新型冠狀病毒實時熒光RT-PCR檢測的性能驗證
何呂芬 李沙 利振坤 李歡 王立程 符曉瑩 黎元莉 陳海 陳少金 朱雄
2019年12月以來,湖北省武漢市陸續發現多起新型冠狀病毒[后來更新為嚴重急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)]感染后引起新型冠狀病毒肺炎(coronavirus disease2019,COVID-19)的病例,隨后疫情迅速蔓延至全國各省市。SARSCoV-2屬于β屬冠狀病毒,有包膜,顆粒呈圓形或橢圓形,常為多形性,直徑60~140 nm。其基因特征與嚴重急性呼吸系統綜合征冠狀病毒(Severe Acute Respiratory Syndrome Coronavirus,SARSCoV)和中東呼吸綜合征冠狀病毒(Middle East Respiratory Syndrome Coronavirus,MERS-CoV)有明顯區別。目前研究顯示SARS-CoV-2與蝙蝠SARS樣冠狀病毒(bat-SL-COVZC45)同源性達85%以上[1]。該病作為急性呼吸道傳染病已納入《中華人民共和國傳染病防治法》規定的乙類傳染病,按甲類管理。隨著對疾病認識的不斷深入,我國先后發布了《新型冠狀病毒感染的肺炎診療方案》及《新型冠狀病毒感染的肺炎防控方案》等規范性文件,并已進行了多次更新[2-3]。
病原學檢測是診斷COVID-19的金標準。由于病毒測序技術對人員、設備要求較高[4],因此采用RT-PCR技術檢測核酸是目前確診SARS-CoV-2最為廣泛的方法。ISO15189是國際醫學界普遍承認并遵照執行的關于醫學實驗室質量和能力方面要求的國際標準。2019年2月15日最新發布的CNAS-GL039[5]文件由中國合格評定國家認可委員會制定,是對CNAS-CL02:2012《醫學實驗室質量管理和能力認可準則在分子診斷領域的應用說明》中有關分子診斷相關檢驗程序進行性能驗證實驗所做的具體解釋和指導。
1 材料與方法
1.1 臨床樣本
選取2020年1月25日至2020年2月24日在三亞市人民醫院檢測的SARS-CoV-2核酸陽性和陰性樣本所有患者均已鑒知情同意書及通過醫院倫理委員會。
1.2 試劑與儀器
核酸提取或純化試劑盒(批號:2019004)、2019新型冠狀病毒(ORF1ab/N)核酸檢測試劑盒(批號:20200123)、DA3200核酸提取儀,均購自中山大學達安基因股份有限公司;ABI 7500型PCR儀購自美國Thermo Fisher Scientific。
1.3 檢測方法
按試劑盒說明書操作,擴增反應條件為:50℃15 min;95℃15 min;94℃15 s;55℃45 s;共45個循環,在55℃采集熒光信號。
1.4 判斷標準
根據試劑盒要求,結果判斷標準如下:①如果檢測樣本在ORF1ab和N基因通道無擴增曲線或Ct值>38,判為SARS-CoV-2陰性;②如果檢測樣品在ORF1ab和N基因通道Ct值≤38,且有明顯的擴增曲線,判為SARS-CoV-2陽性;③如果檢測樣品在ORF1ab或者N基因通道Ct值≤38,另一通道無擴增曲線,建議復檢,復檢結果與原結果一致,判為SARS-CoV-2陽性。
1.5 性能驗證方法及指標
1.5.1 精密度評估
選取4例咽拭子,其中SARS-CoV-2核酸陽性3例(S1、S2、S3),陰性1例(S4)。批內精密度試驗,在同一批試驗中重復檢測20次;批間精密度試驗,重復測定5次,連續測定4 d,共計測定20次。要求變異系數(CV)≤5%,陰陽性符合率均>95%,則精密度符合要求。
1.5.2 準確度評估
選取經海南省COVID-19診斷專家組確診為COVID-19患者的咽拭子10例和三亞市疾控中心已確認的5例咽拭子(SARS-CoV-2陽性3例、陰性2例)進行檢測,分析結果的一致程度,陰陽性符合率>95%,則準確度符合要求。
1.5.3 最低檢測下限評估
將1例SARS-CoV-2核酸濃度為2.33×106copies/mL的咽拭子樣本分別稀釋為1×106、1×105、1×104、1×103、1×102copies/mL,核酸提取后,進行雙重實時熒光RT-PCR反應體系的靈敏度測試,初步測試該方法的靈敏度范圍,再進一步各進行10個重復測試確定最低檢測下限,計算各濃度檢出率,100%檢出率的最小值為檢測下限。
1.5.4 特異性評估
將冠狀病毒(OC43、NL63、229E、HKU1)、甲型流感病毒、乙型流感病毒、肺炎鏈球菌、結核分枝桿菌、金黃色葡萄球菌、白色念珠菌、人巨細胞病毒、MERS冠狀病毒樣顆粒、SARS冠狀病毒樣顆粒分別加入到SARS-CoV-2陰性的咽拭子樣本中,同時各以1例陰性和陽性樣本為陰陽性對照,各重復檢測3次。可接受性能標準:不應出現陽性擴增曲線或Ct值。
1.5.5 內源性干擾評估
選取1例SARS-CoV-2核酸陽性的咽拭子樣本分成4份,各200μL,每份樣本加入正常人紅細胞0、6、10、12μL,紅細胞濃度分別是0%、3%、5%、6%,提取核酸后進行復孔擴增,重復5次,要求變異度(CV)≤5%,并評判符合性。
1.6 統計學方法
采用Excel和SPSS 19.0統計軟件進行數據分析,計算計量資料的均數、方差、標準差和CV值。
2 結果
2.1 精密度驗證
批內精密度試驗中,SARS-CoV-2樣本陽性3例(S1、S2、S3),重復測定20次,ORF1ab基因通道的Ct值的平均值分別是23.19、30.06、33.87,其變異系數CV分別是1.21%、1.52%、1.49%;N基因通道的Ct值的平均值分別是23.19、29.07、33.11,其變異系數CV分別是1.34%、1.54%、1.46%。批間精密度試驗中,SARS-CoV-2樣本陽性3例(S1、S2、S3),重復測定5次,連續測定4 d,ORF1ab基因通道的Ct值的平均值分別是23.30、30.01、33.98,其變異系數CV分別是2.05%、1.97%、2.05%;N基因通道的Ct值的平均值分別是23.16、28.96、33.07,其變異系數CV分別是2.09%、1.92%、1.91%。精密度試驗的陰性、陽性符合率均為100%,所有通道的Ct值的變異系數CV<5%,精密度符合性能驗證標準。
2.2 準確性驗證
15例樣本進行檢測結果顯示:13例為SARS-CoV-2陽性,ORF1ab基因通道的Ct值為22.40~35.62,N基因通道的Ct值為21.31~37.25,Ct值均<38,且有明顯的擴增曲線;2例陰性,在ORF1ab和N基因通道均無擴增曲線。與海南省COVID-19診斷專家組和三亞市疾控中心的結果一致,陽性和陰性樣本符合率均為100%,其準確性符合性能驗證標準。
2.3 最低檢測下限
濃度為10倍差梯度(1×106~1×103copies/mL)的SARS-CoV-2樣本,ORF1ab和N基因檢測通道均有明顯擴增曲線,且Ct值均<38;1×102copies/mL SARS-CoV-2樣本,雙基因通道雖然存在熒光信號和擴增曲線,但ORF1ab和N基因Ct值分別是:38.23、40.75,見圖1。因此,采用濃度為1×103、5×102、2×102copies/mL的SARS-CoV-2樣本,各重復測試10次。1×103copies/mL SARS-CoV-2樣本雙基因通道的Ct值均<38,檢出率均為100%,見圖2;5×102copies/mL SARS-CoV-2樣本雙基因通道雖然存在熒光信號和擴增曲線,但ORF1ab和N基因檢出率分別是90%、80%。見圖3。
2.4 特異性驗證
除SARS-CoV-2陽性樣本有擴增曲線外,其它均無擴增曲線,表明該檢測體系具有較好的特異性,見圖4。
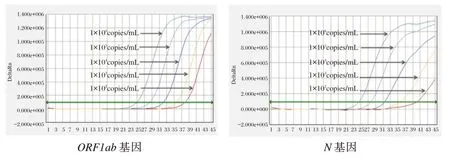
圖1 雙重實時熒光RT-PCR體系靈敏度測試擴增曲線Figure 1 Amplification curves of dual real-time fluorescent RT-PCRsystem sensitivity

圖2 1×103 copies/mL SARS-CoV-2樣本雙重實時熒光RT-PCR擴增曲線Figure 2 Dual real-time fluorescence RT-PCRamplification curves of 1×103 copies/mL SARS-CoV-2 samples
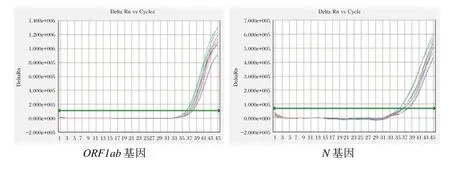
圖3 5×102 copies/mL SARS-CoV-2樣本雙重實時熒光RT-PCR擴增曲線Figure 3 Dual real-time fluorescence RT-PCR amplification curves of 5×102 copies/mL SARS-CoV-2 nucleic samples
2.5 內源性干擾

圖4 雙重實時熒光RT-PCR反應特異性擴增曲線Figure 4 Amplification curves of dual real-time fluorescent RT-PCR reaction specificity
紅細胞濃度分別為0%、3%、5%、6%的SARSCoV-2的陽性樣本,復孔擴增,重復5次,ORF1ab基因通道的Ct值的平均值分別是32.10、33.44、32.94、30.68,其變異系數CV分別是1.37%、2.57%、2.29%、2.00%;N基因通道的Ct值的平均值分別是30.81、32.03、31.56、29.18,其變異系數CV分別是1.03%、2.72%、2.05%、0.88%。所有通道Ct值的變異系數CV<5%,符合率均為100%,表明不存在明顯的內源性干擾,驗證結果通過。
3 討論
分子生物學方法敏感性高,特異性強,已逐漸成為病毒檢測的主要方法。RT-PCR是最常用的分子生物學檢測方法之一,廣泛應用于臨床疾病的診斷、療效評估和預后檢測[6-8]。依據ISO15189和CNAS-GL039性能評價,新試劑和新項目應用于臨床檢測前必須對其檢測體系進行嚴格的方法學評價和性能驗證,定性項目至少對準確度、檢測下限、特異性及抗干擾能力進行驗證。
檢測系統良好的精密度是進行其他方法學驗證實驗的前提[9-10]。本研究結果顯示,精密度試驗的陰性和陽性符合率均為100%,ORF1ab和N基因通道的Ct值的CV值均小于5%,表明試劑盒重復性高,隨機誤差小。內源性抗干擾能力CV值均小于5%,表明試劑盒抗干擾能力良好。與冠狀病毒(OC43、NL63、229E、HKU1)、甲型流感病毒、乙型流感病毒、肺炎鏈球菌、結核分枝桿菌、金黃色葡萄球菌、白色念珠菌、人巨細胞病毒等無交叉反應,因條件限制,未能獲取MERS-CoV和SARS-CoV,使用MERS和SARS冠狀病毒樣顆粒進行實驗,尚不能說明與MERS-CoV和SARS-CoV無交叉反應,但試劑廠家前期的研發結果顯示:與MERS-CoV和SARS-CoV無交叉反應。因此,RT-PCR檢測方法靈敏度高,重復性好,抗干擾力強,檢測下限和特異性均符合要求,可用于臨床檢測。
SARS-CoV-2核酸結果受多因素影響,如采樣標本是否合格、操作是否規范、檢測試劑盒本身敏感性等問題,臨床上若出現鼻、咽拭子陰性而流行病學史、癥狀或影像學表現高度疑似COVID-19的患者,建議同時采下呼吸道樣本進行核酸檢測,選擇不同的檢測試劑,或者增加檢測次數[11-12]。
綜上所述,本研究依據ISO 15189和CNASGL039文件,對SARS-CoV-2核酸檢測試劑盒進行性能驗證,嚴把質量控制關,有助于規范SARSCoV-2實時熒光RT-PCR檢測的實驗室質量管理,提高SARS-CoV-2檢測結果的可靠性、穩定性和準確性。

