再生障礙性貧血患者CD4+T細胞中共刺激分子和免疫抑制受體的表達特點和意義*
郁 志 , 黃桂璇, 張玉平, 陳小惠, 沈 琦, 陳存特,譚廣銷, 曹長姝, 李揚秋, 李 萡△
(1暨南大學附屬第一醫院血液內科,2暨南大學基礎醫學院血液學研究所,廣東廣州510632;3廣州市第一人民醫院,華南理工大學附屬第二醫院血液內科,廣東廣州510180;4深圳市人民醫院,暨南大學第二臨床醫學院血液內科,廣東深圳518020;5暨南大學基礎醫學院解剖學系,廣東廣州510632)
再生障礙性貧血(aplastic anemia,AA)是一種主要以T細免疫介導造血干/祖細胞破壞引起骨髓造血功能衰竭的血液系統疾病。AA 在我國發病率為7.4/106人,遠遠高于歐美國家[1]。
T 細胞活化需要雙信號(第一信號和第二信號)共同作用。第二信號主要包括共刺激分子和免疫抑制受體,其中共刺激分子包括CD28、CD27、OX40、4-1BB、糖皮質激素誘導的腫瘤壞死因子受體(glucocorticoid-induced tumor necrosis factor receptor,GITR)、可誘導T細胞共刺激分子(inducible T cell costimulator,ICOS)、皰疹病毒侵入介質(herpesvirus entry mediator,HVEM)等,免疫抑制受體包括程序性死亡蛋白1(programmed cell death protein-1,PD-1)、細胞毒性T 淋巴細胞相關抗原4(cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)、淋巴細胞活化基因3(lymphocyte activation gene-3,LAG-3)、含T 細胞免疫球蛋白和黏蛋白結構域蛋白3(T-cell immunoglobulin and mucin domain-containing protein-3,TIM-3)等[2-4]。這些正性或負性調控T 細胞活化的第二信號分子是保證恰當、有效T 細胞免疫應答的必要因素。
CD4+T細胞與AA 的發病有一定關系,目前有關AA 患者CD4+T細胞中第二信號分子的研究并不多,因此通過系統分析AA 患者CD4+T 細胞參與T 細胞活化調控第二信號分子的特點將為全面了解AA 的T細胞免疫發病機制提供基礎研究數據。
材 料 和 方 法
1 樣本資料
共收集12 例健康成人(healthy individuals,HI)外周血(其中男性8 例,女性4 例,中位年齡38 歲)作為對照組,16 例AA 患者[包括5 例非重型再生障礙性貧血(non-severe aplastic anemia,NSAA)、5 例重型再生障礙性貧血(severe aplastic anemia,SAA)和6例極重型再生障礙性貧血(very severe aplastic anemia,VSAA),其中男性9 例,女性7 例,中位年齡30 歲]外周血作為實驗組。收集這些外周血樣本時已告知本人,并通過暨南大學附屬第一醫院倫理委員會批準。
2 主要試劑與儀器
CD3-FITC(HIT3a)、CTLA-4-BV421(BNI3)、GITR-PerCP/Cy5.5(108-17)和HVEM-APC(TR2)抗體購自 BioLegend;CD4-APC-H7(RPA-T4)、OX40-PE(ACT35)、4-1BB-BV421(4B4-1)、ICOS-PE(DX-29)、TIM-3-Alexa Fluor(7D3)和 LAG-3-PE(T47-530)抗體購自BD Biosciences;紅細胞裂解液購自BD Biosciences;細胞染色緩沖液購自BioLegend。FACSVerse流式細胞儀為BD Biosciences產品.
3 流式細胞術檢測
3.1 CD4+T 細胞中共刺激分子檢測 根據本實驗室流式細胞術檢測常規方法,配制預混液等試劑后[5],分別取2個流式管(A:對照管;B:全染管),每管加入 200 μL 的健康人或 400 μL 的 AA 患者外周血,各管中加入相當于10 倍外周血體積的紅細胞裂解液,混勻,室溫避光放置10 min,隨后使用350×g離心 5 min。棄上清,加入 2 mL 的 1× PBS 洗滌,350×g離心5 min,棄上清,重復一次。棄上清,加入50 μL的細胞染色液緩沖液重懸細胞,形成單細胞懸液,在A 管中加入配好的抗體預混液(包含有流式抗體CD3 1 μL,CD4 1 μL,OX40-ISO 20 μL,GITR-ISO 5 μL,4-1BB-ISO 5 μL,ICOS-ISO 20 μL,HVEM-ISO 20 μL);同樣,在B 管中加入抗體預混液(包含流式抗體 CD3 1 μL,CD4 1 μL,OX40 20 μL,GITR 5 μL,4-1BB 5 μL,ICOS 20 μL,HVEM 20 μL);輕輕混勻,室溫下避光孵育20 min。上述流式管中加入2 mL 的 1× PBS,350×g離心 5 min,棄上清,再重復一次。棄上清,據細胞數情況在管中加入300~500 μL的細胞染色緩沖液重懸細胞,使用流式細胞儀檢測細胞。
3.2 CD4+T 細胞中免疫抑制受體檢測 該檢測中外周血紅細胞裂解及單細胞懸液制備方法同上。在A 管中加入抗體預混液(包含流式抗體CD3 1 μL 和CD4 1 μL);同樣,在B 管中加入抗體預混液(包含流式抗體CD3 1 μL,CD4 1 μL,TIM-3 5 μL,CTLA-4 5 μL,LAG-3 5 μL);輕輕混勻,室溫下避光孵育20 min(TIM-3、LAG-3 和 CTLA-4 的流式圈門選用 FMO對照)。之后洗滌及重懸細胞流式細胞儀檢測細胞步驟同上。收集CD4+T細胞中共刺激分子和免疫抑制受體流式細胞術檢測原始數據后,采用FlowJo 軟件(Becton,Dickinson and Company)進行分析。
4 統計學處理
使用SPSS 25.0 進行統計學分析。各組數據均用箱圖(box plot)表示:箱(box)中的橫線表示中位數(median);箱的上、下邊(ends)分別表示上、下四分位數(quartiles);上、下誤差線(whiskers)分別表示最大值(maximum)和最小值(minimum)。組間差異采用非參數秩和檢驗(Mann-Whitney 檢驗)。以P<0.05為差異有統計學意義。
結 果
1 AA患者外周血CD4+T細胞中共刺激分子比例
12 例健康人外周血中CD4+T 細胞中OX40、ICOS、4-1BB、GITR 和 HVEM 的比例依次為 3.26%、2.40%、1.39%、25.95%和49.60%;16 例AA 患者(5例 NSAA、5 例 SAA 和 6 例 VSAA)外周血 CD4+T 細胞上述信號分子的比例依次為8.01%、2.44%、1.16%、11.55%和82.20%。AA患者外周血中CD4+OX40+T細胞比例顯著高于健康人,而CD4+GITR+T 細胞的比例顯著低于健康人(P<0.01);不同病情程度AA 患者CD4+GITR+T 細胞比例均顯著低于健康人(P<0.05);SAA 和 VSAA 患者 CD4+OX40+T 細胞比例均顯著高于健康人(P<0.05);VSAA 患者CD4+HVEM+T細胞顯著高于健康人(P<0.05),見圖1。
2 AA患者外周血CD4+ T細胞免疫抑制受體比例
健康人外周血 CD4+T 細胞中 TIM-3、LAG-3 和CTLA-4 的比例依次為4.47%、1.37%和4.27%;而AA 患者外周血CD4+T 細胞的比例依次為7.85%、1.72%和5.38%。AA 患者外周血CD4+T 細胞中TIM-3、LAG-3 和CTLA-4 的比例與健康人相比均無顯著差異,不同病情程度AA 患者與健康人,以及不同病情程度AA 患者之間上述分子的表達亦無顯著差異,見圖2。
討 論
目前普遍認為AA 是異常T 細免疫介導的自身免疫性疾病,多項研究表明AA 中存在異常T 細胞活化[6]。T 細胞活化需要雙信號,其中第二信號又包括共刺激分子和免疫抑制受體,這是兩類執行不同調控功能的信號分子。共刺激分子促進T 細胞活化,而免疫抑制受體起到“剎車”的作用,控制T 細胞不發生過度活化。因此,二者之間的平衡可保證機體的正常T 細胞免疫功能,這個平衡一旦打破,將會引起T 細胞免疫缺陷或T 細胞免疫亢進[7]。我們前期研究也發現AA 患者外周血中與T 細胞活化的TCR/CD3復合物各組成基因(CD3γ、CD3δ、CD3ε和CD3ζ)和第二信號分子CD28 的mRNA 表達升高并參與調控轉錄后調控機制對CD3ζ表達影響[8-10]。
CD4+T 細胞又稱輔助性T 細胞,其主要功能是促進B 細胞、T 細胞和其它免疫細胞增殖和分化,協調不同類型免疫細胞之間的相互作用。根據所分泌細胞因子的不同特點,CD4+T 細胞大致可以分為Th1、Th2、調節性 T 細胞和Th17 細胞亞群,最近還檢測到 Th9、Th22 和 Tfh 等細胞亞群[11]。AA 中異常CD4+T 細胞研究發現Th1 免疫格局偏移,調節性T 細胞數量和功能異常以及Th17 細胞數量異常等[12-14]。有關AA 中CD4+T 細胞異常T 細胞活化第二信號分子的研究不多,我們前期研究也提示不同病情程度AA 患者 CD4+CD27+T 細胞比例均顯著升高[15]。有報道顯示 AA 患者 CD4+PD-1+T 細胞的比例升高[16]。因此,本研究全面分析了AA患者中CD4+T細胞多種第二信號分子的變化。
OX40 屬于腫瘤壞死因子受體超家族成員,主要在活化的T 細胞上表達,在CD4+T 細胞上表達更高。OX40 與其配體OX40L 識別后,促進T 細胞增殖和存活[17]。本研究結果表明 AA 患者 CD4+OX40+T 細胞比例顯著高于健康人,而且在SAA 和VSAA 患者中更高,結果說明AA 患者CD4+T 細胞中OX40 可能與T細胞過度活化有關。
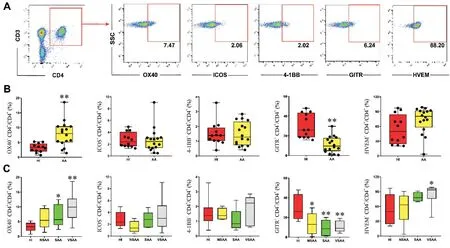
Figure 1.The expression features of co-stimulatory molecules in peripheral blood CD4+ T cells of AA patients.A:the logic diagram of flow cytometry for detecting CD4+ OX40+,CD4+ ICOS+,CD4+ 4-1BB+,CD4+ GITR+ and CD4+ HVEM+ T cells;B:the proportion of CD4+ OX40+,CD4+ ICOS+,CD4+ 4-1BB+,CD4+ GITR+ and CD4+ HVEM+ T cells in peripheral blood of healthy individuals(HI)and AA patients;C:the proportion of CD4+OX40+,CD4+ICOS+,CD4+4-1BB+,CD4+GITR+and CD4+HVEM+T cells in peripheral blood of HI and different degree of AA patients.The data were expressed as box plot,including median,first quartile,third quartile,minimum and maximum. n=12 in HI group;n=16 in AA group(n=5 in NSAA and SAA,n=6 in VSAA).*P<0.05,**P<0.01 vs HI group.圖1 AA患者外周血CD4+T細胞共刺激分子的表達
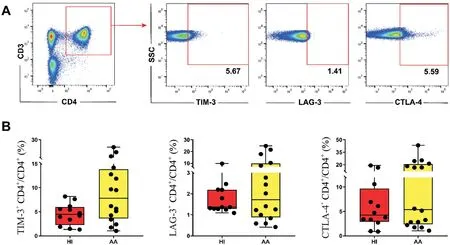
Figure 2.The expression features of immune inhibitory receptors in peripheral blood CD4+ T cells of AA patients.A:the logic diagram of flow cytometry for detecting CD4+ TIM-3+,CD4+ LAG-3+ and CD4+ CTLA-4+ T cells;B:the proportion of CD4+TIM-3+,CD4+LAG-3+and CD4+CTLA-4+T cells in peripheral blood of healthy individuals(HI)and AA patients.The data were expressed as box plot,including median,first quartile,third quartile,minimum and maximum. n=12 in HI group;n=16 in AA group.圖2 AA患者外周血CD4+T細胞中免疫抑制受體的表達
HVEM 也屬于腫瘤壞死因子受體超家族成員,HVEM 高水平表達于初始和活化的T 細胞。根據所結合的配體不同,HVEM 對T 細胞活化的調控起到“雙面”調節作用,既可以發揮正性調控,也可以發揮負性調控。HVEM 在T 細胞上與LIGHT 結合是促進T 細胞活化,而與 CD160 和 BTLA 的結合則抑制 T 細胞活化[18]。本研究僅在VSAA 患者中觀察到CD4+HVEM+T 細胞比例顯著高于健康人,至于HVEM 在VSAA 患者中異常T 細胞活化中的具體作用,需要今后從其所結合的配體去探討。
GITR 同樣屬于腫瘤壞死因子受體超家族成員。初始T 細胞上GITR 表達水平不高,T 細胞活化24 h后GITR 表達迅速增加。GITR 與其配體GITRL 促進T 細胞活化/分化及存活,而且還可參與介導白細胞黏附和遷移[19]。此外,GITR 在調節性T 細胞中組成性表達,調節T 細胞中GITR 與一些自身免疫性疾病有關[20]。本研究檢測顯示不同病情程度AA 患者CD4+GITR+T 細胞比例均顯著降低,這首先說明CD4+GITR+T 細胞比例下降是所有AA 患者的一個共性變化特點。另外,結合有關AA 患者調節性T 細胞中 GITR 未見明顯改變的報道[21],也說明 AA 患者CD4+GITR+T 細胞比例降低可能主要發生在其他CD4+T 細胞亞群,比如 Th1、Th2 或者 Th17 細胞亞群。鑒于這些T 細胞亞群在AA 中特點,我們下一步將主要分析Th1 細胞亞群中GITR 的特點,以期最終明確AA 患者CD4+T 細胞中GITR 在異常T 細胞活化中的作用。
AA 患者中其他共刺激信號分子,如4-1BB 和ICOS,以及免疫抑制受體CTLA4、LAG-3、TIM-3 并未發生顯著變化。但是我們觀察到所分析的3 個免疫抑制受體呈現升高的趨勢。本研究所分析的共刺激分子和免疫抑制受體的結果間接提示AA 患者異常CD4+T 細胞活化可能與某些共刺激信號分子,如OX40、HVEM和GITR等密切相關。由于本研究所涉及樣本例數不多,今后需要進一步加大樣本量觀察上述參與T 細胞活化調控分子在AA 患者CD4+T 細胞中的特點。同時SAA 和VSAA 患者中CD4+OX40+T 細胞比例升高,以及HVEM 在VSAA 患者中的特點也說明不同病情程度AA 患者中共刺激分子存在差異變化特點,通過對T 細胞活化第二信號分子的分析,明晰不同病情程度AA 患者的特征性改變,為今后臨床AA 免疫抑制治療療效評估也提供了一些參考資料。另外,我們將跟蹤分析經免疫抑制治療后AA 患者共刺激分子和免疫抑制受體的變化,也為免疫抑制治療后AA 患者上述信號分子的變化特點積累基礎資料。總之,本研究首次報道了AA 患者CD4+T 細胞中參與調控T 細胞活化的多個第二信號分子的情況(總結示意圖見圖3),為今后更為全面了解AA 中CD4+T 細胞異常免疫狀態提供了新的基礎研究資料。
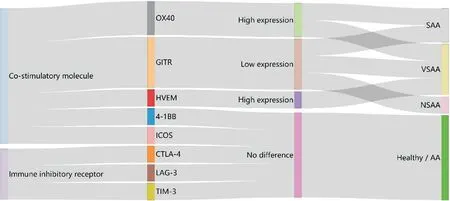
Figure 3.The schematic diagram of expression of co-stimulatory molecules and immune inhibitory receptors in CD4+ T cells from AA patients.圖3 AA患者CD4+T細胞共刺激分子和免疫抑制受體表達情況示意圖

