農桿菌介導的冷誘導基因水稻遺傳轉化體系的建立
崔永禎,趙 紅*,黃 格,鄭愛清,李社萍**,李 鳴
(1.云南省農業科學院 糧食作物研究所,云南 昆明 650205;2.廣西農業科學院 甘蔗研究所,廣西 南寧 530005)
低溫冷害作為糧食生產中最嚴重的自然災害之一,給糧食生產造成了巨大的經濟損失,也是水稻高產、穩產的一個主要制約因素[1,2]。開展水稻耐冷性育種是解決水稻冷害問題的關鍵,而利用轉基因技術將外源耐冷基因導入水稻以期培育有較強耐冷性的水稻品種是值得探索的課題。隨著對耐冷相關基因及其功能的深入研究,學術界普遍認為植物冷調節基因(COR)是目前研究調控機理最為清楚的基因之一[3]。Artus等通過研究擬南芥的耐冷基因Atcor15a發現,該基因在一定程度上提高了轉基因擬南芥植株的耐冷性[4]。司婧等將高山冷芥耐冷基因Cbcor15a轉入煙草的愈傷組織,明顯提高了轉基因煙草植株的耐冷性和耐凍性[5]。滕征等通過將外源耐冷基因Cbcor15a轉入甘蔗愈傷組織中,獲得了轉基因甘蔗陽性植株[6]。將外源耐冷基因Cbcor15a導入水稻品種,以提高水稻耐冷性的研究在國內外尚未見報道。本研究以Bar基因為篩選標記,采用農桿菌介導法將高山離子芥的冷誘導基因Cbcor15a導入水稻品種日本晴,以期獲得具有耐冷性的水稻品種。
1 材料與方法
1.1 實驗材料
冷誘導基因Cbcor15a由蘭州大學生命科學院安黎哲教授提供。水稻品種日本晴、質粒pCAMBIA3300、質粒pMD-COR、大腸桿菌菌株DH5α,以及根癌農桿菌菌株EHA105均由亞熱帶農業生物資源保護與利用重點實驗室提供。乙酰丁香酮(AS)、卡那霉素(Kan)、利福平(Rif)、氨芐青霉素(Amp)、植物凝膠等均購自Sigma公司;頭孢霉素(Cef)購自上海生工公司;Gel Red熒光染料購自Biotiμmol/L公司;PCR耗材、試劑、Marker、Taq酶、質粒提取與純化試劑盒等均購自TaKaRa公司;PCR引物合成及基因測序均由上海生工公司完成;其他常用試劑主要購自上海生工公司。
1.2 培養基
本實驗所用的培養基及其配方如表1所示。

表1 水稻品種日本晴遺傳轉化體系所用的培養基配方
1.3 愈傷組織的制備及預培養
選取水稻品種日本晴健康飽滿的成熟種子作為研究對象。剝去種子的外穎和內穎,用75%乙醇消毒法對種子表面進行消毒[7]。將消毒后的種子置于誘導培養基上,在(28±2)℃下24 h全光照培養2周,使之長出胚性愈傷組織。選擇生長較好、淡黃色、致密、相對干燥的胚性愈傷組織,用刀片將胚性愈傷組織與胚乳、芽、根和盾片分離后,轉入誘導愈傷組織培養基,進行繼代培養1周。選擇相對干燥、致密的胚性愈傷組織,將愈傷組織切成直徑約0.5 cm的小塊,接入預培養培養基,在26 ℃下暗培養3 d。
1.4 農桿菌介導菌液的制備
用劃線接種法將含有目的基因Cbcor15a的pCAMBIA-COR載體[8]的農桿菌菌株接種到YEP固體篩選培養基(含有Rif和Kan)上,在28 ℃下培養2 d;然后將活化的菌株轉移至AAM懸浮培養基中,置于28 ℃恒溫搖床,以200 r/min的轉速振蕩培養3.5 h;最后使用分光光度計將菌液濃度OD600值調至0.8和1.0之間,以備侵染。
1.5 農桿菌侵染愈傷組織
在超凈工作臺上,挑選生長活力較好的水稻愈傷組織作為農桿菌的侵染對象。用鑷子輕輕取出待侵染的愈傷組織,在干燥的無菌濾紙上放置1 h左右,至愈傷組織表面干燥,且略有收縮;然后將愈傷組織浸泡在含有誘導劑乙酰丁香酮(Acetosyringone, AS)100 μmol/L和農桿菌(OD600=0.8~1.0)的AAM轉化液中,于搖床上緩慢搖動20 min;然后將愈傷組織取出并置于干燥的無菌濾紙上,在無菌條件下吹至愈傷組織表面無水漬,略微干燥;最后將愈傷組織接入共培養培養基,在25 ℃下暗培養3 d。
1.6 除草劑敏感性實驗
除草劑Phosphinothricin (PPT)會明顯抑制水稻愈傷組織的生長,高濃度的PPT使水稻愈傷組織出現嚴重的褐化現象,甚至死亡。轉化植株因含有Bar基因(抗除草劑基因)而對除草劑具有很好的抗性,故PPT是水稻遺傳轉化中比較理想的一種篩選劑。選擇生長良好、繼代培養兩次的水稻愈傷組織進行PPT敏感性實驗。本實驗設置PPT濃度分別為0、2、5、10、15、20、25、30 mg/L的L3繼代培養基,在26 ℃下暗培養2周,根據愈傷組織的生長和褐化情況,確定適合水稻愈傷組織的最佳PPT篩選濃度。
1.7 抗生素濃度的篩選
頭孢霉素Cefotaxime Sodium (Cef)可以抑制農桿菌的增殖,使用低濃度的Cef會導致農桿菌大量增殖進而影響愈傷組織生長;而高濃度的Cef則會明顯抑制愈傷組織的生長,故需要篩選出適宜濃度的Cef,使之既能有效抑菌,又不明顯影響水稻愈傷組織的正常生長。本實驗設Cef濃度為300、400和500 mg/L;將侵染后的水稻愈傷組織分別轉移至含有不同濃度Cef 的3種篩選培養基上,在26 ℃下暗培養7 d。根據農桿菌的增殖情況,確定合適水稻愈傷組織的最佳Cef篩選濃度。
1.8 水稻抗性愈傷組織的篩選
將侵染及共培養后的水稻愈傷組織用無菌水清洗5~6次至水澄清透明,然后轉移至含有500 mg/L Cef的無菌水中,浸泡15 min,期間輕緩搖動2~3次;將愈傷組織轉移至無菌、干燥的濾紙上,吹至愈傷組織表面無水漬,略干燥;將愈傷組織轉入含有最佳濃度的Cef和PPT的篩選培養基上進行篩選,在26 ℃下暗培養,每隔2周更換1次培養基,期間及時剔除被污染的水稻愈傷組織;共培養約4周。
1.9 水稻抗性愈傷組織的分化
經過Cef和PPT篩選后,將生長較好的抗性愈傷組織轉移至含有最佳濃度的Cef和PPT的分化培養基上,在28 ℃下以光照16 h/黑暗8 h培養,每隔2周更換1次培養基,待分化出苗后,將高度約3 cm的水稻再生分化苗轉移至壯苗生根培養基,在26 ℃下全光照培養。挑選根系發達、高度約6 cm的水稻再生分化苗進行煉苗,最后將其移栽至水、肥均衡的泥盆中。
1.10 檢測轉化植株
1.10.1 常規PCR檢測 取再生分化苗的幼嫩組織,采用CTAB法提取水稻葉片的總DNA,利用PCR技術檢測再生苗。根據目的基因CbCor15a和篩選標記Bar基因設計1對特異性引物: P1,5′ATGGCGATGTCATTTTCA3′;P2,5′CTTGGTGGCATCCTTAGCA3′。分別以水稻轉化植株的DNA為模板,以pCambia1300-cbcor15a重組質粒為陽性對照模板,未轉化水稻的DNA為陰性對照模板,進行PCR擴增反應。取各PCR產物5 μL,用1%TBE瓊脂糖凝膠電泳進行檢測分析。
1.10.2 用除草劑驗證陽性轉化植株 分別選用Basta濃度為0.050%、0.090%、0.100%、0.125%的除草劑溶液,將其涂抹在未經轉化的空白水稻葉片上,篩選出空白水稻植株葉片正好變黃枯死的除草劑濃度,作為驗證陽性轉基因水稻植株的最適Basta使用濃度,對轉化水稻植株的葉片進行涂抹檢測,在涂抹除草劑約3 d后,葉片變黃枯死的植株為陰性苗,仍為綠色正常生長的植株則為陽性轉化苗。
2 結果與分析
2.1 農桿菌重組菌株EHA105-COR的鑒定
通過PCR檢測經轉化后的農桿菌EHA105是否含有植物表達載體pCAMBIA-COR。隨機挑取8個農桿菌重組單菌落進行PCR檢測,以DL 2000 marker(M)為參照,結果如圖1所示,經擴增均得到目的條帶(423 bp)。實驗結果表明, pCAMBIA-COR已被成功轉入農桿菌中,8個轉化子皆為陽性重組菌株。將陽性農桿菌重組菌株命名為EHA105-COR。
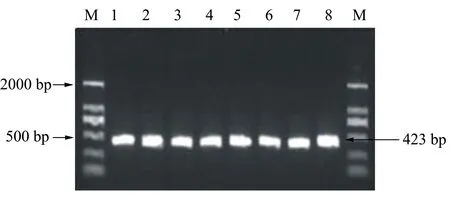
M: DL 2000 marker;1~8:8個EHA105-COR單菌落活化菌液。
2.2 PPT敏感性實驗
使用PPT篩選水稻愈傷組織能夠大大降低假陽性植株的篩選數量,減少后續陽性植株鑒定的工作量,縮短轉化周期。選擇生長良好、繼代培養兩次的水稻愈傷組織進行PPT的敏感性實驗。本實驗設置PPT濃度為0、2、5、10、15、20、25、30 mg/L的L3繼代培養基,在26 ℃下暗培養2周,根據愈傷組織的生長和褐化情況,確定合適日本晴愈傷組織的最佳PPT篩選濃度。由于PPT對不同水稻品種成熟胚的愈傷組織誘發了不同程度的褐化,無法準確計算其褐化率,因此,本實驗用文字描述在不同PPT濃度處理下水稻品種愈傷組織的總體褐化情況。
從表2和圖2中可以看出:在10 mg/L PPT處理下少部分的日本晴愈傷組織開始出現褐化現象;在20 mg/L PPT處理下大部分的愈傷組織出現褐化現象,但仍有小部分的愈傷組織保持黃色;當PPT濃度達到25 mg/L時,日本晴的愈傷組織開始全部褐化。因此,本實驗選用25 mg/L的PPT濃度作為水稻品種日本晴遺傳轉化的最佳篩選濃度。

表2 不同濃度PPT對水稻品種日本晴愈傷組織的影響

圖2 不同濃度PPT對日本晴愈傷組織的影響
2.3 抗生素濃度的篩選結果
本實驗將侵染后的水稻愈傷組織分別轉移至含有300、400和500 mg/L Cef的3種篩選培養基上,在26 ℃下暗培養7 d后,記錄農桿菌的增殖情況。實驗結果(如表3)表明:當Cef濃度為300~400 mg/L時,超過57.5%的愈傷組織被迅速增殖的農桿菌影響;當Cef濃度為500 mg/L時,其可以明顯抑制農桿菌的繁殖,污染率只有9.6%,大多數的愈傷組織可以正常生長(如圖3)。故選擇Cef濃度500 mg/L作為轉化時農桿菌的抑制濃度。
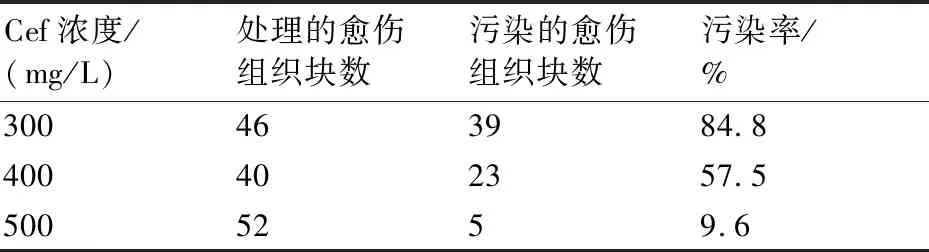
表3 不同濃度Cef對日本晴愈傷組織的影響
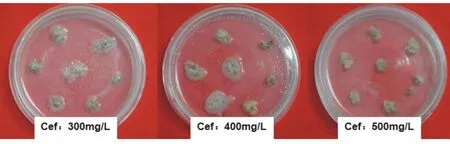
圖3 不同濃度的Cef對日本晴愈傷組織生長的影響
2.4 含Cbcor15a的轉基因水稻的獲得
利用農桿菌介導法轉化獲得了水稻品種日本晴的轉化植株(如圖4所示)。本實驗利用農桿菌侵染處理日本晴愈傷組織220塊,共得到抗性愈傷組織136塊,抗性愈傷組織得率為61.8%,最終獲得日本晴轉化苗9株。
2.5 轉化植株的分子檢測
2.5.1 PCR檢測 以獲得的9株日本晴轉化苗(編號為T01~T09)葉片的總DNA為模板,以P1/P2為引物,以pCAMBIA-COR質粒作為陽性對照模板,以未轉化的日本晴葉片DNA作為陰性對照模板,進行PCR擴增反應。然后分別取PCR產物5 μL,采用1%瓊脂糖凝膠電泳進行檢測。結果(圖5)顯示,有8株日本晴轉化苗擴增得到與目的基因片段大小一致的條帶,初步鑒定獲得8株PCR陽性植株。
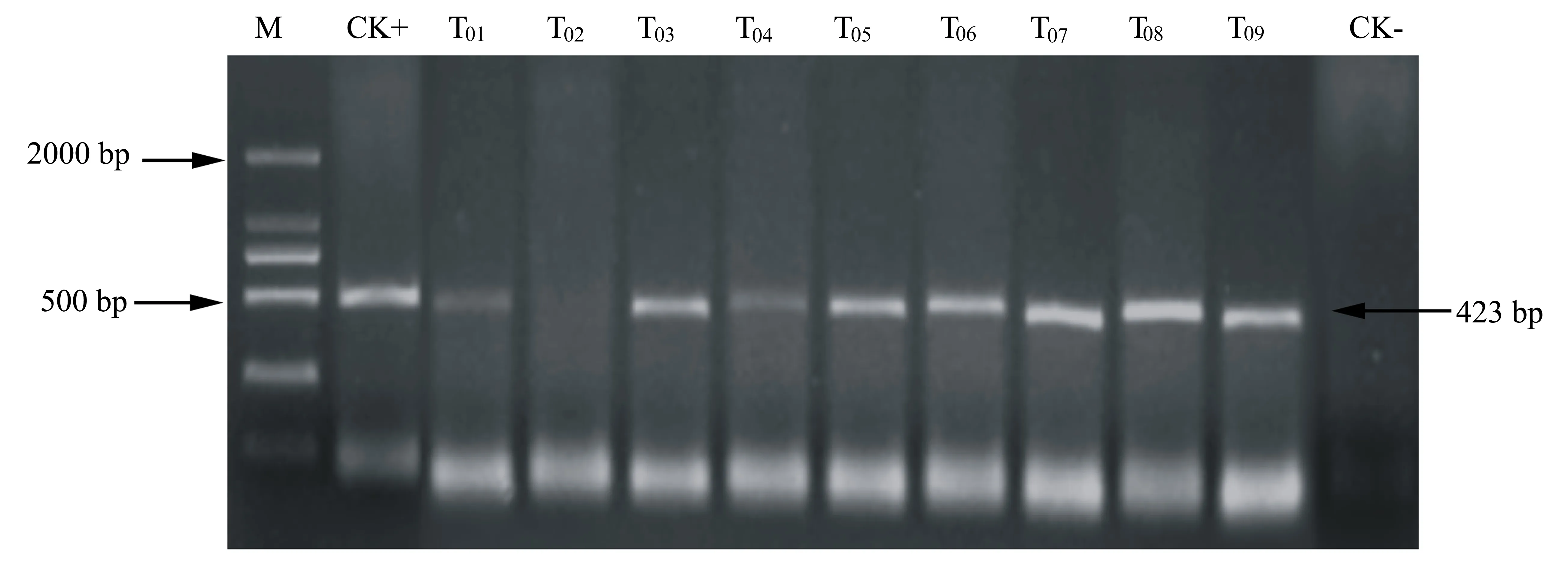
M: DL 2000 marker; CK+: pCAMBIA-COR質粒; CK-:未經轉化的日本晴。
2.5.2 抗除草劑檢測 在本實驗中,轉基因植株由于含有Bar基因篩選標記,而Bar對除草劑具有抗性,由此,可通過選擇合適濃度的除草劑溶液涂抹水稻葉片,觀察葉片是否變黃,初步驗證和篩選轉化植株的陽性轉化苗。分別用0.050%、0.090%、0.100%和0.125%的除草劑Basta溶液涂抹同株未轉化的日本晴葉片,分別編號為1、2、3和4(如圖6所示),篩選出未轉化水稻葉片明顯枯黃的Basta濃度,作為檢測陽性轉化苗的最佳使用濃度。

圖6 Basta濃度的篩選結果
結果顯示,4個Basta溶液濃度對未轉化的日本晴葉片1、2、3和4均造成了不同程度的變黃,其中0.125% Basta溶液對水稻葉片的枯黃致死效果最為明顯。因此,選用0.125% Basta溶液涂抹轉基因植株的葉片,以檢測其抗性。
從圖7可以看出:使用0.125% Basta溶液涂抹后,有6株日本晴轉化植株的葉片無變黃現象,表現出對該除草劑的抗性;有2株轉化植株的葉片明顯變黃,無除草劑抗性。這與經過PCR檢測為陽性的8株轉化苗結果不一致。無除草劑抗性的2株可能是假陽性植株,也可能是轉入拷貝數較低,所以未表現出明顯的除草劑抗性。本實驗結果表明,有除草劑抗性的6株日本晴轉化苗是陽性轉基因日本晴植株。

圖7 轉基因日本晴植株表現出對Basta的抗性
3 討論與結論
水稻傳統的育種方法是雜交育種,但很難快速獲得品質較好的耐冷性水稻品種。基因工程技術的發展為水稻優良品種的快速繁育提供了新的途徑,將目的基因導入并整合到水稻的基因組中,從而在水稻中得到遺傳和表達,可以快速、準確地獲得性狀優良的水稻新品種。利用基因槍法、農桿菌介導法、電擊法研究植物基因轉化已經有成功的報道[9,10]。在已獲得的轉基因植物中,80%以上是利用農桿菌介導法獲得的[11-12]。農桿菌介導法的優點是轉化成本低廉、技術簡單、容易操作;另外,農桿菌介導法因外源基因插入拷貝數低,對受體傷害小,而且可實現大片段DNA的轉化。迄今為止,已在7個科20多種單子葉植物上利用農桿菌轉化基因獲得成功。禾谷類糧食作物水稻、玉米、小麥、大麥等也能被農桿菌感染和轉化[6]。本文以Bar基因為篩選標記,通過農桿菌介導Cbcor15a基因轉化水稻品種日本晴的研究,是利用生物工程改良水稻品種,加快水稻育種進程,縮短育種周期的具體表現。本研究為深入評價利用轉Cbcor15a基因選育具有耐冷性水稻新品種的可行性提供了轉基因材料。
本文以高山離子芥冷誘導基因Cbcor15a為目的基因,以Bar基因為篩選標記,通過農桿菌介導法將目的基因Cbcor15a導入水稻愈傷組織,初步建立了適于水稻品種日本晴的遺傳轉化體系。本實驗結果表明,水稻成熟胚在(28±2)℃、全光照培養條件下,約2周即可獲得適合農桿菌轉化的愈傷組織。對于水稻品種日本晴,篩選時使用Cef 500 mg/L和PPT 25 mg/L,分化時由于Bar基因尚未完全表達,PPT在一定程度上會影響愈傷組織的分化,因此使用15 mg/L PPT較為適合。通過Cef和PPT篩選,本實驗共獲得了日本晴轉化Cbcor15a基因再生苗9株;經PCR檢測和Basta涂抹實驗可以確認,有6株日本晴轉化苗為陽性轉基因植株。

