高通量測序解析白酒中高溫大曲細菌和真菌群落結構
楊 旭 ,馬歌麗,王光路,胡曉龍,張治剛,王永亮,劉智勇,李寶珍
(1.鄭州輕工業大學 食品與生物工程學院,河南 鄭州 450001;2.鄭州市代謝工程和系統生物學重點實驗室,河南 鄭州 450001;3.賈湖酒業集團有限責任公司,河南 漯河 462400;4.鄭州輕工業大學 科技處,河南 鄭州 450001)
近20年來,隨著現代分子生物學技術的發展,不同香型白酒大曲中的微生物(主要是細菌和真菌)種群結構及其組成得到有效解析,如所有香型白酒大曲中均鑒定出乳桿菌屬(Lactobacillus);濃香和醬香型白酒大曲中優勢菌群為芽孢桿菌屬(Bacillus)[1-2];扣囊復膜孢酵母(Saccharomycopsis fibuligera)和總狀橫梗霉(Lichtheimia ramosa)在清香和濃香型白酒大曲中被檢測到;醬香型白酒大曲中特殊微生物為疏棉狀嗜熱絲孢菌(Thermomyces lanugino sus)[3]。由于白酒釀造主要原料高粱中含有的淀粉不能被大多數酵母菌和細菌直接利用,需要通過絲狀真菌產生的α-淀粉酶和糖化酶水解為可發酵糖[4],所以真菌在大曲釀造過程中發揮重要作用。如成熟茅臺風味大曲中檢測出多種真菌:曲霉屬(Aspergillus)、毛霉屬(Mucor)和根霉屬(Rhizopus),總狀毛霉(Mucor racemosus)和嗜熱子囊菌(Thermoascus crustaceus)[5-6]。微生物區系對成品大曲香氣的優劣有著直接的影響[7]。然而,目前微生物群落結構組成的研究大部分集中在濃香、醬香和清香型等主流白酒釀造過程,關于北方不同香型白酒大曲中微生物相關的研究還較少。
高通量測序技術已被廣泛用于分析發酵食品(如白酒、葡萄酒、醋和醬油等)微生物群落的組成[8-10]。基于該技術,本實驗研究了賈湖白酒大曲發酵過程中理化性質和微生物(細菌和真菌)結構的動態變化;確定大曲樣品中細菌和真菌類群的相對豐度和多樣性,對鑒定和判斷大曲制曲過程相關的主要微生物、指導大曲生產,具有重要的意義。
1 材料與方法
1.1 材料與試劑
大曲樣品:河南漯河賈湖酒業集團有限責任公司曲房制作過程中的樣品曲,取樣點為入房(JH1)、第1次翻曲(JH2)、第2次翻曲(JH3)、第3次翻曲(JH4)、出房(JH5)5個點。每次取樣固定為同一點,每次取樣3個曲塊,將樣品粉碎混合為一個區域的綜合樣(實驗樣品),共獲取5個綜合實驗樣品。實驗樣品迅速置于-20 ℃保藏備用。

E.Z.N.ATMMag-BindSoilDNA試劑盒:美國OMEGA公司;Qubit3.0 DNA檢測試劑盒:美國Life公司;2×TaqMaster Mix:南京諾唯贊生物科技有限公司;MagicPureSizeSelection DNA Beads:北京全式金生物有限公司。
1.2 儀器與設備
Heraeus X1R臺式離心機:Thermo Fisher公司;BE-1200漩渦混合器:海門市其林貝爾儀器制造有限公司;TND03-H-H混勻型干式恒溫器:深圳拓能達科技有限公司;DYY-6E型電泳儀電源,DYCP-31C型電泳槽:北京市六一儀器廠;Biodoc-IT凝膠成像系統:美國UVP公司;Qubit3.0熒光計:Invitrogen公司;T100聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國BIO-RAD公司;Research plus 單道可調量程移液器:德國Eppendorf公司。
1.3 方法
1.3.1 大曲水分和酸度測定
按照QB/T 4257—2011釀酒大曲通用分析方法測定大曲水分和酸度。
1.3.2 脫氧核糖核酸提取
稱取200 mg樣品,放入滅菌2 mL離心管中,加入1 mL體積分數70%的乙醇,振蕩混勻,室溫條件下10 000 r/min離心3 min,棄置上層液體。加入磷酸緩沖鹽溶液(phosphate buffer saline,PBS),振蕩混勻,室溫條件下10 000 r/min離心3 min,棄置上層液體。倒置2 mL管于吸水紙上1 min,直至沒有液體流出。將樣品管放入55 ℃烘箱10 min,使殘留酒精完全揮發,保證后續實驗操作。脫氧核糖核酸(deoxyribo nucleic acid,DNA)具體提取步驟參照OMEGA試劑盒E.Z.N.ATM Mag-Bind Soil DNA試劑盒的使用說明書[11]。
1.3.3 16S 核糖體核糖核酸和真菌種屬基因測序及序列分析
16S核糖體核糖核酸(ribosomal ribonucleic acid,rRNA)基因PCR擴增所用的引物為已經融合了Miseq測序平臺的V3-V4通用引物:
341F 引 物:CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG
805R 引 物:GACTGGAGTTCCTTGGCACCCGAGAATTCCA GACTACHVGGGTATCTAATCC
PCR反應條件:95 ℃預變性2 min;95 ℃變性30 s;55 ℃退火30 s;72 ℃延伸30 s,25次循環后,72 ℃延伸5 min,10 ℃保持至停止。
真菌種屬(internal transcribed spacer,ITS)PCR擴增所用的引物為已經融合了Miseq測序平臺的ITS1-2通用引物:
ITS1F 引 物:CCCTACACGACGCTCTTCCGATCTN(barcode)CTTGGTCATTTAGAGGAAGTAA
ITS2R引物:GTGACTGGAGTTCCTTGGCACCCGAGAATTCCA GCTGCGTTCTTCATCGATGC
PCR反應條件:95 ℃預變性2 min;95 ℃變性30 s;55 ℃退火30 s;72 ℃延伸30 s,25次循環后,72 ℃延伸5 min,10 ℃保持至停止。
PCR反應結束后,產物進行瓊脂糖(2%)電泳檢測。回收的DNA利用Qubit3.0 DNA檢測試劑盒精確定量,按照1∶1等量混合后測序。等量混合時,每個樣品DNA量取10 ng,最終上機測序濃度為20 pmol。
1.3.4 生物信息學分析
Illumina MiseqTM得到的原始圖像數據文件經CASAVA堿基識別分析轉化為原始測序序列[12],序列中含有barcode序列,以及測序時加入的引物和接頭序列。首先去除引物接頭序列,再根據雙末端(paired-end,PE)reads之間的overlap關系,將成對的reads拼接成一條序列,然后按照barcode標簽序列識別并區分樣品得到各樣本數據,最后對各樣本數據的質量進行質控過濾,得到各樣本的有效數據。采用軟件Usearch將所有樣本序列按照序列間的距離進行聚類,后根據序列之間的相似性將序列分成不同的操作分類單元(operational taxonomic units,OTUs)[13]。通常在97%的相似水平下的OTU進行生物信息統計分析。將獲得的每個OTU的代表序列與在線數據庫(ribosomal database project,RDP)[14]進行比對,篩選出OTU序列的最佳比對結果,并對比對結果進行過濾,默認滿足相似度>90%且Coverage>90%的序列被用來后續分類[15],確定每個OTU的分類水平,即門、綱、目、科、屬、種水平。
2 結果與分析
2.1 大曲樣品水分和酸度變化
大曲在制備過程中,由于溫度的變化,大曲水分含量逐漸降低,根據大曲質量檢驗標準的相關規定,大曲中的水分含量不能超過13%[16]。由圖1A可知,出房大曲(JH5)水分含量為8.38%(取樣時間為夏季,水分揮發較快)。大曲生產過程中由于水分低的關系生酸量低,常規酸度不會超過1.0。酸度主要是由產酸微生物在大曲中進行有機酸代謝而形成,酸度大小可揭示大曲中產酸微生物的數量多寡,同時也歸因于大曲中脂肪酶和蛋白酶活力強弱[17]。由圖1B可知,大曲在入房時由于代謝旺盛,產酸最高,大曲JH1中酸度達到0.22 mmol/g。酸度的大小和微生物數量變化有很密切的關系,研究表明酸度大小與芽孢桿菌數量有正相關性[18]。本研究結果也證實該結論。在發酵期間,不同時間點大曲樣品芽孢桿菌屬相對豐度分別為2.90%、0.23%、0.10%、0.12%和0.18%,酸度也隨之降低和升高。所以,大曲生產過程中嚴格控制酸度有助于調控和平衡大曲中的微生物組成與數量,同時產生的有機酸還將與醇類化合物反應產生濃郁的白酒風味化合物[19-21]。
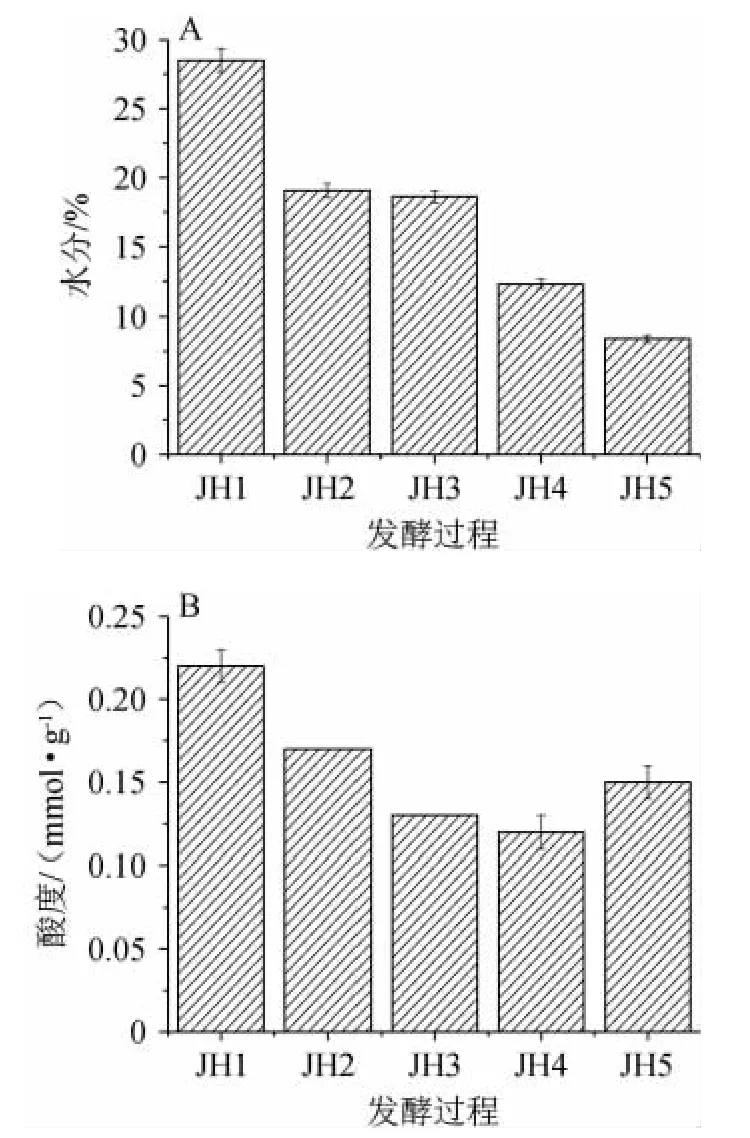
圖2 大曲生產過程中水分(A)和酸度(B)變化Fig.2 Changes in water content and acidity during Daqu fermentation
2.2 大曲微生物OTU多樣性
本研究劃分細菌和真菌OTU 分類信息樣本文庫覆蓋率(Coverage指數)都超過0.97,說明本次測序結果能代表樣本的真實情況,完全能夠反映該區域細菌和真菌群落的種類和結構。由圖2可知,從大曲樣品入房到出房,細菌和真菌微生物多樣性指數(OUT值)表現出先升高后降低的趨勢,并且都在曲溫達到頂溫時(大曲JH3)達到最高值。這也印證了整個培曲過程遵循“前緩、中挺、后緩落”的發酵規律[22],即大曲的培菌、生香轉化主要在40 ℃~60 ℃~40 ℃這一溫度變化區域內進行,因而大曲中富集很多耐高溫微生物,而后續的真菌和細菌群落的詳細分析數據也驗證了該結論。

圖2 DNA測序法測定大曲操作分類單元數目Fig.2 Number of operational taxonomic units in Daqu determined by DNA sequencing
2.3 大曲真菌群落ITS2 rRNA基因序列分析
由圖3A可知,所有大曲樣品中的真菌種群共5個門:子囊菌門(Ascomycota)、毛霉亞門(Mucoromycota)、擔子菌門(Basidiomycota)、被孢霉門(Mortierellomycota)和梳霉門(Kickxellomycota),其中子囊菌門在大曲JH1占主導地位(相對豐度74.03%)。隨著發酵的進行,子囊菌門相對豐度逐漸減少,大曲JH3中減少到最低為26.94%,之后,又逐漸上升至大曲JH5中的47.38%。與之對應的是毛霉亞門的此消彼長,由大曲JH1中的13.14%上升至大曲JH3中的71.47%,逐漸降低至大曲JH5中的36.28%。這可能是由于發酵過程中翻曲操作引起曲塊溫度的變化導致真菌結構的演替:溫度升高有利于毛霉亞門類生長,而對子囊菌門類生長和繁殖有阻礙作用。當曲溫達到頂溫階段(大曲JH3)時,毛霉亞門類相對豐度達到最高,擔子菌門類相對豐度降至最低為0.14%,被孢霉門和梳霉門類已檢測不到,說明絕大多數微生物停止生長。
由圖3B可知,入房大曲JH1中假絲酵母屬(Candida),酵母屬(Saccharomycetales),根霉屬(Rhizopus)和曲霉屬(Aspergillus)是優勢菌屬,其相對豐度占全部真菌群落的74.46%以上,其中最優勢菌屬是假絲酵母屬,約占35.69%,假絲酵母屬是大曲發酵過程重要的真菌之一,主要產酒精和酯類物質[23],而且大量產生酮類、烯類、酚類等揮發性化合物[24],對大曲品質有著決定性的影響。由于入房時溫度較低,霉菌和酵母菌均大量生長,給大曲的多種功能打下基礎。隨著溫度升高,霉菌生長越來越旺盛,其中毛霉屬(Rhizomucor)在大曲JH2、JH3中的相對豐度分別達到21.17%、29.63%,相比較于大曲JH1,同比增加了21.13%、29.59%。當曲溫達到頂溫時,橫梗霉屬(Lichtheimiaceae)成為優勢菌群,相對豐度達到40.60%。在出房大曲JH5中,毛霉屬重新占據優勢,相對豐度達到34.44%,其次是根霉屬和曲霉屬。霉菌被視為大曲糖化降解動力的主要來源,為曲酒的釀造提供糖化力、液化力、蛋白質分解能力及多種有機酸等物質[25-26]。

圖3 大曲樣品中真菌在門(A)和屬(B)分級水平上的種類和相對豐度Fig.3 Types and relative abundance of fungi in Daqu samples at phylum level (A) and genus level (B)
2.3 大曲細菌群落16S rRNA基因序列分析
由圖4A可知,所有大曲樣品中的細菌種群共37個門,其中厚壁菌門(Firmicutes)和變形菌門(Proteobacteria)在大曲JH1占主導地位,其相對豐度占全部細菌群落的97.29%以上。隨著發酵的進行,厚壁菌門相對豐度逐漸增加,在大曲JH3中達到最高為87.27%,之后,又逐漸降低至大曲JH5中的67.97%。與之對應的是變形菌門的此消彼長,由大曲JH1中的18.87%降低至大曲JH3中的1.86%,逐漸增加至大曲JH5中的18.87%。這可能是由于發酵過程中翻曲操作引起曲塊溫度的變化導致細菌結構的演替:溫度升高有利于厚壁菌門類生長,而對變形菌門類生長和繁殖有阻礙作用。當曲溫達到頂溫階段(大曲JH3)時,厚壁菌門類相對豐度達到最高,變形菌門類相對豐度降至最低。
由圖4B可知,入房大曲JH1中分別檢測到乳桿菌屬(Lactobacillus),魏斯氏菌屬(Weissella),葡萄球菌屬(Staphylococcus)、明串珠菌屬(Leuconostoc)、片球菌屬(Pediococcus)、泛菌屬(Pantoea)和芽孢桿菌屬(Bacillus),其中最優勢菌是乳桿菌屬,約占20.10%,乳桿菌屬是白酒生產中非常重要的微生物之一,在釀造過程中具有促進美拉德反應、促進釀酒的發酵、維護與保持釀酒微生態環境等作用[27]。魏斯氏菌屬屬于乳酸細菌,分解葡萄糖產生CO2異型發酵產生乳酸,有利于乳酸乙酯的形成及酒質的穩定,是白酒釀造中的重要微生物之一[28]。當曲溫達到頂溫時,高溫放線菌科克羅彭斯特菌屬(Kroppenstedtia)成為明顯優勢菌群,相對豐度達到60.67%,乳桿菌屬降至最低為15.41%。高溫放線菌科克羅彭斯特菌的發現應該屬于賈湖白酒大曲特殊微生物,結果說明高溫放線菌不單只存在于高溫大曲中,在中低溫大曲中同樣存在。該菌在醬香、濃香等主流香型白酒大曲中都未見報道,只在清香和芝麻香型白酒高溫大曲中被檢測出來[29-30],還可能是因為科克羅彭斯特菌在大曲發酵過程中生存時間較短,不易于取樣檢測。隨著溫度降低,在出房大曲JH5中,科克羅彭斯特菌屬豐度已經降低至0.28%,而乳桿菌屬重新占據優勢,相對豐度達到31.89%。

圖4 大曲樣品中細菌在門(A)和屬(B)分級水平上的種類和相對豐度Fig.4 Types and relative abundance of bacteria in Daqu samples at phylum level (A) and genus level (B)
3 結論
本研究分析了賈湖白酒大曲在整個發酵過程中的理化性質以及真菌和細菌的組成。研究結果得到一個大曲數據庫,包含了5個不同發酵階段獲得的5個樣品的測序數據。大曲樣品從入房到出房,細菌和真菌微生物多樣性指數(OTU值)表現出先升高后降低的趨勢,并且都在曲溫達到頂溫時(大曲JH3)達到最高值。這也印證了整個培曲過程遵循“前緩、中挺、后緩落”的發酵規律,即大曲的培菌、生香轉化主要在40 ℃~60 ℃~40 ℃這一溫度變化區域內進行。賈湖白酒大曲生產過程中發酵前期真菌主要有假絲酵母屬(Candida)、根霉屬(Rhizopus)和曲霉屬(Aspergillus),當曲溫達到頂溫時,橫梗霉屬(Lichtheimiaceae)成為優勢菌群,發酵后期以毛霉屬(Rhizomucor)和曲霉屬為主。賈湖白酒大曲入房和出房樣品中細菌組成變化不大,乳桿菌屬(Lactobacillus)在整個發酵過程中一直存在。在發酵期間,不同時間點大曲樣品芽孢桿菌屬相對豐度分別為2.90%,0.23%、0.10%、0.12%和0.18%,酸度也隨之降低和升高,表明大曲酸度大小與芽孢桿菌數量呈現正相關性。當曲溫達到頂溫時,高溫放線菌科克羅彭斯特菌屬(Kroppenstedtia)成為優勢菌群,相對豐度達到60.67%,該菌屬微生物應該屬于賈湖白酒大曲中特殊微生物之一。細菌和真菌成分的這種動態變化是由大曲生產工藝過程翻曲操作和溫度變化引起的。由于整個發酵過程中未接種發酵劑,這種相對穩定的細菌和真菌結構還可能與發酵環境有關。

