離子色譜法同時測定啤酒中23種糖、糖醇及醇
宋衛得,許美玲,王志宏,張傳杰*,尹相英,孫明芹
(1.日照海關,山東 日照 276800;2.龍口海關,山東 龍口 265700)
啤酒是人們日常生活中的重要飲品,是以啤酒花和麥芽為原料,經糊化、糖化、液態發酵后釀制而成的酒精飲料[1-4]。啤酒釀制過程中會產生多種糖類、糖醇、醇類,它們是啤酒中重要的營養物質和風味物質,直接影響啤酒的口感、風味和品質。糖類化合物是一類多羥基醛或酮,是人體生命活動的能源物質,是許多食品和飲料的重要成分[5-7]。糖醇是糖類的醛基或者酮基被還原后的物質,通常是由對應的糖經過催化氫化而生成的甜味劑,具有預防糖尿病、熱量低、口感好等優點[8-10]。醇類是某些發酵食品中的重要組分,某些醇類有益于人體健康,但是某些醇類如丁二醇,具有一定的毒性[11-12]。因此,啤酒中糖類、糖醇和醇類組分含量的測定具有重要的現實意義。
目前,糖類、糖醇、醇類的檢測方法主要有液相色譜法[13]、液相色譜質譜聯用法[14]、氣相色譜法[15-16]、酶電極法[17]、離子遷移譜法[18]、離子色譜法[19]。液相色譜法通用方便,但靈敏度低,對復雜基質的樣品測定困難;氣相色譜法靈敏度高,但是需要衍生,定量重復性差,不適宜做準確定量分析;酶電極法一般僅對一種糖類進行測定,具有較好的特異性,但是不能進行多組分同時測定;液相色譜質譜聯用法和離子遷移譜法成本較高,廣泛普及應用的難度較大。離子色譜法,是一種簡便、靈敏、準確、可同時分析多類別多組分的技術方法,在食品檢測領域應用廣泛。OWEN B等[20]采用脈沖安培檢測-離子色譜法測定了甘露醇、山梨醇、葡萄糖三種物質;張水鋒等[21]采用脈沖安培-離子色譜方法分析了嬰幼兒乳粉中麥芽糖醇、半乳糖、葡萄糖、蔗糖、果糖、乳糖6種組分,但是研究組分數量較少。
本研究采用積分脈沖安培檢測(integrated pulse amperometric detection,IPAD)-離子色譜(ion chromatography,IC)法,通過深入研究色譜分離的影響因素,優化色譜分析條件,建立了啤酒中23種糖類、糖醇、醇類同時測定的方法,該方法快速、靈敏、準確、選擇性好,解決了當前啤酒中多類別多組分測定時人力物力成本高、檢測效率低的技術難題,且無有毒有害試劑使用,具有良好的經濟價值和環保效益。
1 材料與方法
1.1 材料與試劑
2,3-丁二醇、乙醇、甲醇、丙三醇、赤蘚糖醇、巖藻糖、麥芽糖醇(純度均>98%):上海安譜實驗科技股份有限公司;木糖醇、阿拉伯糖醇、山梨醇、海藻糖、核糖醇、甘露醇、甘露糖、蜜二糖、葡萄糖、果糖、乳糖、核糖、蔗糖、棉子糖、麥芽糖(純度均>98%):德國Dr.Ehrenstorfer GmbH公司;2-脫氧-D-葡萄糖(純度>98%):加拿大Toronto Research Chemicals公司;氫氧化鈉(色譜純)Fisher Chemical公司;鹽酸(色譜純):美國Merck公司;超純水(電阻率18.2 MΩ·cm)、IC-RP10柱(1 cc)和IC-H10柱(1 cc):美國Agela Technologies公司;所測樣品為隨機抽取的市售啤酒。
1.2 儀器與設備
ICS5000離子色譜儀(配備電化學檢測器和自動進樣器):美國Thermo Scientific公司;Milli-Q超純水儀:美國Millipore公司;DL-360E智能超聲波清洗器:上海之信儀器有限公司;ML802/02電子天平:瑞士梅特勒公司。
1.3 方法
1.3.1 離子色譜條件
Dionex CarboPacTMMA1色譜分離柱(4 mm×250 mm),Dionex CarboPacTMMA1保護柱(4 mm×50 mm);積分脈沖安培檢測模式;工作電極:Gold(Au);參比電極:AgCl電極;電位波形:Gold,Carbo,Quad;流動相:NaOH淋洗液;流速:0.45 mL/min;柱溫:29 ℃;進樣量:10 μL。NaOH溶液淋洗液條件,0~75 min:480 mmol/L;75~80 min:480 mmol/L增至600 mmol/L;80~105min:600 mmol/L;105~110 min:600 mmol/L降至480 mmol/L;110~120 min:480 mmol/L。
1.3.2 前處理方法
移取啤酒樣品約10 g,超聲30 min(去除二氧化碳)。準確取超聲后待檢樣品0.100 g,加入去離子水約150 mL,搖勻靜置15 min,全部轉移至200 mL容量瓶中,采用去離子水定容至刻度,搖勻、靜置15 min,取10.0 mL溶液,先過已預活化的IC-H10柱(去除重金屬離子),再過0.22 μm水相濾膜,最后過已預活化的IC-RP柱(去除有機物和其他雜質離子),棄去前3 mL,收集清液,待上機測定。
2 結果與分析
2.1 色譜條件優化
2.1.1 梯度淋洗液的選擇
先后采用了NaOH溶液、NaAc溶液、NaOH溶液和NaAc溶液的梯度淋洗溶液這三種淋洗液,進行分析測定對比,發現采用單純的NaOH溶液淋洗液測定23種糖類、糖醇、醇類的分離效果最好。而后進行了NaOH溶液的等度和梯度淋洗液濃度條件下分離實驗,發現在梯度淋洗條件下,組分分離并不理想,隨著淋洗溶液中氫氧化鈉濃度的變化,基線出現不同程度的漂移,直接影響了定性定量分析;等度淋洗條件下,基線平衡較好,組分分離良好。因此,選取等度NaOH淋洗液進行組分分離實驗(80 min后采用高濃度NaOH淋洗液沖洗色譜柱),23種組分混合標準溶液的離子色譜圖見圖1。由圖1可知,23種組分檢出的主要順序依次是醇類、糖醇類、糖類,各組分分離良好。
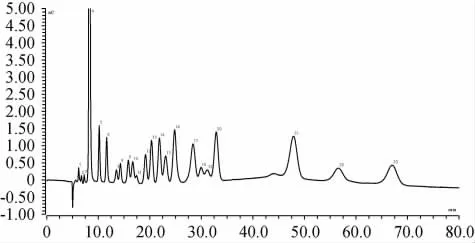
圖1 23種組分混合標準溶液的離子色譜圖Fig.1 Ion chromatogram of mixed standards solution of 23 kinds of components
2.1.2 流速的選擇
考察了0.40 mL/min、0.45 mL/min、0.50 mL/min流速條件下組分分離狀況,結果表明,流速越大,壓力越大,組分保留時間縮短,流速從0.40 mL/min增至0.50 mL/min,23種組分總保留時間由80 min降至62 min,而系統初始壓力由8.1MPa增至10.0MPa。在0.40mL/min流速時,因為流速較低,壓力較小,導致組分峰寬較大,總保留時間較長。0.50 mL/min流速時,系統壓力較大,組分總保留時間縮短,但在75 min后使用600 mmol/L NaOH淋洗液沖洗色譜柱,系統壓力由10.0 MPa升至12.7 MPa,接近色譜柱最高操作壓力13.8 MPa,對色譜柱的使用壽命和系統的整體穩定性不利。0.45mL/min流速時,初始壓力為9.0 MPa,最高壓力為11.5 MPa,壓力適中,而且分離度比較理想,23種組分在70 min內全部出峰。由此可見,增大流速可以提高色譜柱的壓力和理論塔板數,從而縮短保留時間,但是不能改變分離度和組分的洗脫順序,從減少分析時間、提高色譜柱壽命、維持系統穩定角度考慮,選擇在0.45 mL/min流速條件下進行實驗。
2.1.3 NaOH淋洗液濃度的選擇
為了提高23種組分的分離度和靈敏度,進行了初始NaOH淋洗液濃度分別為450 mmol/L、470 mmol/L、480 mmol/L、490 mmol/L、500 mmol/L條件下的對比實驗,結果見圖2。由圖2可知,隨著淋洗濃度逐步增大,多數組分保留時間逐步減小,但是醇類和糖醇組分受淋洗液濃度的影響較小,如組分1~6、8、11和12。這是因為醇類和糖醇含有羥基,在水溶液中幾乎呈中性,而糖類是多羥基(2個或以上)的醛類或酮類化合物,易發生水解,糖類的分子結構和物化特性決定了其在MA1離子色譜柱上的保留較糖醇和醇類更強,受氫氧化鈉淋洗液濃度的變化影響更大。恰好能利用23種糖類、糖醇、醇類組分在不同濃度的氫氧化鈉溶液淋洗條件下,在色譜柱上保留特性的差異,來優化改進組分間的整體分離度。
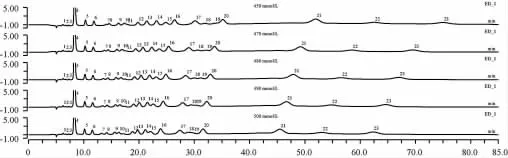
圖2 不同NaOH淋洗液濃度下混合標準溶液的離子色譜圖Fig.2 Ion chromatogram of mixed standard solution at various NaOH eluate concentrations
淋洗濃度為450 mmol/L時,組分7和8、組分19和20的分離度不高,組分10和11幾乎重疊;淋洗濃度為470 mmol/L時,組分10和11分離度不高;淋洗濃度分別為490 mmol/L、500 mmol/L時,組分14和15分離度明顯下降,而組分18和19未完全實現分離;而淋洗濃度為480 mmol/L時,這23種組分的整體分離度和靈敏度最為理想。因此,從整體分離效果來看,選擇淋洗濃度480 mmol/L進行實驗測定。
2.1.4 柱溫的選擇
考察了26 ℃、28 ℃、29 ℃、30 ℃、32 ℃色譜柱溫度條件下組分分離情況,結果見圖3。
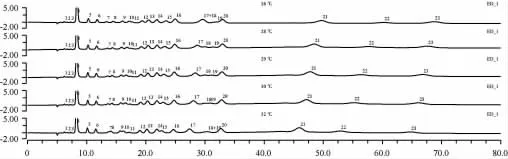
圖3 不同柱溫下混合標準溶液的離子色譜圖Fig.3 Ion chromatogram of mixed standard solution at different column temperature
由圖3可知,隨著柱溫的升高,組分總保留時間縮短,其中組分7和8、組分9和10的之間分離度越來越小,而組分17和18分離度越來越大。從分析溫度點看,26 ℃時,組分10和11、組分17和18這兩對組分幾乎重疊;28 ℃時,組分10和組分11之間的分離度不高;30 ℃時,組分18和19之間的分離度較小,不能滿足定量分析的要求;32 ℃時,組分18和19完全重疊,組分7和8、組分9和10、組分14和15這三對組分分離度較小;29 ℃時,23種組分的分離度和靈敏度均比較理想。由此可見,溫度對23種組分同時測定具有顯著的影響,每一攝氏度的變化就會導致兩種或幾種組分不能有效分離。從提高方法的分離度、靈敏度、選擇性角度考慮,選取在29 ℃柱溫條件下進行實驗分析。
2.2 線性范圍與檢出限
配制7個不同濃度水平的混合標準工作液,其中甲醇質量濃度范圍在10.0~1 000 mg/L、乙醇質量濃度范圍在2.0~200 mg/L,其他組分濃度范圍在0.025~10.0 mg/L之間,以各待測物質質量濃度(X)為橫坐標,峰面積(Y)為縱坐標,進行檢測和校準曲線擬合,并計算待測組分的檢出限(S/N=3),結果見表1。由表1可知,23種組分線性相關系數R2均>0.999,其中有18種組分相關系數R2>0.999 5,同時23種組分線性方程截距的絕對值均<0.008,這充分說明在此實驗條件下,23種組分同時測定的方法穩定、線性良好。除了甲醇和乙醇外,其他21種組分檢出限在0.011~0.197 mg/L之間。
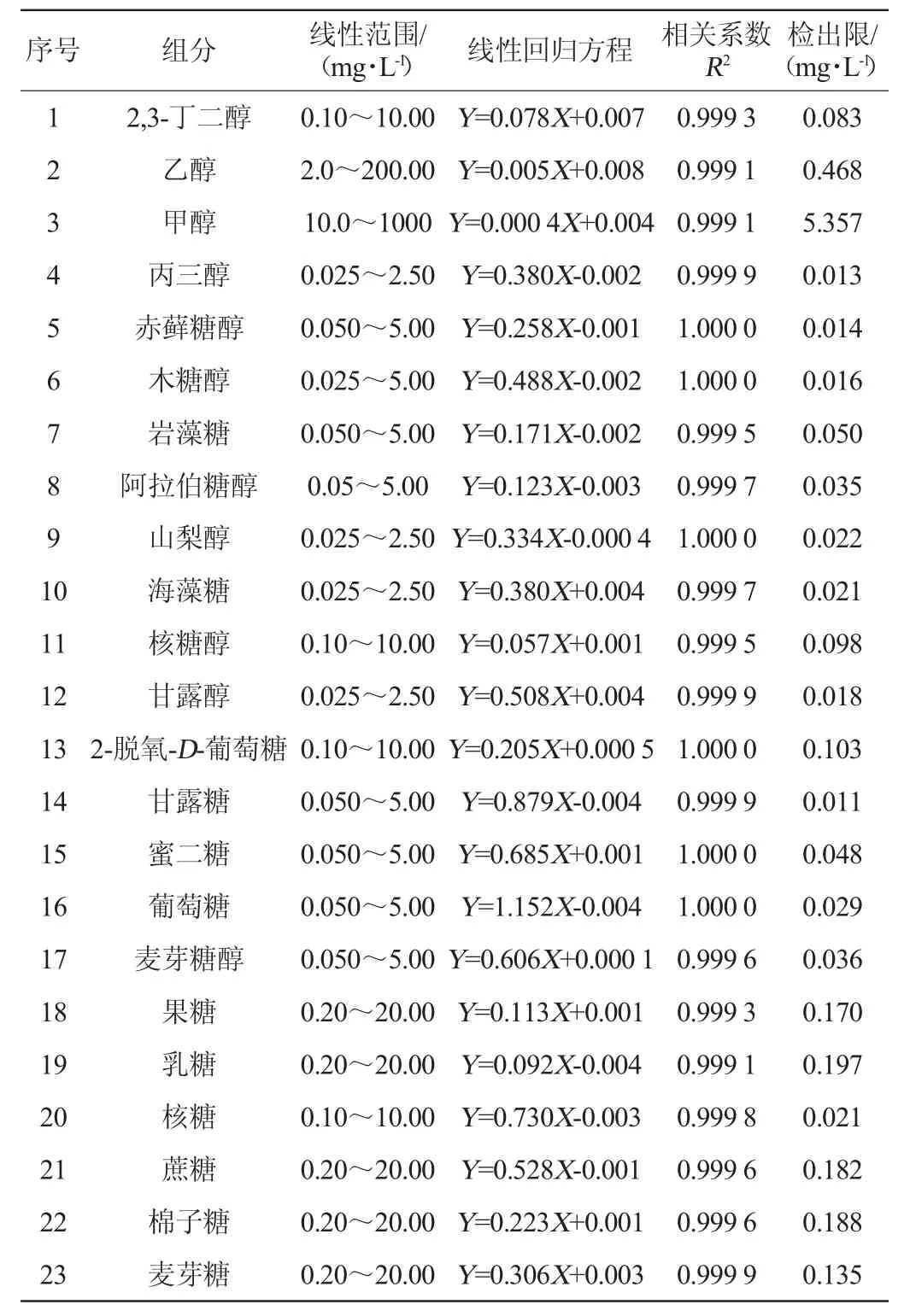
表1 測定組分的線性范圍、線性方程、相關系數及檢出限Table 1 Linear ranges,linear equations,correlation coefficient and limits of detection of determination components
2.3 回收率與精密度試驗
抽取1種啤酒樣品,依次向樣品中添加質量濃度水平分別為0.20 mg/L、1.00 mg/L、2.00 mg/L的混合標準溶液,每個濃度水平進行6次平行實驗,來驗證方法的回收率和精密度,根據基質濃度、添加濃度和添加后測定濃度來計算回收率及相對標準偏差(relative standard deviation,RSD),結果見表2。由表2可知,23種糖類、糖醇、醇類組分在三個添加濃度水平下的回收率在81.27%~106.12%之間,精密度試驗結果RSD在1.53%~10.52%范圍內。回收率、精密度試驗結果均符合食品理化檢測要求[22],表明該檢測方法精密度和準確性良好。

表2 回收率及精密度試驗結果Table 2 Results of recovery rates and precisions tests
2.4 實際樣品的檢測
依次抽取5種代表性啤酒(1-黃啤酒、2-黃啤酒、3-黃啤酒、4-黑啤酒、5-黑啤酒),按照離子色譜條件和前處理步驟,進行了實際樣品中23種糖類、糖醇、醇類組分含量的檢測分析,各樣品離子色譜圖見圖4,檢測結果見表3。
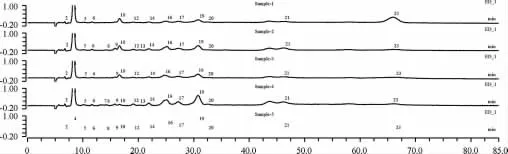
圖4 5種啤酒樣品中23種糖、糖醇及醇測定的離子色譜圖Fig.4 Ion chromatogram of 23 carbohydrates,sugar alcohols and alcohols in beer samples
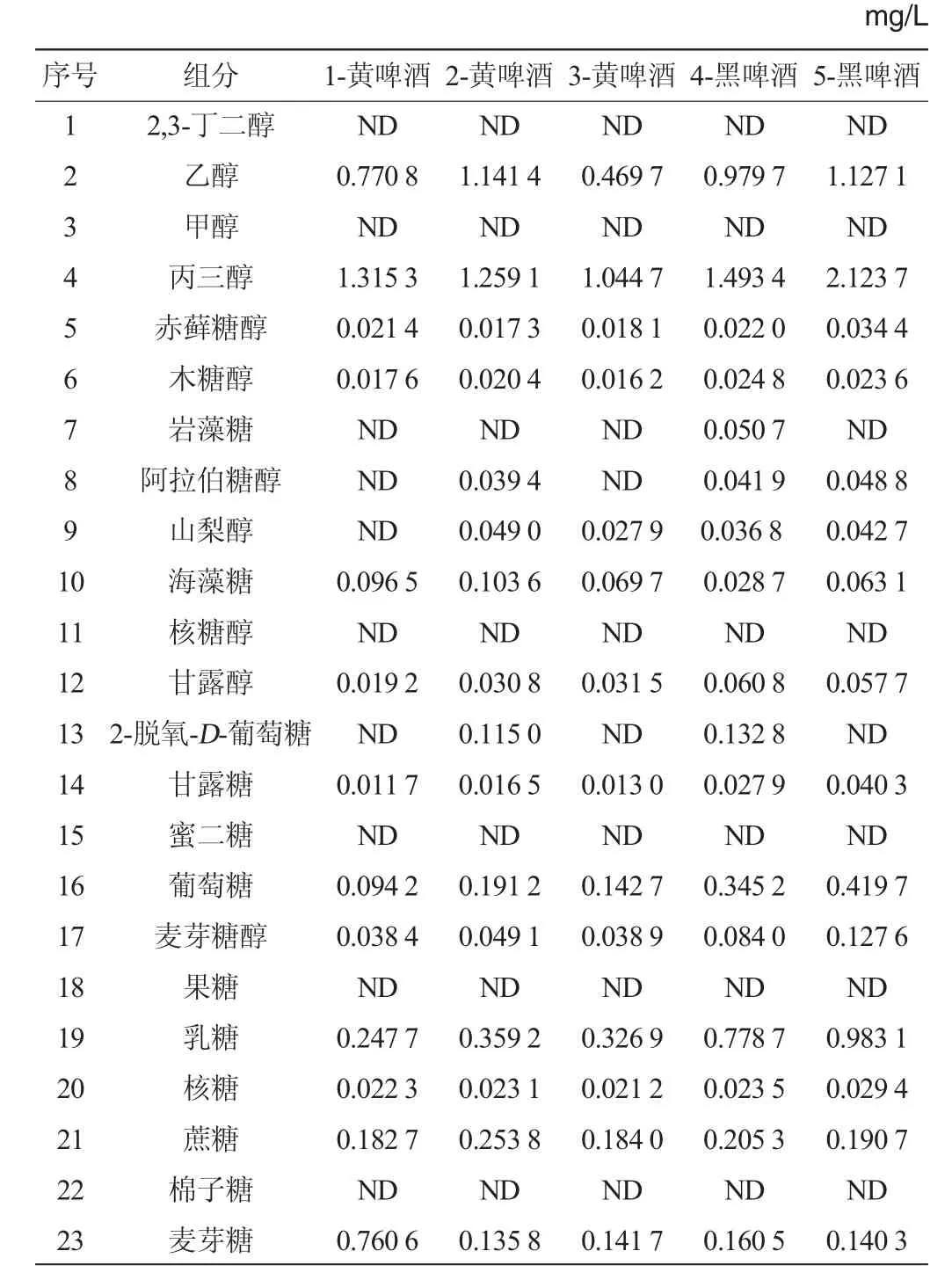
表3 啤酒樣品的23種糖、糖醇及醇測定結果Table 3 Determination results of 23 carbohydrates,sugar alcohols and alcohols in beer samples
由圖4可知,測定基線穩定,組分分離效果好,受其他干擾較小,這說明此方法穩定性好、適用性強。由表3可知,五種啤酒中檢出的糖類、糖醇、醇類組分總數量依次是13、16、14、17、15種,啤酒中檢出有益組分的種類越多、含量越大,該啤酒的品質就越好,實驗測定結果與樣品實際品質狀況完全相符。從檢出組分來看,檢出含量較大的組分依次是丙三醇、乙醇、乳糖、葡萄糖、海藻糖、山梨醇、甘露醇等。從啤酒種類來看,黑啤酒中糖類、糖醇比黃啤酒中的種類和含量更加豐富。
3 結論
本研究通過對流速、淋洗液濃度、色譜柱溫度等實驗影響因素的分析討論,探索出了適于23種糖、糖醇及醇類同時檢測的色譜分析條件,建立了積分脈沖安培-離子色譜法同時測定啤酒中23種糖、糖醇及醇類的分析方法。當流速為0.45 mL/min,淋洗濃度為480 mmol/L,柱溫為29 ℃時,23種組分在各自的質量濃度范圍內具有良好的線性關系(R2>0.999)。除了甲醇和乙醇外,其他21種組分檢出限(LOD)在0.011~0.197 mg/L;在0.20 mg/L、1.00 mg/L、2.00 mg/L三個添加濃度水平下,23種組分的回收率為81.27%~106.12%,精密度試驗結果相對標準偏差(RSD)為1.53%~10.52%。該方法簡便、快速、靈敏、準確,完全適于啤酒釀制加工、質量控制和安全監管等過程中多種糖、糖醇及醇類的快速篩查分析。

