ANCA 相關性血管炎行雙重血漿置換二級濾器高壓力的護理應對
楊健萍,張 靜,朱亞梅,楊家慧
(江蘇省人民醫院,江蘇210029)
抗中性粒細胞胞質抗體(ANCA)相關血管炎(AAV)是一組血清ANCA 陽性,臨床表現為多系統小血管炎性損害的疾病。AAV 常累及肺部及腎臟,腎臟損害多表現為急性腎炎。在疾病的急性發作期,特別是危及病人生命的臨床癥狀出現時,治療的關鍵是快速誘導疾病的緩解,減輕及逆轉臟器損害,方法包括大劑量甲潑尼龍聯合免疫抑制劑治療。盡管目前診斷技術及治療方法不斷改進,仍有相當部分病人由于嚴重并發癥導致死亡,或出現終末期腎病(ESRD),嚴重影響病人遠期預后。國外資料顯示,5 年內20%病人出現ESRD[1],而國內資料則顯示1 年和3 年腎存活率分別為66.8%和58.5%[2-3]。就診時即有明顯腎功能損害者預后更差,且對藥物治療反應不佳。目前發現的ANCA 主要有兩種類型,即針對中性粒細胞胞質嗜中性顆粒及單核細胞溶酶體髓過氧化物酶(MPO-ANCA)及針對蛋白酶3(PR3-ANCA)的抗體。目前認為ANCA在疾病的發病中起重要作用,且抗體滴度與疾病的活動度密切相關[4]。因此,臨床實踐中也采用體外循環血液凈化方法從循環中迅速清除致病性抗體,以期誘導疾病的緩解。血漿置換(PE)是一種常用的清除自身抗體的方法。其優點是簡便易行,缺點是其清除非選擇性,丟失大量血漿蛋白,需補充大量人體白蛋白或血漿[5]。在此基礎上的改進方法為雙重血漿置換(DFPP),即先采用血漿分離器(一級濾器,膜孔0.2~0.5 μm)將血漿分離出來,再經過血漿成分分離器(二級濾器,膜孔0.01~0.02 μm)濾過,分子量較小的血漿成分(主要為白蛋白及小分子蛋白)被二級濾器濾出后回輸體內,而分子量較大的血漿成分(主要為免疫球蛋白,包含自身抗體)被截留而丟棄。ANCA 相關性血管炎主要是髓過氧化物酶(MPO)、蛋白酶(PR3),PR3 是相對分子質量約為29×103的弱陽離子糖蛋白,而MPO 是相對分子質量為150×103的陽離子糖蛋白[6],二級濾器EC-20W,孔徑0.01 μm,所以血液中抗原、抗體、免疫復合物、炎性因子等易致二級濾器跨膜壓(TMP)升高,影響血漿的濾出,影響治療效果。我院血液凈化中心在二級濾器入口、出口處分別連接Y 型管,入口處Y型管側支連接生理鹽水,出口處側支連接廢液袋,運用生理鹽水沖洗二級濾器等方法,有效降低二級濾器壓力,有效完成治療。現匯報如下。
1 對象與方法
1.1 研究對象 2017 年8 月―2018 年12 月我院腎內科共收住12 例確診為ANCA 相關血管炎伴腎功能不全病人,其中男4 例,女8 例,年齡54~77 歲,平均67.8 歲,隔天進行雙重血漿置換,每例行2~4 次,共行DFPP 治療30次,所有病人或其家屬均簽署知情同意書。每個病人做自身對照,傳統方法為對照組,改良方法為試驗組,傳統方法和改良方法先后順序隨機,排除病人多余奇數例次,共形成對照組、實驗組各13例次。
1.2 DFPP 方法 機器均采用日本旭化成血液凈化設備Plasauto∑,均采用靜脈留置雙腔導管作血管通路,DFPP 采用血液凈化裝置,一級濾器為血漿分離器OP-08W(Asahi Kasei Medical CO,Ltd,日本,面積0.8 m2,孔徑0.3 μm),二級濾器為血漿成分分離器EC-20W(Asahi Kasei Medical CO,Ltd,日本,面積2.0 m2,孔徑0.01 μm),管路是機器配套特定的DFPP 管路。采用低分子肝素抗凝,使活化凝血時間延長1 倍以上。血流量設置為120~150 mL/min,一級濾器分離血漿的速度30~40 mL/min(每小時循環血液總量的25%~30%)。二級濾器棄血漿的速度為3~4 mL/min(占分離血漿的10%),每次雙重血漿置換丟棄的病理血漿量為500 mL,補充4%白蛋白500 mL 或血漿500 mL。
1.3 治療方法
1.3.1 預沖 對照組:按照機器程序選擇補液式雙重血漿置換方式,根據提示正確安裝血漿分離器、血漿成分分離器、血液管路。按照機器操作流程預沖濾器及管路。試驗組:選擇和對照組相同的治療方式,按機器程序安裝血漿分離器、血漿成分分離器、血液管路,在二級濾器入口處、出口處分別連接Y 型管進行改良,Y型管由明月牌一次性使用靜脈營養袋里加藥液導管部分組成,入口處Y 型管連接血漿分離管路和二級濾器入口,側支用于連接生理鹽水,出口處Y 型管連接二級濾器出口和廢棄血漿管路,側支備用連接廢液袋(這里的Y 型管本中心已申請使用新型專利)。兩組完成安裝后,按照機器提示,行全自動預沖。血漿置換機在全自動預沖過程中,仔細研讀OP-08 血漿分離器,EC20W 血漿成分分離器中文說明書,用3 000 mL 含150 mg 肝素的生理鹽水,按照機器全自動雙重血漿置換預沖程序,以血泵100 mL/min 速度排盡血漿分離器膜內、膜外氣體,然后排除血漿成分分離器膜內氣體,膜外空氣。試驗組裝置見圖1。
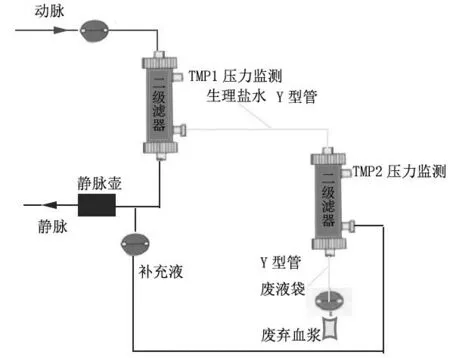
圖1 改良式雙重血漿置換示意圖
1.3.2 配制置換液 遵醫囑準備血漿置換液——4%人血白蛋白溶液500 mL 或者血漿500 mL,核對白蛋白的批號、發票號等,將20%的人血白蛋白100 mL 加入400 mL 的林格氏液中配制成4%的白蛋白溶液。血漿在使用前必須2 人核對血漿袋上的各項信息,確認血漿的質量和用量,血袋完好無損。4%的白蛋白溶液現用現配,血漿現取現用。
1.3.3 治療 雙重血漿置換整套裝置準備就緒后,運用低分子抗凝劑,將血路管動、靜脈端與中心靜脈雙腔管的動、靜脈端相連接,開啟血泵以80 mL/min 的速度引血開始體外循環治療,并根據醫囑設定一級分離血漿速度、二級棄漿速度和補置換液速度,點擊“開始”鍵開始置換血漿。此時需要密切觀察機器動脈壓、靜脈壓、跨膜壓TMP1 和TMP2 的變化,以及病人生命體征的變化。跨膜壓TMP1 對應一級濾器跨膜壓,范圍-100~60 mmHg(1 mmHg=0.133 kPa),跨 膜 壓TMP2 對應二級濾器跨膜壓,機器范圍-50~400 mmHg,實際治療過程中,在低分子抗凝劑作用下,動脈壓、靜脈壓、一級TMP1 壓力都在限定范圍內,治療開始到結束壓力變化范圍較小,不超過20 mmHg,不影響治療,而二級TMP2 隨著治療的進行,會進行性增高,兩組共26 例次進行雙重血漿置換治療,TMP2壓力均逐漸升高,TMP2 壓力達到300~350 mmHg,共計11 例,接近機器TMP2 高限域值,操作具體TMP2 壓力范圍見表1。
2 結果(見表2)

表2 兩組治療情況比較 單位:例
3 TMP2 高壓力護理應對
減少二級濾器棄血漿的速度,由3~4 mL/min 降至2.5~3.0 mL/min,使棄漿/分離≤10%,適當延長治療時間,緩慢棄血漿,通常TMP2 可以下降30 mmHg,維持TMP2 壓力在301~350 mmHg,繼續治療操作。當二級濾器TMP2 壓力高時,上述方法只能短暫緩解壓力,但壓力依然高,TMP2 維持在350 mmHg 左右,無法繼續治療時,考慮治療耗材昂貴,回血重新更換、預沖二級濾器需要花費人力、時間、金錢,給病人帶來恐懼、焦慮心理。我中心采用日本旭化成血液凈化設備Plasauto∑全自動程序行DFPP,血漿管路為一體機,無法更改手動方式予生理鹽水沖洗二級濾器[7],所以本中心進行改良,停止二級濾器治療程序,不影響一級濾器內血液運轉,在二級濾器血漿入口側支連接生理鹽水,另一端二級濾器血漿出口處側支連接廢液袋,借助擠壓袋裝生理鹽水500 mL 沖洗二級濾器,通過重力及一定壓力,迅速使堵塞二級濾器膜孔的致病抗體、脂蛋白、凝血因子等相關應子從出口側支排除到廢液袋,計時1~2 min,夾閉二級濾器血漿入口、出口側支。繼續開始二級血漿治療程序,全過程只需一名護士操作,簡單、安全、快速、有效,整個操作在密閉的管路中進行,不違反無菌原則。
AAV 是一種自身免疫性疾病,臨床有發熱、貧血、肺損害、腎損害等癥狀,檢查發現C 反應蛋白增加、紅細胞沉降率增快,血液中有抗原、抗體、免疫復合物、炎性因子等。其中腎臟是原發性小血管炎最常見受累器官。ANCN 抗體陽性和外周血高遷移率族蛋白-1(HMGB1)對其診斷具有意義,因此早期進行ANCN抗體和HMGB1 檢測有助于診斷,及時綜合治療后可改善預后。AAV 腎臟損害病人就診時表現為急性腎炎,極少數起病隱匿,由于血管炎導致腎臟分期分批受累,腎臟損害表現為不同階段、不同病變同時存在[8-9]。DFPP 能迅速清除病人血漿中的免疫復合物、抗體、抗原等致病因子,調節免疫系統,清除封閉性抗體,恢復細胞免疫功能及網狀內皮細胞吞噬功能,使病情迅速緩解[10]。
ANCN 抗原成分有許多種,包括蛋白酶3、髓過氧化物酶、組蛋白酶、乳鐵蛋白、殺菌/通透性增加蛋白、人白細胞彈力蛋白酶、天青殺青素等,但研究較清楚的主要是MPO、PR3,PR3 是相對分子質量約為29×103的弱陽離子糖蛋白,而MPO 是相對分子質量為150×103的陽離子糖蛋白[6],二級濾器EC-20W,孔徑0.01 μm, 所以血液中抗原、抗體、免疫復合物、炎性因子等易致二級濾器TMP2 壓力升高,影響血漿的濾出,在二級濾器入口處、出口處分別連接Y 型管進行改良,方便TMP2 壓力高時,予生理鹽水500 mL 沖洗,方法簡單、安全、快速、有效。實驗組均完成血漿置換治療量,且可緩解操作護士的緊張壓力和病人病情。

