芍藥苷調節高糖環境下線粒體相關內質網膜對雪旺細胞凋亡的影響
孫曉萌 李瀟 朱笳悅 韓朔 楊鑫偉 許利平
糖尿病周圍神經病變(Diabetic Peripheral Neuropathy,DPN)是糖尿病常見的慢性并發癥之一,其高發病率和高致殘率嚴重影響人們的生活和質量,尋找治療的有效藥物,是目前一直研究和觀注的重點。雪旺細胞(Schwann cells,SCs)作為周圍神經系統的特有膠質細胞,在神經損傷與修復過程中發揮重要作用[1]。高糖環境下SCs的正常代謝過程被破壞,從而使神經毒性的終產物積累,影響神經營養因子,導致細胞凋亡[2]。已有研究表明芍藥苷(paeoniflorin,PF)可以促進高糖培養的SCs的增殖,對抗高糖環境對SCs增殖的抑制作用[3],并有可能是潛在的神經生長促進因子[4]。課題組近期研究發現線粒體相關內質網膜(mitochondriaassociated endoplasmic reticulum membranes,MAMs)參與了SCs的代謝過程,糖尿病周圍神經病變的發病機制與MAMs密切相關,本實驗以MAMs為切入點,圍繞PF調控MAMs膜上功能蛋白和鈣離子參與SCs凋亡,試圖闡明PF對高糖環境下SCs凋亡的作用機制。
1 材料與方法
1.1 實驗細胞和藥品
雪旺細胞株RSC96,為中醫絡病研究北京重點實驗室保存細胞株。
芍藥苷,購于中國藥品生物制品檢定所,批號:110736-201035
1.2 主要試劑
葡萄糖(G8150,Sigma);無水甲醇(20180226,北京化工廠);PBS(P1020-500,Solarbio);ER-tracker(P1041,Beyotime);Mito-tracker(P1048,Beyotime);高效RIPA組織/細胞裂解液(R0010-100,Solarbio);anti-Mitofusin2抗體(ab124773,abcam);DMEM(PM150210,Procell);胎牛血清(16000-044,Gibco),DMSO(Sigma,D2650-100ml)。
1.3 主要儀器
手持式細胞計數儀(Millpore,AH01YOUQ);低溫離心機(Sigma,3K15);超速離心機(BECKMAN,L-80XP);高級研究型顯微鏡(Nikon,ECLIPSE 80i);定制型流式細胞儀(Becton,Dickinson and Company,BD LSRFortessa);激光共聚焦顯微鏡(Leica,TCS SP8);透射電子顯微鏡(Hitachi,HD7700);基礎電泳儀電源(PowerPacTM),電泳槽(Mini-PROTEAN?Tetra),轉印槽(Trans-Blot?),均來自Bio-Rad。
1.4 細胞處理、分組與蛋白樣品提取
1.4.1 RSC96細胞復蘇與傳代 從-80℃低溫冰箱中取出凍存細胞后迅速放入37℃水浴鍋內溫浴1分鐘,將細胞懸液加入預先加過培養基的離心管內1000 r/min離心5分鐘,棄上清,使用新鮮培養基重懸細胞沉淀,接種于新的培養瓶或培養皿內,常規培養。鏡下觀察細胞生長狀態,接近長滿時,用0.25%胰酶消化細胞1 mL,顯微鏡下觀察細胞變圓并有部分脫落后,加入含血清培養基終止消化。反復吹打貼壁細胞,使其逐漸脫落并制成細胞懸液,接種于新的培養皿中。
1.4.2 實驗分組及給藥 取5個培養瓶分別標記為空白對照組,模型對照組,PF低、中、高劑量組。取RSC96細胞,胰酶消化后制成細胞懸液,采用手持細胞計數儀進行計數,每個培養瓶內加入5×106個細胞,貼壁培養12小時以上。配置空白對照組(25 mM glucose DMEM+10%FBS),模型對照組(150 mM glucose DMEM+10%FBS),PF低劑量組(150 mM glucose DMEM+10%FBS+1 μM PF),PF中劑量組(150 mM glucose DMEM+10%FBS+10 μM PF),PF高劑量組(150 mM glucose DMEM+10%FBS+100 μM PF)。取出貼壁的RSC96細胞,吸棄培養基,加入以上配置好的藥品,置于37℃,5%CO2培養箱中分別培養24小時與48小時。
1.4.3 MAMs蛋白提取 采用胰酶將培養24小時與48小時的細胞消化成懸液后,轉移至2 mL的離心管中。采用4℃低溫冷凍離心機800 g,離心10分鐘,取上清液轉移至新的離心管中;更改離心條件為9000 g,離心10分鐘,棄上清,用PBS將沉淀吹散;更改離心條件為10000 g,離心10分鐘,重復2次后取沉淀;采用超速離心機設置為95000 g,離心30分鐘。吸出大約距管底約1 cm處的漂浮于溶液中的環狀絮狀白色固體于離心管中,更改離心條件為6300 g,離心10分鐘后取沉淀。再次采用超速離心法,更改條件為100000 g,離心30分鐘,沉淀部分為MAMs蛋白。
1.5 觀察指標
1.5.1 激光共聚焦觀察MAMs形態與數量 取LAB-TekTMII腔室蓋玻片8孔板,分別標記為空白對照組,模型對照組,PF低劑量組,PF中劑量組和PF高劑量組。取RSC96細胞鋪板后貼壁生長12小時后,吸棄培養基加藥,同1.4.2。吸棄培養液,每孔加入300 μL Mito-tracker工作液,于37℃孵育50分鐘。PBS清洗3次后,加入ER-tracker工作液于37℃孵育30分鐘。去除工作液,加入新鮮配置的細胞培養液。采用STED超高分辨率共聚焦顯微鏡觀察活細胞。每組4個樣本,每個樣本隨機選取6個區域,采用積分光密度法計數,將6個區域的均值作為每個樣本的光密度。對Merge后線粒體標記蛋白和內質網標記蛋白重疊的部分,以積分光密度衡量含量,進行數據分析。
1.5.2 Western blot法檢測線粒體融合蛋白2(Mitofusin2,Mfn2)表達 將含DTT的上樣緩沖液與MAMs蛋白樣品1∶3體積混合,于沸水變性。冷卻后分裝存放于-20℃待測。在10%SDS-PAGE凝膠孔中加入等量蛋白進行電泳分離,并使用濕轉系統將蛋白轉移到0.45 μm的PVDF膜上。5%脫脂奶粉室溫孵育2小時后采用MFN2抗體(1∶2000)4℃孵育過夜,TBST浸洗后,繼續室溫孵育山羊抗兔抗體1小時,使用TBST浸洗,加入超敏發光液后使用發光顯影儀曝光。應用Image J軟件對圖片進行分析獲得灰度值,以β-actin為內參,每組重復4次,計算相對蛋白含量。
1.5.3 Elisa法檢測蛋白激酶R樣內質網激酶(PKR-like endoplasmic reticulum kinase,PERK)蛋白表達 采用MAMs蛋白,取PERK ELISA試劑盒,于室溫(20~25℃)放置30分鐘。取出酶標板,按照標準品的次序依次分別加入100 μL的標準品溶液于空白微孔中。在空白微孔中加入100 μL樣品,再加入10 μL平衡液。在各孔加入50 μL的酶標記溶液,37℃孵育1小時。充分清洗酶標板后,用吸水紙徹底拍干。各孔依次加入顯色劑A 50 μL和顯色劑B 50 μL。于20~25℃下避光反應10分鐘后,加入50 μL終止液以終止反應。將微孔板置于450 nm波長的酶標儀下進行讀數(吸光度值即為OD值)。每組重復4次,以標準品的OD值做標準曲線,將樣品的數據帶入標準曲線中獲得蛋白含量。
1.5.4 流式細胞術檢測細胞Ca2+水平 將細胞分為空白對照組,模型對照組,PF低、中、高劑量組;分別鋪板加藥后,孵育24小時和48小時(同1.4.2)。采用無EDTA胰酶消化細胞,并收集于2 mL離心管中。加入1 mL培養基,1000 r/min離心5分鐘后,吸棄培養基。加入500 μL的Fluo-AM3(0.5 μm),將細胞吹打均勻,37℃孵育30分鐘后,1000 r/min離心5分鐘。吸棄250 μL上清液,繼續加入250 μL的PBS,37℃孵育30分鐘。1000 r/min離心5分鐘后,吸棄上清液。加入500 μL的PBS,將細胞吹打均勻后,使用流式細胞分析儀進行細胞內Ca2+水平檢測。
1.6 統計學處理
采用SPSS 17.0進行統計分析,數據符合正態分布,以均數±標準差(±s)表示。多組樣本比較采用單因素方差分析,方差齊性條件下,選擇LSD分析,方差不齊性條件下,選擇Tambane's T2分析。P<0.05為差異有統計學意義。
2 結果
2.1 PF對高糖環境下MAMs的形態與含量
SCs呈梭形,綠色部分為線粒體,由Mito-tracker標記;紅色部分為內質網,由ER-tracker標記;重疊部分為MAMs。統計結果顯示干預24小時和48小時后:與空白對照組比較,模型對照組MAMs含量顯著降低(P<0.01),SCs梭形不明顯,形態變小不規則;與模型對照組比較,PF各組MAMs含量顯著增加(P<0.01),SCs形態得到改善,趨于棱形,見圖1、圖2 與表1。
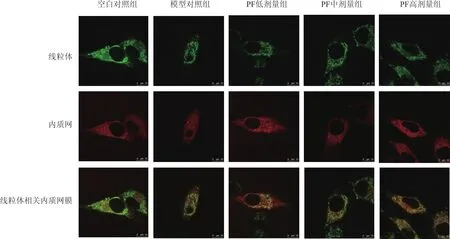
圖1 共聚焦觀察24小時高糖環境下的MAMs形態(×630)
圖2 共聚焦觀察48小時高糖環境下的MAMs形態(×630)
表1 高糖環境下SCs中MAMs的共聚焦積分光密度(n=4,±s)
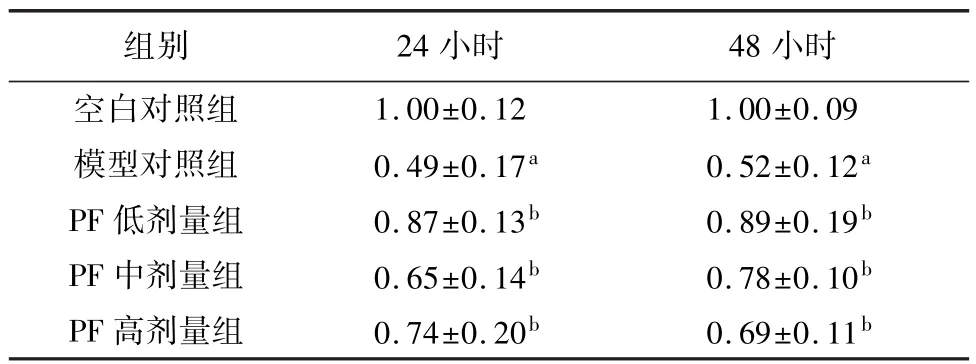
表1 高糖環境下SCs中MAMs的共聚焦積分光密度(n=4,±s)
注:與空白對照組比較,aP<0.01;與模型對照組比較,bP<0.01。
1.00±0.12 1.00±0.09模型對照組 0.49±0.17a 0.52±0.12a PF 低劑量組 0.87±0.13b 0.89±0.19b PF 中劑量組 0.65±0.14b 0.78±0.10b PF 高劑量組 0.74±0.20b 0.69±0.11小時空白對照組組別 24小時 48 b
2.2 PF對高糖環境下MAMs中Mfn2表達
Mfn2低表達影響細胞代謝。RSC96細胞干預24小時和48小時后:與空白對照組比較,模型對照組Mfn2表達顯著降低(P<0.01);與模型對照組比較,PF各劑量組Mfn2表達顯著升高,差異有統計學意義(P<0.01),見表2。
表2 PF對高糖環境下MAMs中Mfn2的影響(n=4,±s)

表2 PF對高糖環境下MAMs中Mfn2的影響(n=4,±s)
注:與空白對照組比較aP<0.01;與模型對照組比較bP<0.01。
組別 24小時 48 1.00±0.13 1.00±0.10模型對照組 0.50±0.10a 0.59±0.10a PF 低劑量組 0.85±0.12b 0.82±0.16b PF 中劑量組 0.72±0.20b 0.80±0.11b PF 高劑量組 0.64±0.17b 0.70±0.10小時空白對照組b
2.3 PF對高糖環境下MAMs中PERK表達
PERK的過度激活會促進細胞凋亡。干預RSC96細胞24小時和48小時:與空白對照組比較,模型對照組PERK表達明顯升高(P<0.01);與模型對照組比較,芍藥苷低劑量組和芍藥苷中劑量組PERK表達顯著下降,差異有統計學意義(P<0.01),芍藥苷高劑量組表達也有明顯下降(P<0.05),見表3。
表3 PF對高糖環境下MAMs中PERK的影響(n=4,±s)

表3 PF對高糖環境下MAMs中PERK的影響(n=4,±s)
注:與空白對照組比較,aP<0.01;與模型對照組比較bP<0.05,cP<0.01。
組別 24小時 48 1.00±0.02 1.00±0.02模型對照組 1.44±0.10a 1.55±0.11a PF 低劑量組 1.18±0.09c 1.01±0.08c PF 中劑量組 1.25±0.09c 1.16±0.15c PF 高劑量組 1.30±0.12b 1.39±0.15小時空白對照組b
2.4 芍藥苷對高糖環境下RSC96細胞Ca2+水平
Ca2+水平的上升是細胞凋亡的誘導因素之一。與空白對照組相比,模型對照組Ca2+水平顯著升高(24小時升高3.63倍,48小時升高2.05倍,差異有統計學意義P<0.01)。與模型對照組比較,芍藥苷各劑量組均能夠顯著降低Ca2+水平,差異具有統計學意義(P<0.01);提示PF能夠緩解高糖誘導的細胞Ca2+水平,見表4。
表4 PF對高糖環境下RSC96細胞Ca2+的影響(n=4,±s)
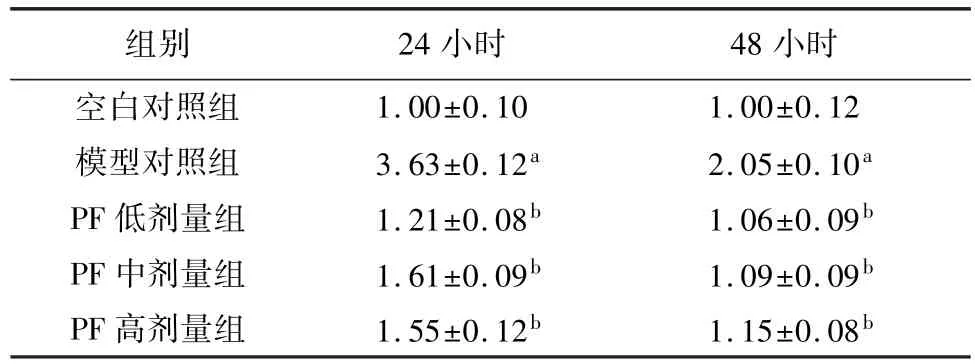
表4 PF對高糖環境下RSC96細胞Ca2+的影響(n=4,±s)
注:與空白對照組比較,aP<0.01;與模型對照組比較bP<0.01。
1.00±0.10 1.00±0.12模型對照組 3.63±0.12a 2.05±0.10a PF低劑量組 1.21±0.08b 1.06±0.09b PF中劑量組 1.61±0.09b 1.09±0.09b PF高劑量組 1.55±0.12b 1.15±0.08小時空白對照組組別 24小時 48 b
3 討論
高血糖誘導的SCs病變是糖尿病周圍神經病變的主要發病機制之一,SCs在神經損傷的修復中起著重要作用。氧化應激和內質網應激均能夠引起SCs凋亡。高糖環境下未折疊蛋白的過度堆積引起內質網應激[5],激活內質網跨膜蛋白PERK,繼而引發細胞凋亡[6-7]。
近年研究發現[8],線粒體外膜與內質網膜之間存在由特定蛋白質經由物理連接形成的亞細胞器結構,即MAMs。MAMs[9-10]經由內質網與線粒體相互調控,其機制與MAMs上多種功能蛋白和Ca2+信號密切相關。Mfn2作為線粒體外膜上一種跨膜GTP酶,介導線粒體融合,參與細胞能量代謝、增殖及凋亡等。研究還發現[11-12]Mfn2不僅參與調控線粒體形態結構,還與細胞代謝、增殖、凋亡密切相關。Mfn2能夠引起下調Ca2+內流,緩解細胞內鈣超載從而緩解細胞凋亡。PERK[13]是位于內質網膜上的一種跨膜蛋白,PERK信號通路的激活在內質網應激的早期可以通過抑制蛋白的合成發揮保護細胞的作用,促進細胞生存。但隨著內質網應激時間的延長,PERK則會促進細胞的凋亡。SCs的凋亡影響周圍神經功能,進一步影響糖尿病周圍神經病變。已有研究[14]表明,Mfn2是PERK的上游調節劑,并在物理上與PERK相互作用,Mfn2損傷的細胞在基礎條件下表現出PERK的持續激活。早期PERK能夠使線粒體鈣正常化,但后期則誘導內質網轉流進入線粒體的Ca2+增加,促進鈣超載,引發細胞凋亡。
赤芍為毛茛科植物芍藥Paeonia lactifloraPall.或川赤芍P.vertchiiLynch的根,在糖尿病周圍神經病變的辨證論治中,結合糖尿病“陰虛為本,燥熱為標”的特點,常配伍在復方中[15-16]用于治療糖尿病周圍神經病變。課題組前期研究[17]也發現,PF通過Nrf/ARE途徑減輕線粒體氧化應激,降低SCs中氧自由基的含量,從而減輕SCs凋亡,保護周圍神經而改善糖尿病周圍神經病變。
本實驗的結果示高糖環境下SCsCa2+明顯增多,影響MAMs的形態和含量,引起細胞凋亡。結果還顯示Mfn2表達下降,影響線粒體和內質網的形態異常;PERK表達的增加,也會導致細胞凋亡。Mfn2表達下降同時Ca2+增加,PERK表達也增加的現象證明Mfn2能夠下調Ca2+,且能夠下調PERK的表達。當用PF干預高糖環境的SCs后,影響MAMs的PERK表達量,48小時較24小時時間點的差異性更大,說明隨著時間的增加,PF抑制PERK的表達更加明顯,同時Ca2+水平下降更顯著,具有一定的時效關系。PF干預后,Mfn2表達顯著提升的同時表現為Ca2+水平顯著下降,細胞凋亡緩解,MAMs的含量提升,PERK的表達降低,接近正常水平,表明PF通過上調線粒體相關內質網膜上 Mfn2的表達,而Mfn2能夠下調PERK的表達,進而緩解鈣超載,從而減輕SCs的凋亡,緩解糖尿病周圍神經病變。
綜之,PF能夠改善高糖環境下SCs的MAMs的結構含量和功能蛋白,改善SCs形態,減輕SCs凋亡,有利于改善糖尿病周圍神經病變。這與其能夠上調Mfn2的表達,抑制PERK表達,降低細胞內Ca2+濃度,減輕鈣超載有關。

