腹腔感染患者感染源控制時機與預后的關系
文靜 湯展宏
摘要:目的 ?探討腹腔感染患者采取感染源控制措施的時機對疾病預后的影響。方法 ?回顧性分析廣西醫科大學第一附屬醫院重癥醫學科二病區2015年7月~2018年12月收治的101例腹腔感染患者的臨床資料,根據入院時間或住院期間出現腹腔感染的時間到采取感染源控制措施的時間間隔將患者分成≤6 h組、6~12 h組、12~24 h組、24~48 h組、>48 h組5組,并將6~12 h組、12~24 h組、24~48 h組及>48 h組設為>6 h組,比較各組死亡率、≤6 h組與>6 h組在住院時間、重癥監護室(ICU)監護時間、呼吸機治療時間、連續性血液凈化治療(CRRT)時間、住院費用及并發癥發生情況。結果 ?患者總體死亡率為34.65%(35/101),≤6 h組死亡率為29.17%,低于6~12 h組(35.71%)、12~24 h組(42.11%)、24~48 h組(33.33%)、>48 h組(34.62%)4組死亡率,但差異無統計學意義(P>0.05)。≤6 h組在住院時間、住院費用、腹腔出血的并發癥方面優于>6 h組,差異有統計學意義(P<0.05);≤6 h組在肺炎及血流感染的發生率、ICU監護時間、呼吸機治療時間、CRRT治療時間均少于>6 h組,在呼吸衰竭、腹腔膿腫的發生率與>6 h組相當,在急性腎衰竭、多器官功能障礙綜合征(MODS)、腸梗阻、腹腔間隙綜合征發生率方面則高于>6 h組,但差異均無統計學意義(P>0.05)。結論 ?在6 h時間窗內盡早采取感染源控制措施并未明顯改善腹腔感染患者的不良預后,但在縮短患者的住院時間,減少住院費用,以及減少腹腔出血并發癥的發生方面可能具有一定的優勢。
關鍵詞:腹腔感染;感染源;控制措施;時機;預后
中圖分類號:R656 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? DOI:10.3969/j.issn.1006-1959.2020.11.025
文章編號:1006-1959(2020)11-0086-06
Abstract:Objective ?To investigate the impact of the timing of infection source control measures on the prognosis of patients with abdominal infection.Methods ?To retrospectively analyze the clinical data of 101 patients with abdominal infections admitted to the Second Ward of the Department of Critical Medicine of the First Affiliated Hospital of Guangxi Medical University from July 2015 to December 2018. The time interval of source control measures divided the patients into ≤6 h group, 6~12 h group, 12~24 h group, 24~48 h group,>48 h group 5 groups, and 6~12 h group, 12~24 h group , 24~48 h group and group>48 h were set as group>6 h, comparing the mortality in each group, group ≤6 h and group>6 h in hospital stay, intensive care unit (ICU) monitoring time, ventilator duration of treatment, the duration of continuous blood purification therapy (CRRT), the cost of hospitalization, and the occurrence of complications.Results ?The overall mortality rate of the patients was 34.65% (35/101), and the mortality rate in the ≤6 h group was 29.17%, lower than the 6-12 h group (35.71%), 12~24 h group (42.11%), 24~48 h group (33.33%),>48 h group (34.62%) 4 groups mortality, but the difference was not statistically significant (P>0.05). The ≤6 h group was superior to the ≥6 h group in terms of hospitalization time, hospitalization costs, and complications of abdominal bleeding,the difference was statistically significant (P<0.05); the ≤6 h group had the incidence of pneumonia and bloodstream infection, ICU Monitoring time, ventilator treatment time, and CRRT treatment time were all less than>6 h group. The incidence of respiratory failure and abdominal abscess was similar to that of>6 h group. In acute renal failure, multiple organ dysfunction syndrome (MODS), The incidence of intestinal obstruction and celiac space syndrome was higher than that in the group> 6 h, but the difference was not statistically significant (P>0.05).Conclusion ?Taking the source control measures as early as possible within the 6 h time window does not significantly improve the poor prognosis of patients with abdominal infections, but may have certain advantages in shortening the hospitalization time of patients, reducing hospitalization costs, and reducing the incidence of abdominal bleeding complications.
Key words:Abdominal infection;Source of infection;Control measures;Timing;Prognosis
膿毒癥(sepsis)是目前全球重大的公共衛生問題之一[1],全球每年有超過1900萬的膿毒癥患者,其中的死亡人數高達530萬[2,3],腹腔感染(intra-abdominal infection,IAI)是膿毒癥及感染性休克的第2大病因,同時也是重癥監護病房(ICU)中感染性疾病患者的第2大死因,如不能及時有效處理可進一步發展為膿毒癥、感染性休克,最終可導致多器官功能衰竭,從而增加患者的死亡率。腹腔感染治療的關鍵措施包括復蘇、感染源控制以及抗菌藥物的使用,其中感染源控制是治療的基礎,給予感染源控制措施的時機可能影響患者預后,2012年版本的膿毒癥與感染性休克治療國際指南(SSC 2012)建議感染源控制措施應在確診的12 h內啟動[4],而 2016年版本的膿毒癥與感染性休克治療國際指南(SSC 2016)要求在符合醫療原則的情況下盡可能快的控制感染源[5]。美國外科感染學會2017年發布的腹腔感染管理指南(SISAcIAI2017)建議除臨床證據表明非介入治療或延遲治療是適當的,否則應在診斷腹腔感染后的24 h內進行感染源控制,對合并有膿毒癥以及感染性休克的患者,應以更緊急的方式進行感染源控制[6],可見目前對于感染源控制措施實施的時機尚存在爭議。本研究通過回顧性分析101例腹腔感染患者的臨床資料,旨在探討腹腔感染患者采取感染源控制措施的時機對該疾病預后的影響,現報道如下。
1資料與方法
1.1一般資料 ?收集2015年7月~2018年12月廣西醫科大學第一附屬醫院重癥醫學科二病區收治的101例腹腔感染患者的臨床資料,其中新入院患者以入院時間作為時間“零點”,住院期間獲得腹腔感染的患者以出現相關臨床、體征的時間作為時間“零點”,根據患者的時間“零點”到首次感染源控制措施開始的時間間隔將患者分為5組,分別為≤6 h組(24例)、6~12 h組(14例)、12~24 h組(19例)、24~48 h組(18例)、>48 h組(26例),其中6~12 h組、12~24 h組、24~48 h組、>48 h組4個組的患者統稱為>6 h組(77例),對各組患者的資料進行回顧性分析。納入患者符合:①出院主要診斷為腹腔感染,按廣義的腹腔感染的定義,包括腸壞死、腸梗阻、胃腸穿孔以及闌尾炎等空腔臟器引起的腹腔內的細菌性炎癥,也包括肝、脾等實質性臟器感染病原體而形成膿腫的情況,還包括胰腺等腹膜后臟器炎癥引起的腹膜后感染;根據美國外科感染學會2010年腹腔感染管理指南,通過患者的臨床癥狀、體征、實驗室檢查及CT檢查結果進行診斷,且均經感染源控制措施留取標本進一步確診;②年齡>18歲;③首次感染源控制措施在本院進行;④臨床資料完整。
1.2方法 ?在時間“零點”收集患者的一般資料,包括性別、年齡、合并癥、生命體征、血常規、肝功能、腎功能、電解質、血氣分析、腹部X線片和(或)腹部超聲和(或)腹部計算機斷層掃描(CT)等評估結果、Glascow昏迷評分、急性生理學和既往健康評分(APACHE Ⅱ評分)和臟器功能障礙嚴重度評分(SOFA評分)等指標。
1.3觀察指標 ?比較≤6 h組、6~12 h組、12~24 h組、24~48 h組、>48 h組的死亡率,另外分析比較≤6 h組與>6 h組在死亡率、住院時間、ICU 監護時間、呼吸機治療時間、連續性血液凈化治療(CRRT)時間、住院費用以及各種并發癥等指標上的差異。
1.4統計學處理 ?使用SPSS 22.0統計軟件,分類變量使用(n)和(%)表示,連續變量使用(x±s)或四分位數表示,對連續變量進行分組,根據數據類型分別采用?字2檢驗、Wilcoxon秩和檢驗和方差分析3種不同的方法進行組間差異比較。本研究設定假設檢驗為雙尾檢驗,P<0.05表示差異有統計學意義。
2結果
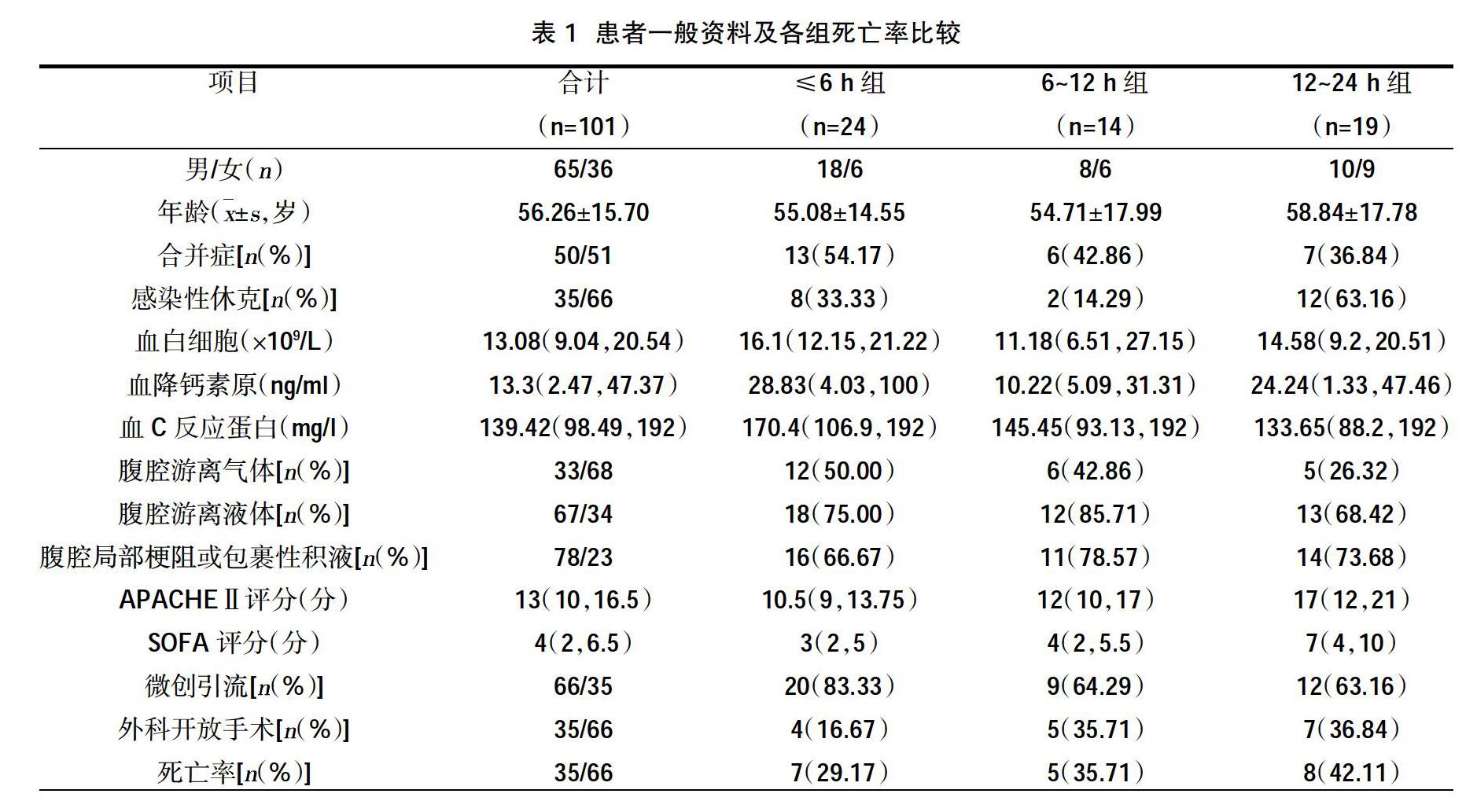
列入研究的101例患者中有21例為住院期間腹部手術后繼發感染,占20.79%,其余為院外感染后新入院患者(79.21%)。病變部位的分布情況:膽道系統占比最多,為25.74%,其次為大腸(18.81%)、小腸(17.82%)、胃(11.88%),十二指腸、胰腺、肝、闌尾的比例在10%以下,其中闌尾最少、約為2.97%。病因方面,有18例為惡性腫瘤患者,占17.82%,其余為良性疾病患者(82.18%)。感染源控制時間窗范圍為21(0.5~600)h。控制感染源的措施主要為B超引導下的穿刺引流或ERCP等微創介入技術和外科開腹手術2種,見表1~表4。
3討論
腹腔感染是一種涉及腹腔內多個部位、多種病因的綜合征,臨床表現多樣化,個體差異大,又不能完全分割,多數情況下需要緊急處理,且處理措施中包括微創的或開放的手術操作,不同個人、不同醫療機構、不同地區之間的操作水平差異難以衡量,同時考慮倫理道德方面的限制等原因,不僅很難實施大型的多中心前瞻性研究,常規的臨床研究也面臨重重困難。到目前為止,現有證據標明感染源控制的最佳時機[6]。
研究顯示[7],從診斷到感染源控制時間間隔是腹腔感染患者死亡的預測因素。然而,既往研究并未見明確標準說明應該何時啟動感染源控制措施。臨床醫師在是否開始感染源控制的決策上往往較為謹慎,常需行充分的實驗室檢查以達到精確的病情評估、CT檢查以對病變部位進行更準確的定位、進行充分的液體復蘇實現血流動力學穩定等處理后再開始感染源控制的措施,但上述措施全部完善后可能會導致感染源控制延遲,增加感染源控制失敗的風險。
既往研究顯示[8,9],對于血流動力學不穩定的膿毒癥患者,可能需要短時間延遲開始感染源控制的時間才能快速復蘇。2008年版本的膿毒癥與感染性休克治療國際指南(SSC 2008)亦建議只有在成功的初始復蘇后才能開始進行針對感染源的干預措施[10]。
但最新版本的SSC(SSC 2016)和SISAcIAI2017不再強調必需成功復蘇后才能開始控制感染源[5,6]。De De Waele JJ的研究提出消化道穿孔及彌漫性腹膜炎患者應在診斷后1~2 h內進行手術,不論其對復蘇嘗試的反應如何[11]。Azuhata T等[12]的一項對154例胃腸穿孔患者的前瞻性觀察性研究顯示,入院到實施感染源控制的時間是影響患者存活率的獨立因素,研究表明,按照目標導向性復蘇策略對患者進行初始復蘇,即使在患者血流動力學不穩定的情況下,及早手術仍可顯著改善患者預后,隨著入院到手術時間的延長,存活率下降,當入院到手術開始時間超過6 h時,60 d存活率為0。Rausei S等[13]回顧性分析了111例使用腹腔開放療法作為感染源控制措施的嚴重腹腔感染患者的臨床資料后發現,早期手術可以顯著改善患者的預后,6 h內進行手術治療的患者死亡率較超過6 h才手術的患者低,而初級筋膜關閉率較后者高,且手術每延遲 6 h,患者的死亡率逐漸增高,初級筋膜關閉率逐漸下降。但值得強調的是該研究里的死亡率以及初級筋膜關閉率的高峰出現在了與預后相關的APACHEⅡ評分及SOFA評分得分最高的6~12 h組,說明相較于手術時機對預后的影響,患者病情的嚴重程度對預后的影響更為關鍵。同時,另有研究提出病情對預后的影響比手術時機的影響更 ? 大[5,14,15]。因此,血流動力學不穩定的情況下是否應開始感染源控制措施,給予了積極的復蘇治療血流動力學狀態仍無法改善的重癥感染患者的處理仍存在爭議,有待進一步研究。
本研究模擬了Rausei S等[13]的方法對研究對象進行觀察,從各組實際死亡率上看,呈現的趨勢如下:≤6 h組的死亡率在各組中最低,且≤6 h組、6~12 h組、12~24 h組3組的死亡率隨著手術時間的延遲逐漸遞增,死亡率高峰出現在12~24 h組,24~48 h組死亡率稍低于>48 h組,但24~48 h組、>48 h組兩組的死亡率均低于6~12 h組及12~24 h組。同時,各組死亡率的高低與它們的APACHEⅡ評分及SOFA評分的平均分值的高低基本一致。并且,101例患者中APACHEⅡ評分>中位數分數13分的患者死亡率高于APACHEⅡ評分≤13分的患者,差異有統計學意義(P<0.05),與Rausei S等[13]的研究中觀察到的情況是一致的。但此本研究各組死亡率比較,差異無統計學意義(P>0.05)。
本研究的沒有限定控制感染源的具體措施,Rausei S等[13]研究的對象均為接受腹腔開放療法治療的嚴重腹腔感染患者,而本研究入組的患者感染源控制措施主要為B超引導下的穿刺引流或ERCP等微創介入技術以及外科開腹手術2種,具體方式的選擇是根據當時患者的病情、患者及家屬的意愿、外科醫師的經驗以及醫院的條件等因素決定的。目前被認為有效的感染源處理措施包括傳統的剖腹探查和膿腫切開引流、經皮膿腫穿刺引流、腹腔鏡探查和引流、腹腔開放療法等[16]。指南(SISAcIAI2017)建議在能夠達到有效控制感染源的目標的前提下,優先選擇損傷最小的干預措施。但SISAcIAI2017指南同時指出:對局部腹腔感染患者而言,選擇經皮穿刺引流等微創手術治療是合理的;對彌漫性腹膜炎患者而言,需要進行剖腹手術,部分重癥患者甚至需要采取腹腔開放療法[6]。對此,王革非等[17]亦提出了遞增式的感染源治療策略:首先選擇微創手術達到改善引流的目的或者建立主動的引流途徑;上述方式無法有效的控制感染源時應考慮行開腹手術引流,手術需遵循損傷控制的原則;合并腹腔高壓的患者應積極采用腹腔開放療法進行干預。在本研究中,所有患者感染源控制方式的選擇基本符合指南以及專家的建議。但是受醫院及外科醫師技術條件的限制、患者及家屬的意愿、社會風俗習慣等因素的影響,本次納入研究的患者極少采用腹腔開放治療,因此部分患者可能存在感染源控制措施選擇欠合理、感染源控制欠充分的情況,而感染源控制不足可導致包括死亡率增加在內的多種不良后果[18]。
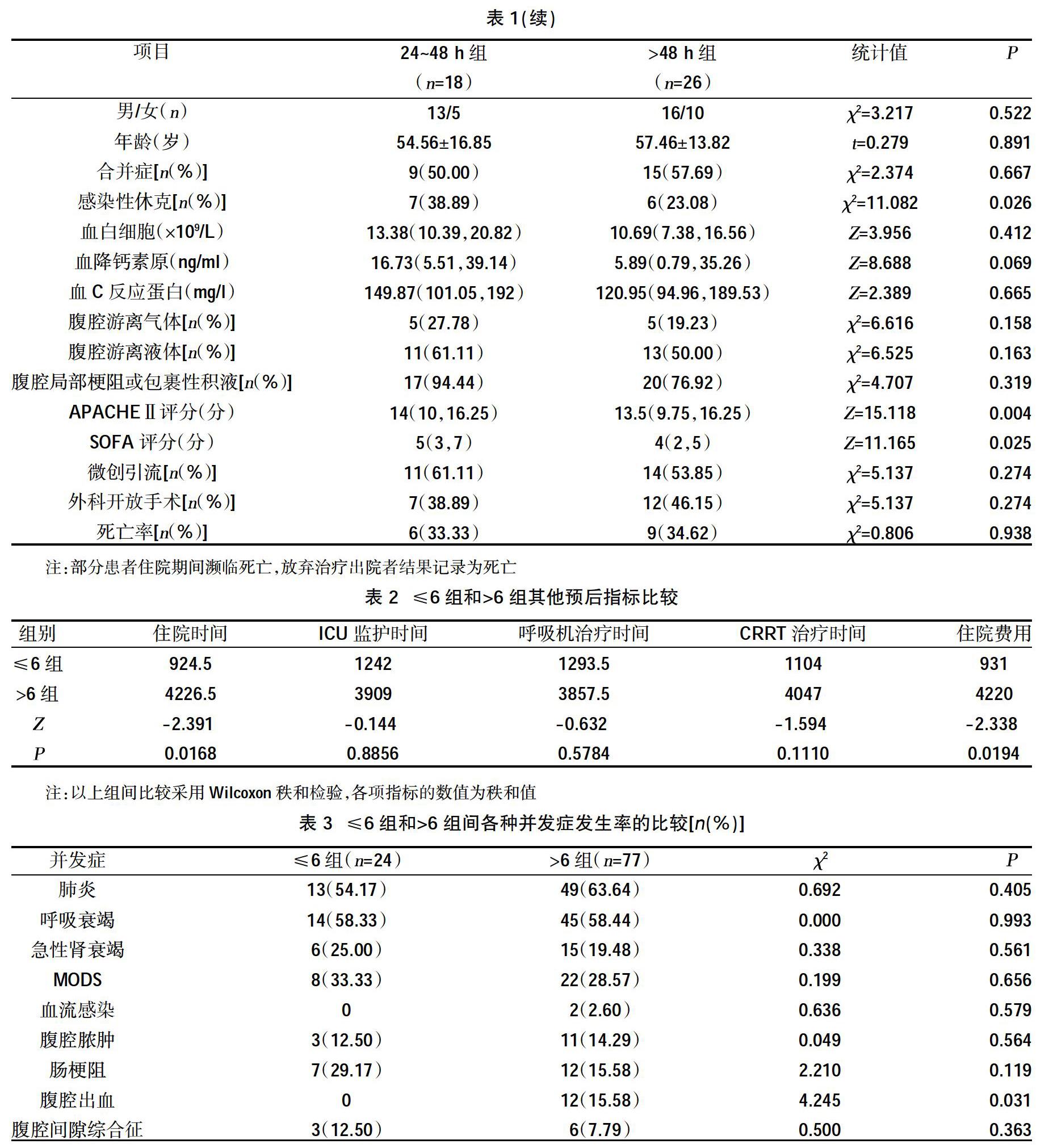
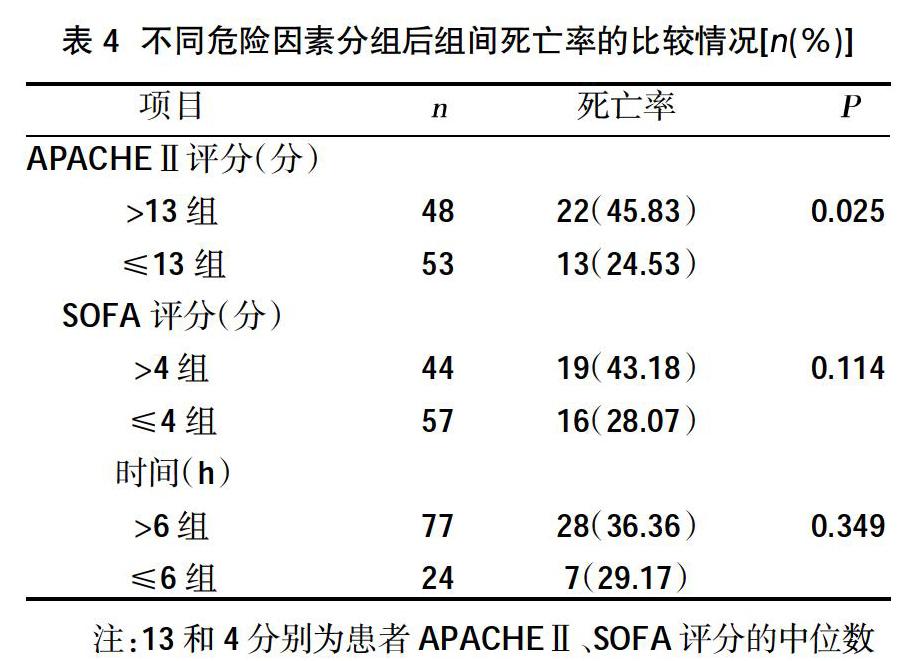
另外,為了更好地觀察感染源控制時機與預后的關系,本研究增加了≤6 h組和>6 h組在住院時間、ICU 監護時間、呼吸機治療時間、連續性血液凈化(CRRT)治療時間、住院費用以及各種并發癥方面的比較,結果顯示≤6 h組在住院時間、住院費用、腹腔出血的并發癥方面優于>6 h組,差異有統計學意義(P<0.05),在肺炎及血流感染的發生率、ICU監護時間、呼吸機治療時間、CRRT治療時間均少于后者,但差異無統計學意義(P>0.05),而在呼吸衰竭、腹腔膿腫的發生率與后者相當,甚至在急性腎衰竭、多器官功能障礙綜合征(MODS)、腸梗阻、腹腔間隙綜合征發生率方面高于后者,這可能與手術影響復蘇方案的充分實施以及復蘇目標的監測與判斷、手術損傷等因素有關,手術創傷對危重患者而言有時是不可忽視的,損傷控制外科理念的存在即很好的證明了這一點,但以上項目的比較差異無統計學意義(P>0.05),需進一步的研究了解其間的關系。
總之,本次研究仍存在不足之處。首先,小樣本量的回顧性分析的方法限制了結果的準確性。其次,本次研究樣本是不均勻,既有在院外已獲得感染的新入院患者,又有手術后并發腹腔感染的患者;既有消化性潰瘍穿孔、膽石癥并感染等良性疾病的患者,也有惡性腫瘤患者;各組患者間的一般資料比如APACHEⅡ評分及SOFA評分的分布也是不均勻的,這些干擾因素無疑會影響結果的判斷。再次,因為有時候出現癥狀的時間是很難確定的,所以“零點”時間的定義未包括新入院病人從出現癥狀到入住醫院期間的時間長短,這些都可能會影響研究的結果。
參考文獻:
[1]Singer M,Deutschman CS,Seymour CW,et al.The Third International Consensus Definitions for Sepsis and Septic Shock(Sepsis-3)[J].JAMA,2016,315(8):801-810.
[2]Sep Net Critical Care Trials Group.Incidence of severe sepsis and septic shock in German intensive care units:the prospective,multicentre INSEP study[J].Intensive Care Medicine,2016,42(12):1980-1989.
[3]Angus DC,van der Poll T.Severe sepsis and septic shock[J].N Engl J Med,2013,369(9):840-851.
[4]Dellinger RP,Levy MM,Rhodes A,et al.Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septicshock,2012[J].Crit Care Med,2013,41(2):580-637.
[5]Rhodes A,Evans LE,Alhazzani W,et al.Surviving Sepsis Campaign:International Guidelines for Management of Sepsis and Septic Shock:2016[J].Critical Care Medicine,2017,45(3):486-552.
[6]Mazuski JE,Tessier JM,May AK,et al.The Surgical Infection Society Revised Guidelines on the Management of Intra-Abdominal Infection[J].Surgical Infections,2017,18(1):1-76.
[7]Kim JJ,Liang MK,Subramanian A,et al.Predictors of relaparotomy after nontrauma emergency general surgery with initial fascial closure[J].American Journal of Surgery,2011,202(5):549-552.
[8]Solomkin JS,Mazuski JE,Bradley JS,et al.Diagnosis and management of complicated intra-abdominal infection in adults and children:Guidelines by the Surgical Infection Society and the Infectious Diseases Society of America[J].Surg Infect(Larchmt),2010,11(1):79-109.
[9]Friedrich AKU,Cahan M.Intraabdominal Infections in the Intensive Care Unit[J].Journal of Intensive Care Medicine,2014,29(5):247-254.
[10]Dellinger RP,Levy MM,Carlet JM,et al.Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock:2008[J].Crit Care Med,2008,36(1):296-327.
[11]De Waele JJ.Early source control in sepsis[J].Langenbecks Arch Surg,2010,395(5):489-494.
[12]Azuhata T,Kinoshita K,Kawano D,et al.Time from admission to initiation of surgery for source control is a critical determinant of survival in patients with gastrointestinal perforation with associated septic shock[J].Crit Care,2014,18(3):R87.
[13]Rausei S,Pappalardo V,Ruspi L,et al.Early Versus Delayed Source Control in Open Abdomen Management for Severe Intra-abdominal Infections:A Retrospective Analysis on 111 Cases[J].World Journal of Surgery,2017,42(3):707-712.
[14]Tavaré A,O'Flynn N.Recognition,diagnosis,and early management of sepsis:NICE guideline[J].British Journal of General Practice,2017,67(657):185-186.
[15]Sartelli M,Catena F,Ansaloni L,et al.Complicated intraabdominal infections worldwide:the definitive data of the CIAOW study[J].World J Emerg Surg,2014(9):37.
[16]任建安.腹腔感染風險因素分析與對策[J].中華消化外科雜志,2017,16(12):1167-1171.
[17]王革非,任建安,黎介壽.腹腔感染源的遞增式治療策略[J].醫學與哲學,2017,38(12B):8-10.
[18]Tellor B,Skrupky LP,Symons W,et al.Inadequate source control and inappropriate antibiotics are key determinants of mortality in patients with intra-abdominal sepsis and associated bacteremia[J].Surg Infect(Larchmt),2015,16(6):785-793.
收稿日期:2020-04-15;修回日期:2020-04-25
編輯/肖婷婷

