一株雞傳染性貧血病毒的分離鑒定及其致病性研究
陳玲,宋亞芬,張兵,蔣桃珍
(中國獸醫藥品監察所,北京 100081)
雞傳染性貧血(Chicken infectious anemia)是由雞傳染性貧血病毒(Chicken infectious anemia virus, CAV)引起,其病原CAV屬于圓環病毒科,基因組由單鏈、環狀、共價封閉的負鏈DNA組成[1-2]。該病最早由Yuasa等[3]報道,主要特征是導致感染雞出現再生障礙性貧血和伴有免疫抑制的胸腺萎縮和淋巴細胞流失,并伴隨著病毒、細菌或真菌感染。自從雞傳染性貧血病毒在日本首次分離以來[4],該病毒已在幾乎所有擁有家禽產業的國家被分離出來。除了貧血和相關癥狀外,在商品雞群中經常觀察到無貧血但死亡率增加的亞臨床CAV感染[5]。
自2014年以來,從我國黑龍江、吉林、遼寧、寧夏、江蘇等地的雞群中分離出CAV的報道增加,且毒株多從混合感染雞病料中分離,這些研究報道表明我國部分地區商品雞中CAV感染比例較高,且可能也是導致雞群一些相關疫病發生的誘因。但是在相關研究人員的報道中,沒有發現對近些年分離毒株致病性的研究數據[6-7]。為進一步了解近期國內CAV分離株的分子生物學特征和對雞的致病力,本研究采用2016年從北京平谷某雞場死亡雞肝臟中分離的一株CAV對1日齡SPF雞進行致病性研究,同時進行了全基因組測序和特征性氨基酸位點分析。
1 材料與方法
1.1 病料 北京平谷某雞場死亡雞肝臟。
1.2 SPF雞胚和雞 6日齡SPF雞胚和1日齡SPF雞,均購自北京勃林格殷格翰維通實驗動物有限公司。
1.3 引物設計與合成 參照美國CVB《外源性雞傳染性貧血病毒檢測和鑒定的PCR方法》[6],設計一對CAV特異性引物CAV F/R;根據GenBank中CAV全基因組,設計兩對引物CAV F1/R1和CAV F2/R2, 引物序列見表1,由中美泰和生物技術有限公司合成。
1.4 主要試劑 大腸桿菌JM109感受態細胞、病毒DNA提取試劑盒、DNA Marker、Ex Taq Mix購自Takara公司;pGEM-T載體購自Promega公司; 瓊脂糖凝膠DNA回收試劑盒購自Omega公司。
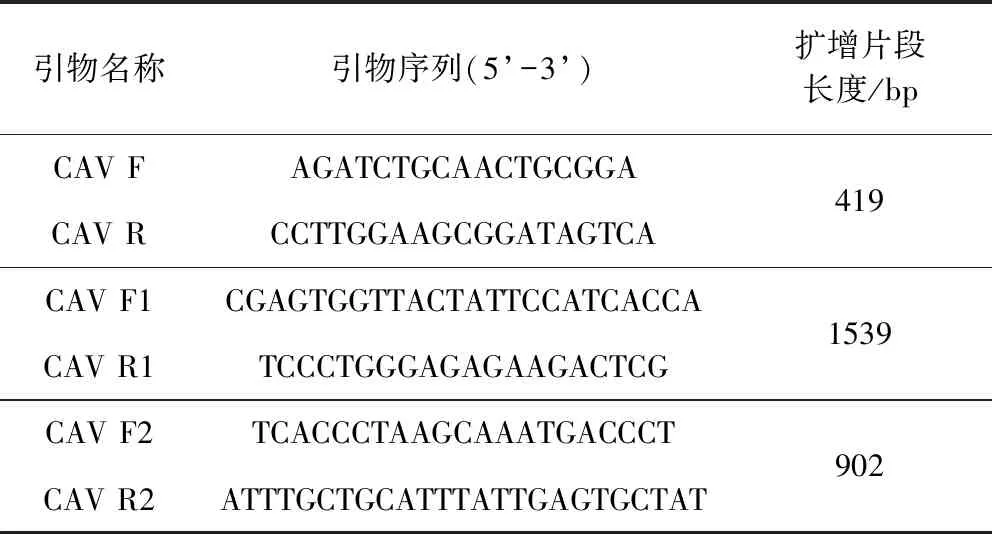
表1 PCR擴增的引物序列Tab 1 Primer sequences for PCR amplication
1.5 病毒分離 將肝臟組織剪成小塊后置于研缽中,倒入適量液氮,充分研磨,按1∶5的體積比加入含雙抗(1000 U/mL)的生理鹽水,-80 ℃反復凍融三次,8000 r/min離心10 min,取上清,經0.22 μm濾膜過濾除菌。取研磨液經卵黃囊接種6日齡SPF雞胚,0.2 mL/胚。37 ℃繼續孵育14 d,無菌收獲胚體放入勻漿杯中,加入適量生理鹽水(25 mL/胚),10000 r/min勻漿2 min,間隔1 min,再次以相同速度勻漿2 min,經64目銅網過濾,收獲含毒濾液,標記為CAV E1。將收獲濾液再次接種雞胚,并連續進行5次傳代(CAV E1-E5),每個代次病毒分裝后保存在-80 ℃。
1.6 病毒鑒定和特異性檢測
1.6.1 PCR檢測CAV病毒 參照Takara MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0說明書,提取CAV E2-E4代病毒基因組。以CAV F/R為引物檢測雞傳染性貧血病毒,反應體系:2×Ex Taq Mix 25 μL,CAV F/CAV R(10 μmol/L)各1 μL, 模板10 μL, ddH2O 13 μL;反應條件:95 ℃ 5 min;95 ℃ 30 s,51.5 ℃ 45 s,72 ℃ 1 min,30個循環;72 ℃ 10 min。取5 μL PCR產物,用1.5%瓊脂糖凝膠電泳檢查PCR擴增結果。
1.6.2 純凈性檢測 取CAV E4病毒液經滴鼻、點眼接種20只3周齡SPF雞,0.2 mL/只,同時肌肉注射,0.5 mL/只。21d后按上述方法和計量重復接種一次。試驗期間進行臨床觀察,第一次接種后42 d采血,參照《中國獸藥典》方法,進行相關病毒(表2)的抗體檢測。

表2 相關病毒抗體檢測方法Tab 2 Detection method of related viral antibody
1.7 致病性試驗 將60只1日齡SPF雞隨機分為3組,每組20只。第1組和第2組為試驗組,分別經胸部肌肉接種100和10000 EID50CAV E4病毒,第3組為空白對照組,接種等量的生理鹽水。分別在接種當天、接種后7 d、14 d、24 d、28 d和35 d對試驗雞進行稱重,并在接種后14 d時采血測定其紅細胞壓積。
1.8 病毒全基因組的擴增、克隆和測序 以CAV E4 DNA為模板,分別以CAV F1/R1和CAV F2/R2為引物進行PCR擴增,將PCR產物回收后,與pGEM-T載體連接,轉化到JM109細胞,取100 μL涂布含有氨芐的LB瓊脂,37 ℃過夜培養。利用菌落PCR的方法鑒定重組子,挑選3個陽性克隆送往中美泰和生物技術有限公司測序。
1.9 序列比對與分析 將CAV E4的全基因組序列和VP1、VP2、VP3序列分別與國內外已發表的CAV分離株(毒株信息見表3)進行比對和分析[4]。
2 結果與分析
2.1 PCR鑒定 CAV E2-E4代病毒均能擴增出特異性的419 bp條帶(圖1)。
2.2 純凈性檢測 接種的所有雞除產生CAV特異性抗體外,其他所檢測病原抗體均為陰性,也無雞痘臨床癥狀,表明所分離的CAV毒株是純凈的,

表3 序列信息表Tab 3 sequence information list
無其他病毒性病原污染。因此將毒株命名為AV1550,真空冷凍干燥后保藏在中國獸醫微生物菌種保藏管理中心(CVCC)。
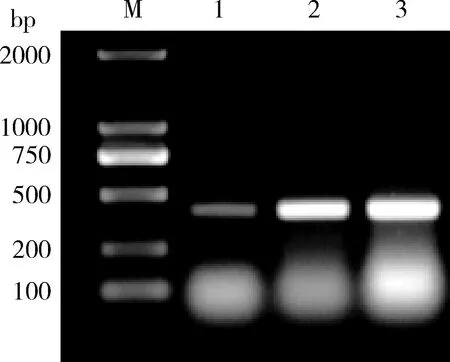
M: DNA Marker; 1-3:CAV E2、E3、E4 的CAV特異性片段 M: DNA Marker; 1-3:CAV specific fragment of E2、E3、E4圖1 CAV E2、E3和E4 PCR檢測Fig 1 Identification of CAV E2、E3、E4 by PCR
2.3 致病性試驗
2.3.1 臨床觀察 攻毒后2 d,對照組1只雞出現非特異性死亡。10000 EID50感染組在攻毒后8 d開始出現死亡,在觀察期內死亡率為50%;100 EID50感染組在攻毒后13 d開始出現死亡,在觀察期內死亡率為25%。接種雞出現死亡的高峰期在13~20 d。結果見表4。
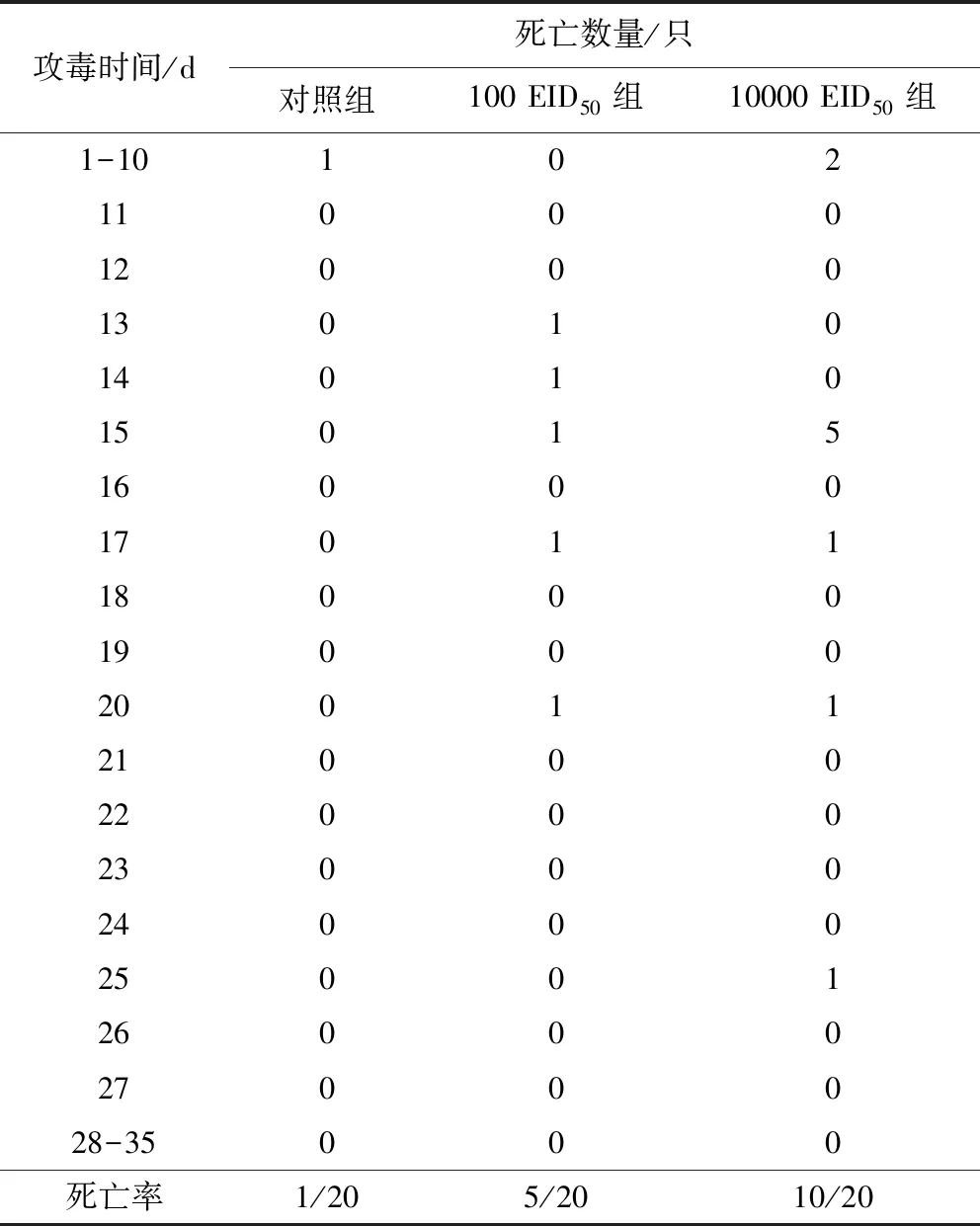
表4 1日齡SPF雞接種后死亡結果Tab 4 Deaths of 1-day-old SPF chicken inoculation
2.3.2 攻毒后不同時間試驗雞體重變化 不同劑量接種后7 d,各組試驗雞平均體重無明顯差異。10000 EID50感染組在接種后14~35 d間,平均體重與對照組相比,具有極顯著性差異(P<0.01);100 EID50感染組在接種后21 d~28 d,平均體重與對照組相比,具有顯著性差異(P<0.05),接種后14 d和35 d平均體重也低于對照組,但差異不顯著(P>0.05)。具體數據見表5。
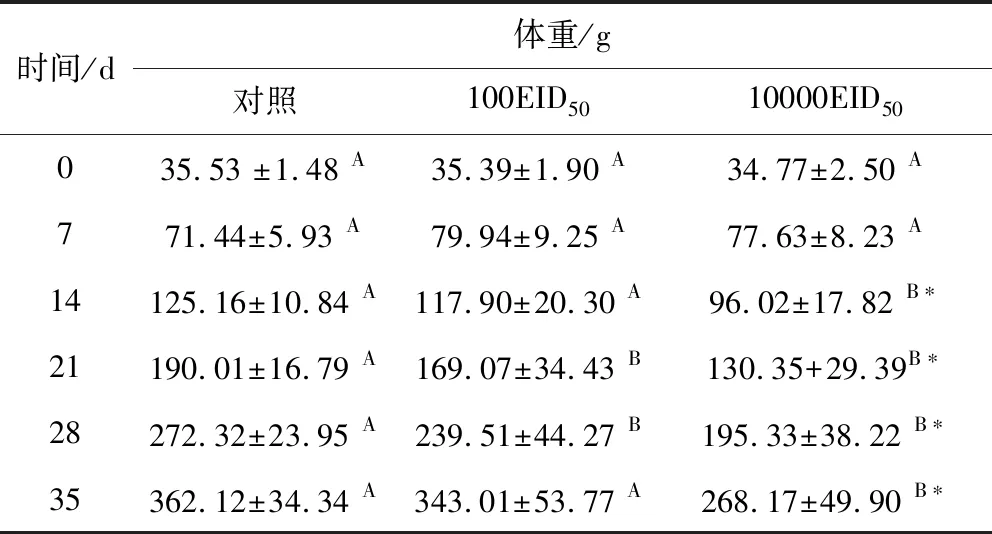
表5 不同時間雞體重結果(n=10)Tab 5 Weight of SPF chicken at different time(n=10)
不同的大寫字母表示差異顯著(P<0.05),*表示差異極顯著(P<0.01)
Different capital letters indicate significant differences(P<0.05),*means the difference is very significant(P<0.01)
2.3.3 對SPF雞的致貧血作用 攻毒后14 d采血測定紅細胞數量和壓積(表6),10000 EID50感染組紅細胞數量及紅細胞壓積與對照組相比具有極顯著性差異 (P<0.01);100 EID50感染組紅細胞數量也低于對照組,但差異不顯著,紅細胞壓積與對照組相比具有顯著差異(P<0.05)。

表6 紅細胞數量和紅細胞壓積結果(n=10)Tab 6Record of erythrocyte and packed cell volume(n=10)
不同的大寫字母表示差異顯著(P<0.05),*表示差異極顯著(P<0.01)
Different capital letters indicate significant differences(P<0.05),* means the difference is very significant(P<0.01)
2.4 AV1550全基因組序列分析 AV1550 E4基因組全長為2298 bp,非編碼區含有4個21 bp的直接重復序列(Direct Repeat, DR),編碼區有3個部分重疊的開放閱讀框(Open Reading Frame, ORF),分別編碼VP2(651 bp)、VP3(366 bp)和VP1(1350 bp)。CAV參考株全基因組序列可分為A、B和C 3個群(圖2),AV1550株屬于A群,基因同源性分析顯示,AV1550株與中國分離株LN15170的親緣關系最近,基因同源性為99.7%,與TR20株親緣關系最遠,同源性僅91.7%。

圖2 AV1550毒株的全基因組進化樹Fig 2 Phylogenic tree based on whole genome of AV1550 and reference strains
2.5 AV1550與其它CAV參考株VP1、VP2和VP3序列比較 將AV1550株與NCBI上其它CAV毒株的VP1、VP2和VP3核苷酸和氨基酸序列進行同源性分析,VP1核苷酸序列與已發表的CAV毒株的同源性在94.0%~99.6%之間,同源性最高的毒株為LN15170,最低的為FAdV-N22株;VP2核苷酸同源性在98.9%~99.8%;VP3核苷酸同源性為98.9%~100%。VP1氨基酸與已發表的CAV毒株的同源性在96.7%~99.6%,同源性最高的毒株為LN15170,最低的為SH11株和SDLY08株;VP2氨基酸同源性在98.2%~99.5%;VP3氨基酸同源性為97.5%~99.2%。CAV毒株的VP2和VP3序列非常保守,基因差異主要在VP1編碼區。
2.6 AV1550株特征性氨基酸位點分析 AV1550株在VP1的75、89、125、141和394位均為強毒株特征性氨基酸;在VP1的高變區(aa139-aa151)的139和144位氨基酸分別為K和E,推測該毒株有較高的復制和傳播能力。AV1550株VP1上特征性氨基酸位點見表7。

表7 AV1550 VP1特征性氨基酸位點Tab 7 Characteristic amino acids on VP1 of AV1550
3 討論與結論
自Yuasa等[9]發現雞T淋巴細胞系(如MDCC-MSB1)和B淋巴細胞系(如LSCC-1104B1)可用于培養CAV以來,細胞培養已成為CAV分離和繁殖的優選方法[5]。但不同亞型的MSB1對CAV感染的敏感性不同,部分CAV毒株(如CIA-1)不能在MSB1上復制[11];此外,MSB1細胞有時經連續傳代后對CAV的敏感性降低,甚至僅傳代8周后病毒就不能在其上增殖[12]。有些通過細胞培養或PCR檢測為陰性的樣品,接種1日齡易感雞后可產生CAV感染臨床癥狀,已有研究表明用1日齡易感雞進行病毒分離的敏感性是細胞培養的100倍以上。本研究采用雞胚卵黃囊接種的方法成功分離出一株CAV毒株,且增殖的病毒滴度較高,這為某些不能適應細胞培養的田間CAV毒株的分離提供參考。
AV1550毒株的基因組大小為2298 bp,與國內外其它35個毒株的核苷酸相似性在91.7%~99.7%之間,與國內分離的大多數毒株的同源性均較高,與遼寧分離株LN15170同源性最高(99.7%)。不同毒株VP1核苷酸同源性在94.0%~99.6%之間,VP2核苷酸同源性在98.9%~99.8%之間,VP3核苷酸同源性為98.9%~100%。總體而言,CAV全基因及VP1、VP2和VP3的序列分析,表明其基因組變異很小,且VP2和VP3高度保守,VP1作為唯一的結構蛋白且刺激宿主免疫應答反應,其氨基酸差異相對較大[5],這與國內外學者的研究報道一致。
Yamaguchi等[13]報道VP1中394位的氨基酸可能是毒力的主要決定因素。如果該位點為谷氨酰胺(Q),則該分離毒株可能具有較高的致病性,如果該位點為組氨酸(H),則其致病性相對較低。林歡等[14]對CAV全基因組序列分析后發現,除日本毒株C369外,絕大部分毒株在394位氨基酸均為Q。早期研究報道[15],75V、89T、125I、141Q和144Q氨基酸同時發生突變,毒力會明顯減弱,不會引起貧血、骨髓和胸腺萎縮。本研究中,為進一步明確氨基酸序列與致病性之間的關系,對分離鑒定的AV1550毒株進行了測序和致病性試驗,AV1550毒株394位的氨基酸為Q,僅在125L和144E發生基因突變,表明毒株可能具有較高的致病性,且毒力不會發生明顯減弱。而1日齡雞的致病性試驗證實AV1550毒株低劑量和高劑量接種組都可以導致雞發病死亡,且高劑量組(每只雞接種10000 EID50)可引起50%的死亡率,明顯高于一般毒株感染引起的死亡率(通常不超過30%),試驗雞有明顯的貧血癥狀,增重遲緩。初步研究試驗結果也表明,毒株的致病性與VP1特定位點的氨基酸具有相關性。
Renshaw等[16]報道VP1蛋白跨13個氨基酸(139 -151)的高變區(HVR)中139和144位的氨基酸在病毒的生長和傳播中起重要作用,如果VP1 Q-139和/或Q-144時,病毒的復制和傳播效率就會有所下降。AV1550毒株在139和144位氨基酸分別為賴氨酸(K)和谷氨酸(E),推測其在機體的復制和傳播能力可能較強,但毒株的該生物學特性還需要進一步試驗研究。

