實(shí)時(shí)超聲造影和融合影像導(dǎo)航下微波消融與手術(shù)治療小肝癌患者療效比較*
全亞寧,商曉杰,孟 璇,高榆秀
肝癌作為臨床常見惡性腫瘤之一,發(fā)病隱匿,生長速度迅速,惡性程度高,易出現(xiàn)浸潤轉(zhuǎn)移,晚期易伴嚴(yán)重的并發(fā)癥,死亡率較高[1]。手術(shù)切除是治療肝癌最有效的手段之一,但基于腫瘤進(jìn)展程度、患者全身狀況和肝功能狀況等因素的影響,臨床僅10%~20%轉(zhuǎn)移性肝癌和30%原發(fā)性肝癌(PLC)患者可滿足手術(shù)切除的條件[2]。近年來,微波消融作為一項(xiàng)新型微創(chuàng)治療手段,具有易操作、創(chuàng)傷輕微、并發(fā)癥少、可重復(fù)操作等優(yōu)勢,已被廣泛用于肝癌的治療[3]。但有報(bào)道顯示,部分小肝癌生長位置較為特殊,處于肝門區(qū)、肝包膜下或鄰近大血管、膈肌、膽囊等位置,常規(guī)超聲定位難度較大,治療困難。另外,某些病灶與周圍肝實(shí)質(zhì)回聲差異相對較小,周圍實(shí)質(zhì)回聲雜亂,導(dǎo)致病灶界限不清,常規(guī)超聲檢查病灶顯示較為困難,難以確保完全消融[4]。有研究認(rèn)為,實(shí)時(shí)超聲造影可有效、實(shí)時(shí)、清晰地顯示腫瘤血管和血流灌注情況,即時(shí)判斷微波消融的效果。基于超聲造影結(jié)合融合影像導(dǎo)航條件下實(shí)施微波消融,可實(shí)現(xiàn)特殊部位肝癌的準(zhǔn)確定位,有效輔助引導(dǎo)消融治療[5,6]。我們采用超聲新技術(shù)引導(dǎo)下微波消融治療小肝癌患者,現(xiàn)報(bào)道如下。
1 資料與方法
1.1 一般資料 2013年12月~2016年12月我院收治的原發(fā)性肝癌患者142例,男90例,女52例;年齡29~73歲,平均年齡為(46.7±7.7)歲。診斷參考《原發(fā)性肝癌診療規(guī)范(2011年版)》[7],最大結(jié)節(jié)直徑≤3 cm,結(jié)節(jié)數(shù)目≤3個(gè);特殊部位腫瘤指位于膈頂、肋骨后或毗鄰心臟、腔靜脈等處的腫瘤,腫瘤離肝內(nèi)較大血管或膽管10 mm及以下,距肝包膜5 mm及以下,距離肺、心臟、膽囊、胃腸道或右腎10 mm及以下;肝功能Child-Pugh A/B級(jí);無血管和周圍臟器侵犯或肝外轉(zhuǎn)移;凝血酶原活動(dòng)度大于70%;入組前6個(gè)月內(nèi)未接受過外科相關(guān)手術(shù)治療。排除標(biāo)準(zhǔn):(1)肝功能Child-Pugh C級(jí);(2)合并門靜脈癌栓、肝外轉(zhuǎn)移;(3)嚴(yán)重的凝血功能障礙;(4)肺、肝等重要臟器功能障礙;(5)轉(zhuǎn)移性肝癌或其他惡性腫瘤;(6)合并頑固性腹水、有食管胃底靜脈曲張破裂出血或肝性腦病史;(7)妊娠或哺乳期婦女,或?qū)Τ曉煊皠┻^敏者。采用隨機(jī)抽簽法將患者分為兩組,每組71例,兩組一般資料比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05,表1)。患者簽署知情同意書,本研究獲得我院醫(yī)學(xué)倫理委員會(huì)批準(zhǔn)。
表1 兩組一般資料【】比較
1.2 治療方法 在觀察組,實(shí)施實(shí)時(shí)超聲造影和融合影像導(dǎo)航下微波消融治療。使用Esaote Mylab90型彩色多普勒超聲診斷儀(探頭頻率為2.0~5.0 MHz,內(nèi)置于超聲儀內(nèi)有Virtual Navigator一體化工作站的實(shí)時(shí)虛擬導(dǎo)航系統(tǒng))、GE公司SIGNA 1.5 TL×MRI、飛利浦64排螺旋CT和南京億高公司生產(chǎn)的ECO-100A1型微波治療儀(功率為0~100 w,頻率為2450 MHz)。先行常規(guī)CT/MRI檢查,獲取薄層DICOM格式影像數(shù)據(jù)資料,采用醫(yī)學(xué)影像存檔和傳輸系統(tǒng)借助光盤或U盤將數(shù)據(jù)資料導(dǎo)入虛擬導(dǎo)航系統(tǒng)。選擇血管與病灶同時(shí)顯示相對清晰的 CT/MRI時(shí)相,標(biāo)記CT/MRI上病灶邊緣,行三維渲染顯示。根據(jù)血管走行或輪廓將CT/MRI圖像與實(shí)時(shí)超聲圖像進(jìn)行注冊、微調(diào),完成二者聯(lián)動(dòng),并不斷行不同切面上對應(yīng)解剖結(jié)構(gòu)的影像融合驗(yàn)證。對出現(xiàn)錯(cuò)位者,予以微調(diào)校正。利用影像融合導(dǎo)航,對CT/MRI上病灶信息判斷病灶在實(shí)時(shí)超聲圖像中所處的位置。經(jīng)虛擬導(dǎo)航完成病灶定位后,選擇病灶顯示最為清晰的切面并固定,通過肘部靜脈快速團(tuán)注對比劑2.4 mL,再以生理鹽水5.0 mL沖管,實(shí)時(shí)觀察超聲圖像上相應(yīng)病灶的血流灌注變化,進(jìn)一步明確病灶部位、大小和與周邊重要臟器的解剖位置關(guān)系。常規(guī)消毒、鋪巾,用1%利多卡因皮下注射局部麻醉,術(shù)中給予舒芬太尼靜脈注射鎮(zhèn)痛。在實(shí)時(shí)超聲造影和融合影像導(dǎo)航下同時(shí)顯示病灶,將微波消融針刺入病灶,確保微波針針頭處于病灶的中心處。將微波儀功率調(diào)節(jié)至40~80 w,維持5~10 min,行微波消融治療。在實(shí)施消融過程中,在超聲引導(dǎo)下實(shí)時(shí)監(jiān)測病灶的消融情況,并監(jiān)測消融區(qū)內(nèi)回聲變化,對氣化區(qū)域行消融范圍預(yù)估。在消融結(jié)束時(shí),確保消融范圍達(dá)到病灶周邊的0.5 cm。術(shù)后10 min,即行實(shí)時(shí)超聲造影評(píng)估,探查原病灶動(dòng)脈期是否存在強(qiáng)化,整體評(píng)估消融效果。對超聲造影提示局部存在腫瘤殘留者,再次行微波消融治療,補(bǔ)充消融5~10 min。術(shù)后,予以對癥治療;在對照組,實(shí)施手術(shù)切除治療,包括局部肝切除術(shù)或解剖性肝切除。全身麻醉,開腹或于腹腔鏡下切除病灶,確保手術(shù)切緣大于腫瘤邊緣的2.0 cm以上。對于處于表淺部位的腫瘤,且與重要膽管或血管無密切聯(lián)系者,選擇肝癌局部切除術(shù)。對于腫瘤位置較深,與主要膽管或血管聯(lián)系密切,則實(shí)行解剖性肝切除術(shù),包括單肝段切除或聯(lián)合肝段切除。在治療3個(gè)月后,所有患者在門診行超聲造影或增強(qiáng)CT等檢查。在隨訪過程中,對消融過的病灶再次明顯增大,或出現(xiàn)與消融或手術(shù)切緣分界不清的新發(fā)病灶,判斷為局部進(jìn)展,對肝內(nèi)其他區(qū)域有新發(fā)病灶出現(xiàn)者,則判斷為再發(fā)[7]。
1.3 檢測方法 使用美國雅培公司生產(chǎn)的ARCHITECT I2000SR型全自動(dòng)化學(xué)發(fā)光免疫分析儀和酶速率法測定血清α-L-巖藻糖苷酶(α-L-fucosidase,AFU)水平(北京科美生物技術(shù)有限公司);采用ELISA法測定血清甲胎蛋白(alpha fetal protein,AFP)水平(北京熱景生物技術(shù)有限公司);采用免疫放射法測定血清糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)水平(天津九鼎醫(yī)學(xué)生物工程有限公司)。

2 結(jié)果
2.1 兩組基本治療情況 術(shù)后3個(gè)月復(fù)查,觀察組71例患者96個(gè)病灶中90個(gè)病灶(93.8%)完全消融,6個(gè)病灶殘留,對照組71例患者99個(gè)病灶全部被切除,未發(fā)現(xiàn)局部殘留(圖1、圖2)。在隨訪1年時(shí),觀察組23例(32.4%)出現(xiàn)局部腫瘤進(jìn)展,對照組20例(28.2%)出現(xiàn)肝內(nèi)腫瘤再發(fā),兩組差異無統(tǒng)計(jì)學(xué)意義(x2=0.300,P=0.584)。
2.2 兩組血清腫瘤標(biāo)記物水平比較 在治療后3月末,兩組血清AFP、AFU和CA19-9水平無統(tǒng)計(jì)學(xué)差異(P>0.05,表2)。
2.3 兩組并發(fā)癥發(fā)生情況比較 在術(shù)后3月末,觀察組并發(fā)癥發(fā)生率顯著低于對照組(P<0.05,表3)。
2.4 兩組遠(yuǎn)期生存率比較 隨訪3~36個(gè)月,中位隨訪18個(gè)月。觀察組累積生存率為73.2%(52/71),對照組為71.8%(51/71),兩組差異無統(tǒng)計(jì)學(xué)意義(Log-rank值=0.086,P=0.763,圖3)。
圖1 原發(fā)性肝癌患者腹部實(shí)時(shí)超聲造影表現(xiàn) ①64歲男性,病灶位于肝左葉;②同一患者,微波消融治療前動(dòng)脈期腫瘤迅速增強(qiáng),治療后動(dòng)脈期強(qiáng)化明顯減弱
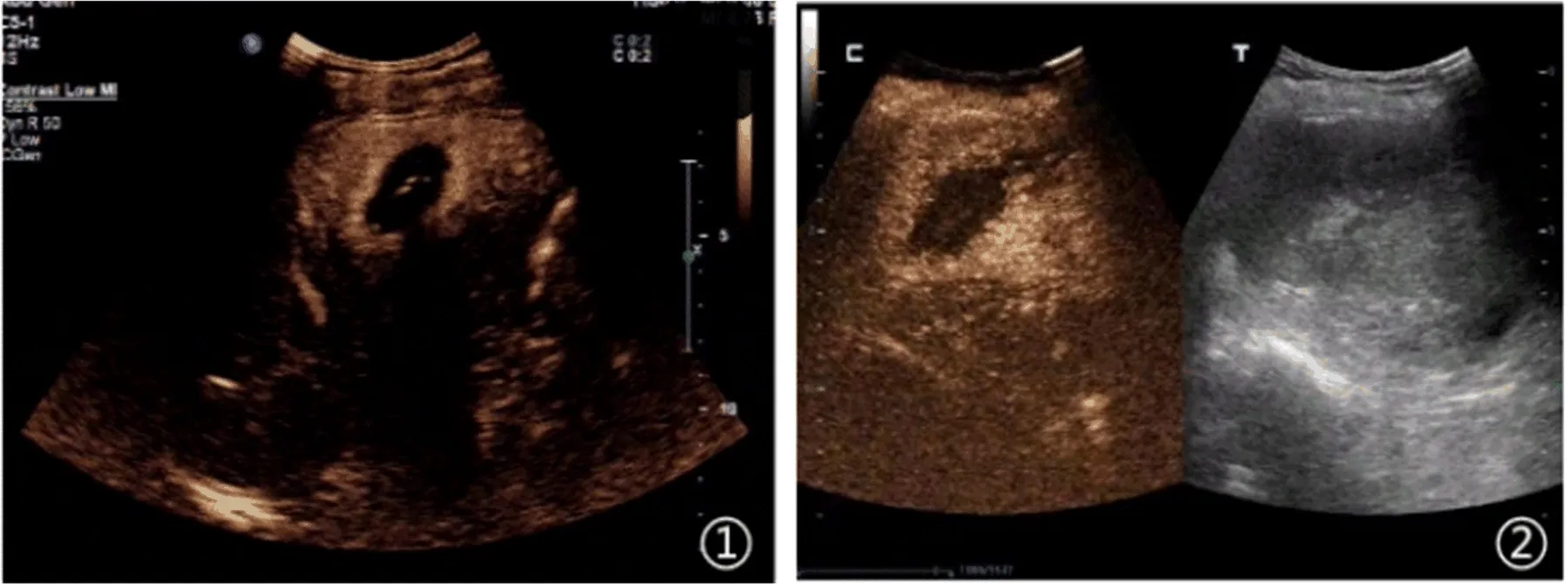
圖2 原發(fā)性肝癌患者腹部實(shí)時(shí)超聲造影表現(xiàn)①60歲女性,病灶位于肝左葉;②同一患者,微波消融治療前動(dòng)脈期有回聲,治療后動(dòng)脈期顯示無回聲,邊緣清晰
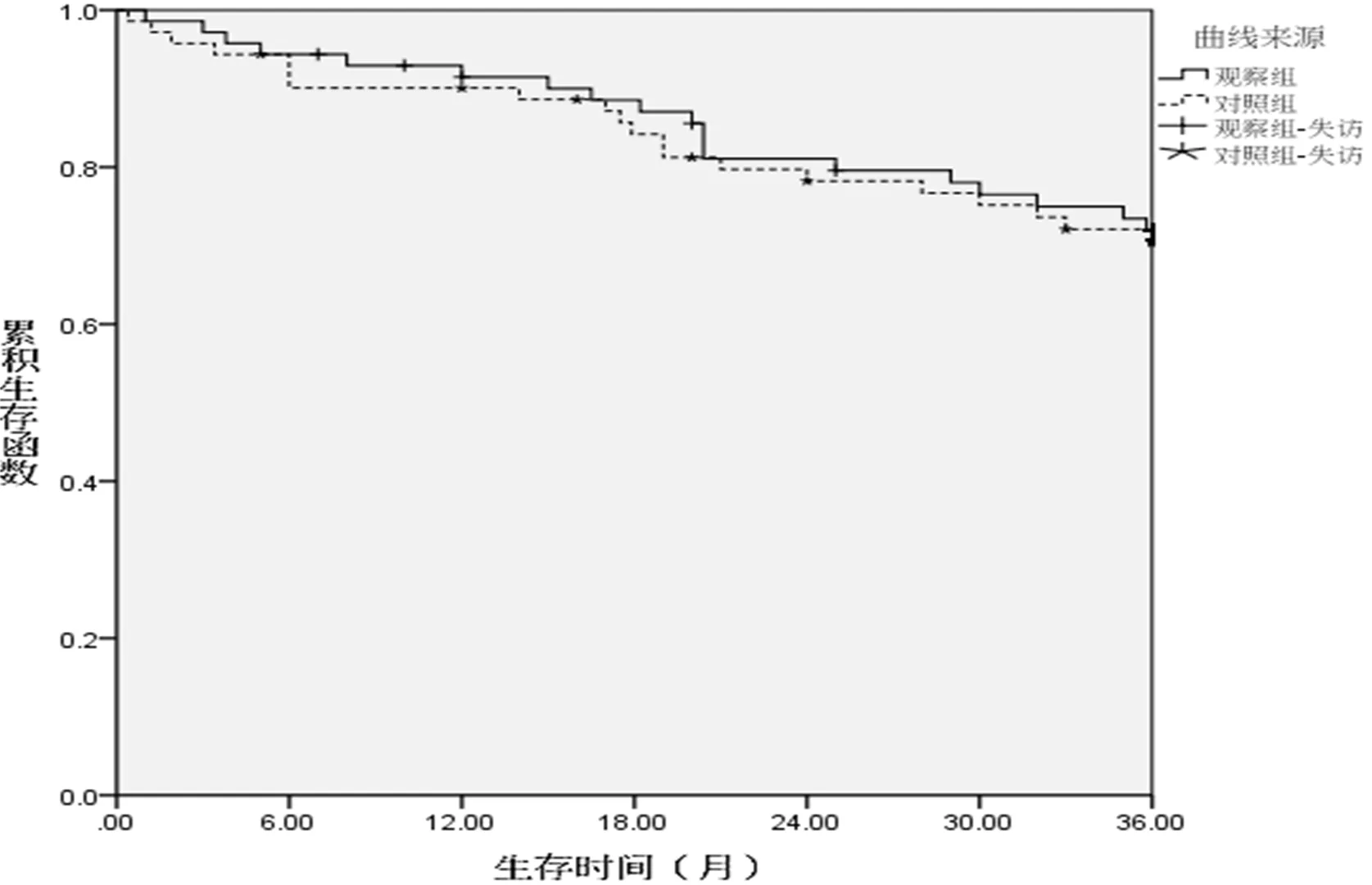
圖3 兩組累積生存率比較
表2 兩組血清腫瘤標(biāo)記物水平比較

表3 兩組并發(fā)癥發(fā)生率(%)比較
與對照組比,①P<0.05
3 討論
目前,微創(chuàng)療法和手術(shù)切除等均為早期小肝癌的有效治療方法,其中微創(chuàng)療法療效顯著,創(chuàng)傷輕微,并發(fā)癥發(fā)生風(fēng)險(xiǎn)低,患者恢復(fù)快,臨床應(yīng)用較為廣泛[8-11]。微波消融技術(shù)屬微創(chuàng)療法中常用的手段,近年來多被用來治療肝癌。報(bào)道顯示,傳統(tǒng)微波消融治療往往基于超聲引導(dǎo)下才能開展。若病灶與周圍肝組織回聲僅存在較小的差異,或周圍組織有雜亂回聲,常規(guī)超聲檢查對病灶的顯示程度較差,無法實(shí)現(xiàn)準(zhǔn)確的定位[12-15]。超聲造影已被廣泛用于消融治療的引導(dǎo),可增加腫瘤與周圍肝組織間的對比度,于動(dòng)脈期或延遲期迅速、準(zhǔn)確定位病灶,準(zhǔn)確反映病灶的實(shí)際大小,引導(dǎo)消融針的穿刺,必要時(shí)還可指導(dǎo)予以補(bǔ)充消融[16-18]。采用實(shí)時(shí)超聲造影定位腫瘤的準(zhǔn)確性高達(dá)92.3%,接近增強(qiáng)MRI或CT[19]。隨著計(jì)算機(jī)處理技術(shù)的應(yīng)用,采用實(shí)時(shí)超聲造影結(jié)合融合影像導(dǎo)航技術(shù)下微波消融治療肝癌逐漸應(yīng)用于臨床,可顯著提高療效[20]。
本研究觀察組完全消融率為93.8%,對照組完全切除率達(dá)100.0%,與既往報(bào)道[15]一致,證實(shí)兩種方案近期療效確切。
- 實(shí)用肝臟病雜志的其它文章
- 《實(shí)用肝臟病雜志》2021年征稿、征訂啟事
- 舉足輕重,持續(xù)關(guān)注肝病營養(yǎng)問題
- 阿舒瑞韋聯(lián)合達(dá)拉他韋治療慢性丙型肝炎患者初步療效及其病毒準(zhǔn)種變化和耐藥變異特征分析*
- 雙鏡微創(chuàng)術(shù)聯(lián)合術(shù)后吲哚美辛栓治療膽囊結(jié)石合并膽總管結(jié)石患者效果研究*
- 經(jīng)皮肝穿刺膽管造瘺電子膽道鏡取石術(shù)治療肝內(nèi)膽管結(jié)石患者并發(fā)癥發(fā)生及其影響因素分析*
- 超聲聯(lián)合CT檢查在肝惡性腫瘤射頻消融治療中的應(yīng)用價(jià)值探討*

