FibroScan聯合多種預測模型預測肝硬化患者食管靜脈曲張程度應用價值探討
李 娜,鄭少秋,趙守松
目前,胃鏡是明確食管胃底靜脈曲張程度的“金標準”, 美國肝病研究協會(American Association for the Study of Liver Diseases,AASLD)建議,所有新診斷的肝硬化患者應行食管胃十二指腸鏡(oesophago-gastro-duodenoscopy,EGD)檢查以篩查食管靜脈曲張,識別出血的高危人群,以便給藥預防[1-3]。無靜脈曲張的患者應該每2~3年接受一次內鏡檢查,小靜脈曲張者每1~2年接受檢查,失代償期肝硬化患者即使無靜脈曲張也要每年接受胃鏡檢查。但胃鏡屬侵入性檢查,部分患者依從性差。約50%肝硬化患者在肝硬化初診后的10年內可能不會發展為食管靜脈曲張[4],且大多數接受EGD篩查的肝硬化患者或者沒有靜脈曲張,或者有不需要預防性治療的輕度食管靜脈曲張[5]。根據中度靜脈曲張和重度靜脈曲張的患病率,出血的最高風險為15%~25%。本研究在142例接受胃鏡檢查的肝硬化患者,使用FibroScan檢測肝臟硬度值(liver stiffness measurement,LSM)并聯合肝纖維化診斷模型天冬氨酸氨基轉移酶/血小板比值指數(aspartate aminotransferase- to- platelet ratio index,APRI)、基于 4 因子的纖維化指數(fibrosis index based on the 4 factors,FIB- 4)[6,7]和γ-谷氨酰轉肽酶/血小板計數模型(gamma-glutamyl transpeptidase to platelet ratio,GPR),探討了聯合預測肝硬化患者食管靜脈曲張程度的應用價值。
1 資料與方法
1.1 病例來源 2018年1月~2019年2月就診于蚌埠醫學院第一附屬醫院感染病科和消化科并接受胃鏡檢查的肝硬化患者,參照 2011 年版《肝硬化中西醫結合診療共識》的標準診斷[8]。食管靜脈曲張程度的分級參照《肝硬化門靜脈高壓食管胃靜脈曲張出血防治指南 (2015年)》[10],將食管靜脈曲張呈直線形或略有迂曲,無紅色征的患者分為輕度EV組(G1);將食管靜脈曲張呈直線形或略有迂曲,有紅色征或食管靜脈曲張呈蛇形迂曲隆起但無紅色征的患者分為中度EV組(G2);食管靜脈曲張呈蛇形迂曲隆起且有紅色征或靜脈曲張呈串珠狀、結節狀或瘤狀(不論是否有紅色征)分為重度EV組(G3) 。排除標準:未行胃鏡檢查、既往有脾切除史、TIPs治療史、1個月內發生消化道出血或既往經過胃鏡下治療者、診斷未原發性肝癌、存在影響瞬時彈性成像檢查準確性的因素,如腹水、肋間隙過窄[9]、肝外原因所致的門靜脈高壓和非肝硬化引起的脾腫大、使用對骨髓有抑制或促進作用的藥物、有血小板減少家族史、近期內使用過降門靜脈壓力的藥物,如β-受體阻滯劑。
1.2 臨床檢測和檢查 根據患者年齡、肝功能指標和血常規結果,計算APRI、FIB-4和GPR。計算公式如下:FIB-4=年齡×AST/PLT×ALT1/2、APRI=AST(/ULN)/PLT(×109/L)×100(其中ULN為AST的正常參考值上限)、 GPR=GGT/PLT;使用OlympusGFl50電子胃鏡(日本奧林巴斯株式會社)檢查,觀察有無食管胃底靜脈曲張和食管胃底靜脈曲張的程度;使用FibroScan 502瞬時彈性掃描儀(法國EchoSens公司)檢測LSM,取10次測量數據的中位數,單位為kPa[11]。
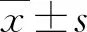
2 結果
2.1 基本情況 本研究納入肝硬化患者142例,男性102例,女性40例;年齡23~75(48.87±11.01)歲,其中乙型肝炎肝硬化127例,丙型肝炎肝硬化9例,酒精性肝硬化3例,自身免疫性肝炎肝硬化2例,不明原因肝硬化1例 ;胃鏡檢查發現無EV組49例,有EV組93例(輕度28例,中度30例,重度35例)。
2.2 有與無EV組有關指標比較 有EV患者LSM、APRI、FIB-4和GPR均顯著高于無EV組,差異有統計學意義(P<0.01,表1)。
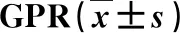
表1 兩組LSM、APRI、FIB-4和比較
與無EV組比,①P<0.01
2.3 不同靜脈曲張程度患者有關指標比較 與無或輕度EV患者比,中度和重度EV患者LSM、APRI、FIB-4和GPR顯著升高,差異有統計學意義(P<0.01,表2)。
2.4 各指標評價靜脈曲張的效能情況 以ROC曲線計算AUROC評估各指標的評判療效,結果見表3和圖1。
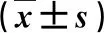
表2 不同食管靜脈曲張程度患者肝纖維化指標比較
與G0或G1組比,①P<0.01

表3 各指標預測EV程度的效能
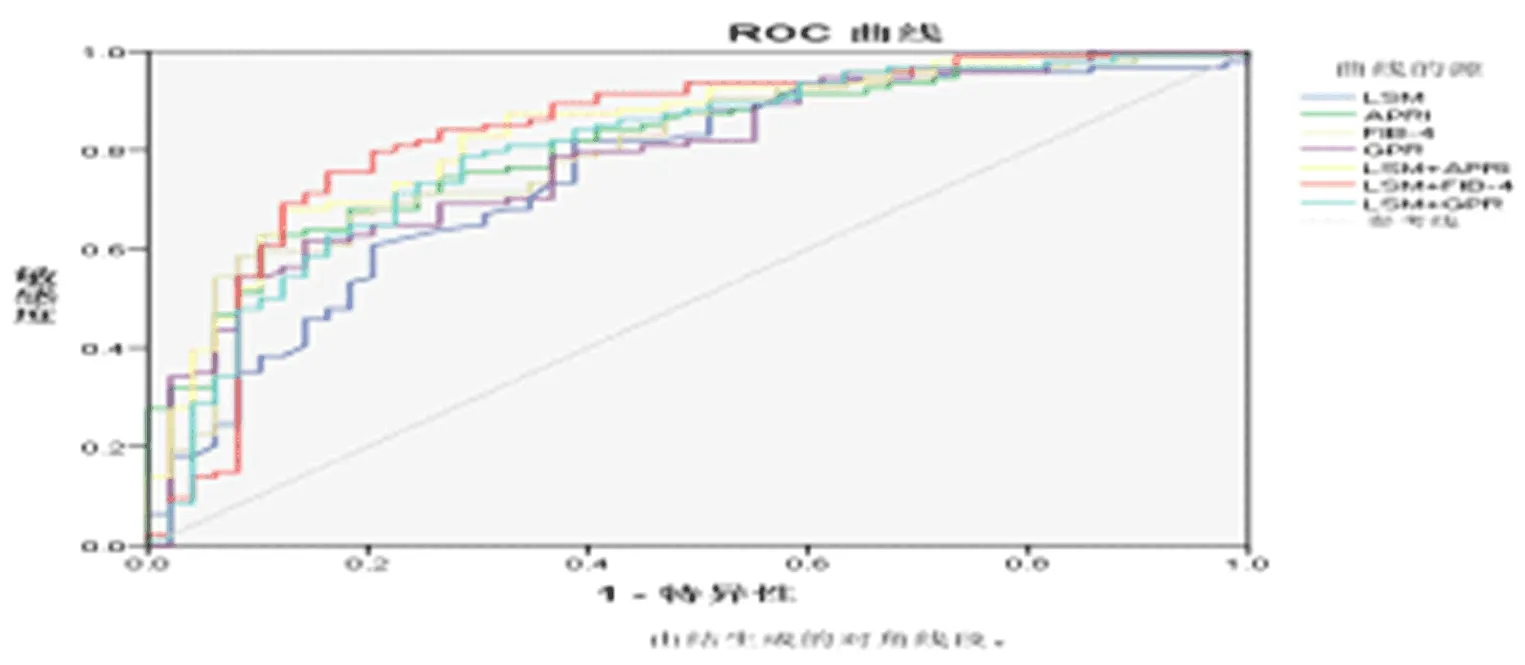
圖1 各指標預測中度以上EV的ROC曲線
3 討論
食管胃底靜脈曲張出血是肝硬化最常見的并發癥,致死率高。目前,胃鏡檢查為診斷和進行EV分級的金標準。然而,胃鏡檢查為有創性,使得部分患者難以耐受,隨訪復查亦受到限制。由于我國人口眾多,肝病高發。因此,尋找無創診斷EV的方法具有重大的臨床意義。本研究結果顯示瞬時彈性成像,即FibroScan檢測聯合血清肝纖維化模型,如APRI、FIB-4和GPR評分可作為一種無創檢測方法預測是否存在EV和評估EV的嚴重程度。
應用LSM作為肝硬化和食管靜脈曲張預測指標的有效性已經在一些研究中得到證實[12-16]。LSM對評估是否存在EV,其截斷點為13.9~21.5 kPa,AUROC值波動在0.76 ~0.85之間,診斷的靈敏度為84%~95%,特異性為43%~78%。在預測重度EV時,其AUROC為0.76~0.87,診斷的靈敏度為77%~91%,特異性為60%~85%。基于這些研究結果,2015年Baveno VI共識[17]提出在代償期慢性進展期肝病患者(compensated advanced chronic liver disease,cACLD)和Child A級肝硬化患者,當LSM<20 kPa,且PLT>150×109/L時可不必行胃鏡篩查,這些患者可以通過檢測LSM和PLT進行隨訪。最新的Baveno VI共識提出,當LSM<25 kPa,且PLT>110×109/L時,也可不必胃鏡篩查[18]。然而,LSM的檢測受到肥胖、腹水、肋間隙寬度等因素的限制,一些失代償期肝硬化患者還可能存在轉氨酶異常和膽汁淤積的臨床表現,進而會影響LSM結果的準確性。APRI和FIB-4 指數是近年來國內外用于診斷肝病患者肝纖維化程度的無創診斷模型[19]。有人提出了一種新的血清學指標,即GGT/PLT比值(GPR),以METAVIR肝組織病理學評分系統為參照,證明了GPR在預測顯著肝纖維化(≥F2)、嚴重肝纖維化(≥F3)和肝硬化(≥F4)方面的表現接近或高于APRI和FIB-4[20]。到目前為止,關于GPR與食管靜脈曲張關系的研究還很少。食管靜脈曲張的無創診斷在臨床應用較少,可能主要是它們的可靠性被質疑。綜合最近的一些研究結果[15],發現APRI和FIB-4在預測肝硬化患者存在靜脈曲張或高危靜脈曲張的準確率仍不高,其AUROC從0.677至0.785不等,靈敏度范圍為0.60至0.74。由此可見,單一的診斷技術在評估食管靜脈曲張程度的準確性時存在一定的局限。本研究采用LSM分別聯合APRI、FIB-4和GPR評估EV程度,從而達到取長補短的目的。
根據本研究的結果可見,當LSM≥19.20 kPa或FIB-4≥0.82時,可判斷患者存在中度或重度EV的存在,從而在臨床上需對患者采取藥物干預或手術治療。肝硬化患者的肝損傷程度可能不與EV是否存在及其程度呈正相關關系。EV的存在與消化道出血的關系也需要研究。病因不同,治療方法各異,患者的生活、工作狀態和情緒,都可能影響病情的發展。
本研究應用FibroScan結合血清學指標等無創肝纖維化檢測技術評估了肝硬化患者EV的存在與否及其程度,收集臨床常用的實驗室指標,如ALT、AST、GGT和PLT等,再計算常用的無創診斷肝纖維化指數,被用來評估EV的存在,取得了一定的有益結果。對于門診隨訪的肝硬化患者來說實用性較強。由于本研究所收集患者例數較少且導致肝硬化的病因種類較多,年齡跨度大,肝功能情況和治療方法存在差異,可能會導致結果存在偏差,仍需進一步擴大樣本量,采取多中心的臨床研究,以驗證診斷模型的診斷效能。

