茵陳四苓顆粒對膽汁淤積性肝炎大鼠肝功能損害的改善作用及其機制研究*
楊 涓
膽汁淤積性肝炎(cholestasis hepatitis,CH)又稱淤膽型肝炎或膽小管型肝炎,是各種原因引起的膽汁形成、分泌和(或)膽汁排泄異常而導致的肝臟病變,占黃疸型肝炎的2%~8%[1,2]。臨床治療CH主要以糖皮質激素、甘草酸制劑、熊去氧膽酸和S-腺苷-L-蛋氨酸等藥物為主[32],但由于CH的病因多樣,藥物治療往往療效有限。近年來,多項研究證實傳統中醫藥對CH具有較好的治療效果。《傷寒論》中的茵陳蒿湯為疏肝利膽退黃法治療黃疸的基本方,中成藥茵陳四苓顆粒源于茵陳蒿湯,具有疏肝補脾、清熱解毒和利濕的功效,但其具體的治療機制尚不明確。本研究采用α-異硫氰酸萘酯(alpha-naphthylisothiocyanate,ANIT)灌胃法制備CH動物模型,觀察了茵陳四苓對CH大鼠肝功能的改善作用及血清白介素-17(IL-17)和干擾素-γ(IFN-γ)等細胞因子的變化,現將研究結果報道如下。
1 材料與方法
1.1 動物模型的建立 30只雌性SD大鼠,體質量為(200±20)g,購于昆明醫科大學實驗動物中心(合格證號為16054411)。隨機將動物分為對照組、模型組和茵陳四苓顆粒處理組,每組10只。適應性飼養1 w,自由飲用純凈水,飼養環境相對濕度為60%,環境溫度為22~25℃,進食高壓消毒滅菌不含致敏原的飼料,每周更換墊料2~3次,每12 h交替光照。對照組不予任何特殊處理;模型組以100 mg.kg-1ANIT經口灌胃,制備CH大鼠模型,灌胃前后12 h自由飲水,禁食,12 h后恢復正常飲食。每周灌胃1次,連續3 w。在第3次灌胃后48 h,予以20%烏拉坦(0.5 ml/100 g)腹腔注射麻醉,無菌條件下留取腹主動脈血和肝組織標本;在藥物處理組,以模型組相同方法制備CH大鼠模型,并于造模結束后給予茵陳四苓顆粒2.0 g.kg-1溶解于飲用水后經口灌胃,3次/d,持續3 w。標本留取方法同模型組。實驗過程符合《中華人民共和國實驗動物管理條例》的有關規定。
1.2 主要儀器、試劑和藥物 全自動生化分析儀(美國貝克曼公司);低溫高速離心機(美國Sigma公司);實時熒光定量PCR儀(美國賽默飛公司);蛋白質核酸電泳分析儀(美國Bio-Rad公司);酶標儀(美國Thermo公司);顯微鏡、顯微攝像及圖像分析系統(日本Olympus公司);ANIT(美國Sigma公司);兔抗鼠IL-17、抗IFN-γ、超氧化物歧化酶(SOD)、丙二醛(MDA)試劑盒(武漢明浩生物科技股份有限公司);反轉錄試劑盒(美國Fermentas公司);引物由上海信裕生物科技有限公司設計;茵陳四苓顆粒(西南醫科大學附屬中醫醫院,川藥制字Z20070525)。
1.3 實驗室檢測 經腹主動脈抽血6 ml,置于真空干燥管,室溫靜置0.5 h,離心(3000 r/m,10 min),將上清液分裝后,保存于-20℃待測。采用ELISA法檢測血清IL-17、IL-4、IFN-γ水平;采用比色法檢測血清SOD和MDA水平。取肝組織,以10%中性福爾馬林溶液固定,脫水、石蠟包埋,采用HE染色,觀察肝組織病理學變化。另取肝組織,置于液氮中迅速冷凍,保存于-80℃,使用試劑盒提取總RNA,逆轉錄合成cDNA,設計合成引物,IL-17上下游引物分別為:5′-GGGAAGTTGGACCACCACA-3′、5′-CCCACCAGCATCTTCTCCA-3′;IFN-γ上下游引物分別為:5′-CATCAGCAACAACATAAGTGTCATC-3′、5′-CATTGACAGCTTTGTGCTGGA-3′;SOD上下游引物分別為:5′-GGGGTACCCTTATGGCGACGAAGGCCGTG-3′、5′-GCTCTAGATTATTGGGCGATCCCAATTACA-3′; 法尼酯X受體(FXR)上下游引物分別為:5′- GCAACTGCGTGATGGATATG-3′、5′- TTCTCCCTCGCATAGCTTGGT -3′;建立PCR反應體系,采用PCR法檢測IL-17、IFN-γ、SOD和FXR mRNA水平。

2 結果
2.1 三組大鼠血清肝功能指標比較 藥物干預組動物血清ALT、AST、ALP、TBIL和GGT水平顯著低于模型組(P<0.05,表1)。
2.2 三組大鼠血清炎癥因子水平比較 藥物干預組動物血清IL-17、IFN-γ和MDA水平顯著低于模型組,而血清SOD水平顯著高于模型組(P<0.05,表2)。
2.3 三組大鼠肝組織病理學變化 見圖1。
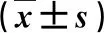
表1 三組血生化指標比較
與模型組比,①P<0.05;與對照組比,②P<0.05
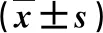
表2 三組血清炎癥因子水平比較
與模型組比,①P<0.05;與對照組比,②P<0.05

圖1 三組大鼠肝組織病理學變化(HE,100×)A:對照組大鼠肝組織結構正常;B:模型組大鼠肝小葉結構破壞,肝細胞腫脹,呈水樣變性和羽毛樣變性,膽管上皮細胞腫脹、空泡化和壞死,腔內可見脫落的膽管上皮細胞碎屑,部分肝細胞和膽小管腔內可見微膽栓形成,匯管區膽管擴張,纖維組織增生,中性粒細胞浸潤,肝竇明顯擴張;C:藥物干預組大鼠肝組織小葉結構基本完整,少量炎性細胞浸潤,肝細胞形態基本正常,匯管區無纖維組織增生
2.4 三組大鼠肝組織IL-17、IFN-γ、SOD、FXR mRNA水平比較 藥物干預動物肝組織IL-17和IFN-γ mRNA水平顯著低于,而SOD和FXR mRNA水平顯著高于模型組(P<0.05,表3)。
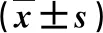
表3 三組肝組織炎癥因子mRNA水平比較
與模型組比,①P<0.05;與對照組比,②P<0.05
3 討論
長期的膽汁淤積可因淤積的膽汁酸破壞生物膜的脂質成分導致肝細胞發生變性、壞死,引起肝組織匯管區和小葉炎性細胞浸潤,進而誘發肝臟的持續慢性炎癥及纖維化,最終導致肝硬化的發生。此外,反復出現的高膽紅素血癥也容易誘發急慢性肝功能衰竭等不良臨床結局。ANIT是一種間接性的肝臟毒性物質,其作用機制為增強肝臟的過氧化過程,從而增加氧自由基的生成,導致肝細胞膜發生脂質過氧化反應,引起肝細胞變性、壞死。此外,它還可以直接導致肝內膽管上皮細生及小葉間膽管周圍炎癥,引起肝內膽管阻塞,最終導致廣泛性的膽汁淤積[4]。采用該方法制備CH動物模型,動物生化指標改變較為準確,可以較好地模擬臨床肝內膽汁淤積患者的病理生理變化,我們的研究結果也提示采用ANIT造模后大鼠肝臟生化及病理學變化與CH患者臨床病變特點具有較好的吻合,為后續應用茵陳四苓顆粒進行藥效學研究提供了良好的動物模型。
CH主要的發病機制為肝細胞損害導致壞死后膽紅素和膽汁酸等物質排泌障礙;毛細膽管上皮腫脹、受壓,小膽管內膽栓形成;肝細胞壞死、毛細膽管破裂,血膽屏障受損,膽紅素等進入血液等引起肝內膽汁淤積[5-7]。本研究結果顯示,茵陳四苓顆粒干預組大鼠肝損害減輕。經茵陳四苓顆粒處理后動物肝臟病理學損害明顯改善,提示茵陳四苓能夠有效抑制肝細胞炎癥反應,減少膽管上皮細胞腫脹、變性和壞死,促進肝細胞再生,保持膽管通暢。
多項研究[8-12]已證實,過氧化和炎癥因子失衡等共同參與了CH的發病過程。IL-17是來源于T細胞的細胞因子,可促進T細胞激活,刺激內皮細胞、上皮細胞等分泌巨噬細胞刺激因子、IL-6、IL-8等多種細胞因子,介導炎癥的產生。有研究結果顯示其是T細胞誘導炎癥反應早期啟動因子,Th17細胞能通過分泌IL-17,參與急性肝損傷和肝內炎癥過程。有學者報道肝炎患者肝細胞IL-17表達量明顯高于健康人群。IFN-γ可由T細胞、Th1細胞等產生,結合受體后可激活中性粒細胞、自然殺傷細胞等,促進炎癥發生。有研究[13]結果顯示IFN-γ可導致肝實質細胞壞死,誘發肝臟炎癥反應。MDA來源于脂質過氧化過程,是氧自由基攻擊生物膜中的多價雙鍵不飽和脂肪酸引發脂質過氧化作用而形成的產物,可反映細胞受活性氧、自由基攻擊程度。SOD與MDA具有相反生理功能,具有較強抗氧化作用,間接反映機體清除氧自由基的能力[14]。研究[15]證實慢性肝損傷大鼠肝細胞MDA表達量較高,SOD呈低表達狀態。本研究結果顯示,茵陳四苓顆粒干預組血清及肝組織IL-17、IFN-γ、MDA水平低于模型組,SOD水平高于模型組(P<0.05),說明茵陳四苓顆粒可改善炎癥反應,提高抗氧化能力,這可能是其改善CH肝功能損害的作用機制之一。
FXR系核受體超級家族孤核受體,在肝臟膽汁酸、脂質代謝、肝臟炎癥和腫瘤的發展過程中起著重要的調控作用,是近年來膽汁淤積的研究熱點之一[16]。FXR能通過作用于替代途徑限速酶CYP27A及膽汁酸合成經典途徑限速酶CYP7A1,抑制膽汁酸合成[17]。FXR對膽汁酸的合成、解毒和轉運以及肝纖維化形成等方面均有作用[18],其作用機制考慮為FXR能夠通過其下游分子小異源二聚體伴侶受體(small heterodimer partner,SHP)抑制膽汁酸的合成,誘導肝內膽汁酸的排泄,增加膽汁的流動,增加膽汁中磷脂的含量。目前,FXR被認為是治療膽汁淤積類疾病最有前景的靶點[19,20],但相關藥物仍處于研發階段,需大量可靠基礎實驗和臨床試驗進行驗證。本研究結果顯示,茵陳四苓顆粒干預組動物血清指標和肝組織損傷程度均得以減輕,是否具有藥用價值,值得進一步研究。

