30 013例悅安欣苦碟子注射液安全性醫院集中監測
黎元元 方邦江 劉健 苗夢莉 謝雁鳴
摘要?目的:獲得悅安欣苦碟子注射液不良反應(ADR)發生率、發生特征和影響因素。方法:多中心、大樣本、前瞻性醫院集中監測方法,對使用悅安欣苦碟子注射液的住院患者進行監測。結果:在全國20家監測醫院完成監測病例30?013例。首例入組時間為2012年10月,末例結束監測為2015年8月,共發生ADR/ADE?50例,經過三級判定方法,判定ADR?43例,發生率為1.43‰,屬于偶見不良反應(發生率1‰~1%)。其中新的ADR1例,表現為結膜出血;一般ADR共42例,不良反應表現為皮膚瘙癢、皮疹、頭痛為主,累及全身8個不同系統損傷;無嚴重ADR。ADR多發生在用藥當天30?min內,不良反應影響因素分析提示:年齡段為65以上,有過敏史,高濃度,有合并用藥時應重點關注不良反應的發生。結論:安全性醫院集中監測是獲得中藥注射劑不良反應發生率的有效途徑,悅安欣苦碟子注射液的安全性良好。
關鍵詞?悅安欣苦碟子注射液;安全性評價;醫院集中監測;不良反應;皮疹;皮膚瘙癢;注冊登記研究;安全性證據體
Safety?Report?of?30?013?Yueanxin?Kudiezi?Injection?Based?on?Centralized?Hospital?Monitoring
LI?Yuanyuan1,?FANG?Bangjiang2,?LIU?Jian3,?MIAO?Mengli4,?XIE?Yanming1
(1?Institute?of?Basic?Research?in?Clinical?Medicine,?China?Academy?of?Chinese?Medical?Sciences,?Beijing?100700,?China;?2?Emergency?Department,?Longhua?Hospital?of?Shanghai?University?of?Traditional?Chinese?Medicine,?Shanghai?200032,?China;?3?The?First?Affiliated?Hospital?of?Anhui?University?of?Chinese?Medicine,?Hefei?230009,?China;?4?Renmin?University?of?China,?Beijing?100872,?China)
Abstract?Objective:To?obtain?incidence,?characteristics?and?influencing?factors?of?adverse?drug?reactions(ADR)of?Yueanxin?Kudiezi?Injection(YAX).?Methods:A?multi-center,?large-sample,?prospective?hospital?centralized?monitoring?method?was?used?to?monitor?inpatients?who?used?YAX.?Results:A?total?of?30?013?cases?were?monitored?in?20?monitoring?hospitals?nationwide.?The?first?case?was?enrolled?in?October?2012?and?the?last?case?was?monitored?in?August?2015.?ADR/ADE?occurred?in?a?total?of?50?cases.?After?a?three-level?determination?method,?43?cases?of?ADR?were?determined?with?an?incidence?rate?of?1.43?‰,?which?was?an?occasional?adverse?reaction(incidence?rate?1?‰~1%).?One?new?ADR?showed?conjunctival?hemorrhage.?There?were?42?ADR?cases?in?general.?The?adverse?reactions?were?mainly?pruritus,?rash,?and?headache,?involving?8?different?systemic?injuries?throughout?the?body.?There?was?no?serious?ADR.?ADR?mostly?occured?within?30?minutes?of?the?day?of?medication.?Analysis?of?influencing?factors?of?adverse?reactions?suggests?that?the?age?group?is?over?65,?with?a?history?of?allergies,?high?concentration,?and?should?pay?attention?to?the?occurrence?of?adverse?reactions?when?combined?medication?is?used.?Conclusion:Centralized?monitoring?in?safety?hospitals?is?an?effective?way?to?obtain?the?incidence?of?adverse?reactions?of?traditional?Chinese?medicine?injections.?The?safety?of?YAX?injection?is?good.
Keywords?Yueanxin?Kudiezi?Injection;?Safety?evaluation;?Hospital?centralized?monitoring;?Adverse?reactions;?Rash;?Itchy?skin;?Registration?research;?Safety?evidence?body
中圖分類號:R259文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2020.01.006
悅安欣苦碟子注射液是從抱莖苦荬菜中提取總黃酮和腺苷制成的中藥注射劑,具有活血止痛、清熱祛瘀的功效,目前廣泛應用于治療冠心病心絞痛、缺血性中風[1-3]。關于悅安欣苦碟子注射液的安全性問題,既往諸多學者進行了安全性文獻分析、醫院信息系統數據回顧性分析等[4-7],其局限性在于來源于多個文獻的數據質量參差不齊,無法獲得較為準確的不良反應(Adverse?Reaction,ADR)數據,也無法計算ADR發生率。因此,本研究依據國家法規及國家食品藥品監督管理總局2010年發布的中藥注射劑安全性再評價等7個技術指導原則要求[8],基于多中心、大樣本的醫院集中監測設計方法,在全國20家醫療機構進行悅安欣苦碟子注射液醫院集中監測研究,以期獲得ADR發生率和發生特征,為其安全合理用藥提供科學依據。
1?資料與方法
1.1?研究設計?采用前瞻性、多中心、大樣本注冊登記式醫院集中監測方法[9]。
1.2?監測對象?2012年10月至2015年8月期間,在監測機構使用悅安欣苦碟子注射液的住院患者。
1.3?樣本量?根據國際通用“三例原則”,監測前確定樣本量是3萬例。
1.4?監測周期?用藥期間全程觀察。
1.5?監測形式及內容?本監測的形式分為2種,一是由臨床醫師觀察,并由臨床醫師填寫監測表;二是由臨床醫師觀察,繼而將觀察結果上報藥師,由藥師填寫監測表。監測表分為A,B表。A表包括一般信息、診斷信息、用藥信息、聯合用藥信息,所有病例均需填寫;B表是不良事件相關信息,僅登記發生不良事件/反應。A,B表具體內容是:1)一般信息:包括性別、年齡、生命體征、個人過敏史、家族過敏史等;2)診斷信息:包括西醫診斷、中醫診斷、合并疾病;3)用藥信息:包括使用方式、用藥天數、藥物劑量、溶媒、溶媒用量、注射室溫、配液放置時間、注射持續時間、滴速;4)聯合用藥信息:合并用藥名稱、注射前使用的注射劑名稱、注射期間使用的注射劑名稱、注射后使用的注射劑名稱、注射前后是否沖管、注射前后是否更換輸液器;5)不良反應/事件信息:不良反應/事件名稱、發生時間、癥狀、體征、臨床檢驗,不良反應/事件結果、轉歸、預后,懷疑藥品、溶媒、輸液器、并用藥品的名稱、批準文號、通用名、生產廠家、批號、用法用量、室溫等,關聯性評價結果等。
1.6?監測機構
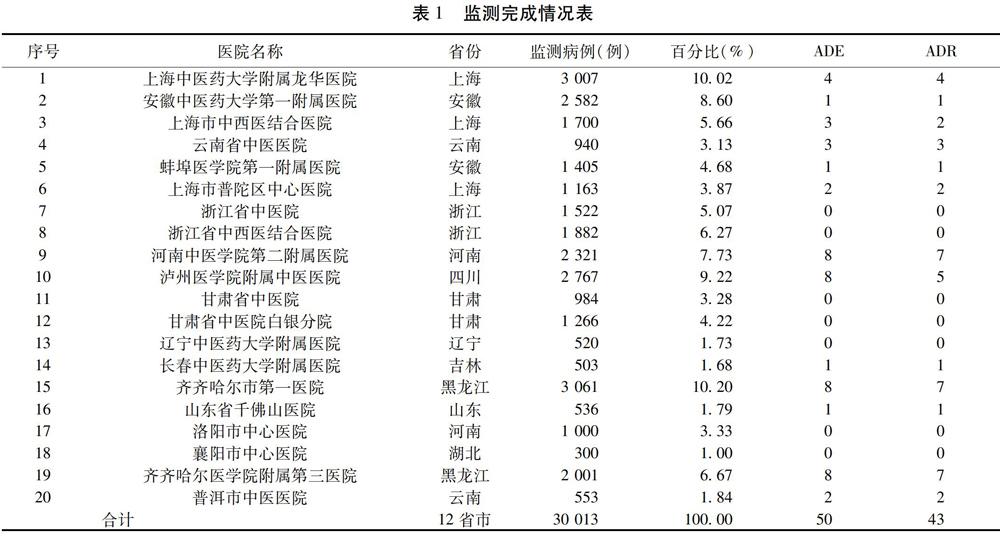
本研究在全國共設有20家監測機構,其中,上海中醫藥大學龍華醫院和安徽中醫藥大學第一醫院作為牽頭負責單位,其余18家為參加單位。
1.7?倫理及臨床注冊
本監測為觀察性研究,對被監測者姓名、性別、家庭住址、聯系方式等隱私信息保密。監測所用方案和觀察表等研究相關資料已通過中國中醫科學院中醫臨床基礎醫學研究所倫理委員會批準(倫理號2012No14)。2013年1月30日通過“Clinicaltrial.gov”國際注冊并獲得注冊號(NO.NCT01781676)[10]。
1.8?數據錄入
采用網上平臺錄入系統的方式,采用雙人雙錄入、差異校驗的方式,通過中藥上市后臨床再評價公共服務平臺(http://www.crpcm.com/),將監測表數據錄入到“悅安欣苦碟子注射液安全性監測數據管理系統”。
1.9?質量控制措施
制定監查及質量控制標準操作規范,采用參加醫院一級檢查、牽頭單位二級監查、高層專家三級稽查的三級監查制度,進行數據質量控制[11]。
1.10?數據標準化
西醫診斷疾病分類編碼參照國際疾病分類(ICD10)[12],中醫病名及辨證參照《中華人民共和國國家標準-中醫病證分類與代碼》(1995版)[13],藥品分類參照《中華人民共和國藥典》[14],ADR編碼參考WHO?ART術語[15]。
1.11?統計學方法
采用SAS?9.2統計軟件編程計算。統計學檢驗均采用雙側檢驗(Two-side?Test),P值小于或等于0.05將被認為所檢驗的差別有統計意義。并利用Excel?2007輔助作圖。
2?結果
2.1?監測完成情況?首例入組時間為2012年10月5日,末例結束監測為2015年8月18日,時間跨度34個月,在全國20家監測醫院,完成監測病例30?013例,發生50例ADR/ADE。根據2011年5月衛生部頒布的《藥品不良反應報告和監測管理辦法》(衛生部令第81號)[16],采取臨床一線醫生報告、監測中心藥品不良反應/事件監測專家委員會評判、組織國內高層專家判讀的不良反應三級判定方法,判定ADR共43例。見表1。
2.2?ADR發生率?ADR發生率為1.43‰(95%CI=1.005‰~1.861‰),根據2005年國際醫學科學組織委員會(CIOMS)推薦標準[17],屬于偶見不良反應(發生率1‰~1%)。其中一般ADR共42例,以皮膚瘙癢、皮疹、頭痛為主;新的ADR1例,表現為結膜出血;無嚴重ADR。
2.3?ADR累及系統及癥狀體征?43例ADR中,不良反應表現為皮膚瘙癢、皮疹、頭痛、嘔吐、胸悶、心悸、頭暈、腹痛、腰背痛、發熱、視覺異常、結膜出血、腹瀉、骨痛、寒戰、惡心、潮紅、紅斑疹、四肢麻木和面部潮紅,累及全身8個不同系統損傷。
2.4?ADR患者基本信息
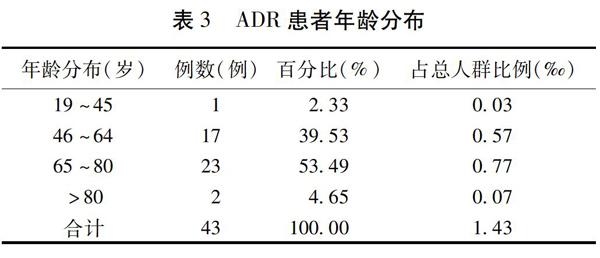
2.4.1?性別年齡分布?43例ADR患者中男16例,女27例,男女比例為1∶1.69。年齡最小42歲,最大者92歲。年齡分布見表3。
2.4.2?過敏史?2例患者有藥物過敏史,過敏藥物為青霉素、鏈霉素、左氧氟沙星;其余41例患者無過敏史。
2.4.3?西醫診斷?西醫診斷最多為腦梗死、其次為冠心病,符合說明書適應證占50%。
2.5?ADR發生特征
2.5.1?ADR出現距用藥時間間隔?43例ADR中,發生時間最早為2?min,最晚為96?h后。半小時內發生最多占39.53%。見表5。
2.5.2?ADR的處理與轉歸?43例ADR中未見嚴重不良反應,處理以停藥與對癥治療為主。有33例停藥觀察未處理,10例停藥并使用處理藥品,其中使用非那根4例,葡萄糖酸鈣注射液2例,VitC2例,西替利嗪2例,柴胡注射液、氧氟沙星滴眼液、英太青、異丙嗪各1例。轉歸為痊愈24例,好轉19例。
2.5.3?停藥或減量后是否減輕?43例ADR中,停藥或減量后痊愈或好轉的40例,未停藥的3例。
2.5.4?再次使用后是否出現ADR?再次使用悅安欣后的結果分為出現ADR、未出現ADR、不明、未再次使用。本監測的43例ADR中,未再次使用的38例,再次使用未出現ADR的2例,不明的3例。
2.6?與ADR相關的藥品使用信息
2.6.1?用法用量?43例ADR均為靜脈點注給藥。用量20?mL的9例,30?mL的3例,40?mL的30例,只有1例為50?mL超出說明書劑量范圍。
2.6.2?溶媒及濃度?溶媒為0.9%氯化鈉注射液32例占74.42%,5%葡萄糖注射液9例,葡萄糖氯化鉀注射液2例。將悅安欣劑量與溶媒劑量比值換算成濃度,取說明書最大劑量與溶媒最小劑量的比值作為正常濃度高限,結果39例為正常濃度,4例為超正常濃度,其中1例超過正常濃度范圍2倍以上。
2.6.3?用藥天數?43例ADR中,用藥1~2?d的24例,3~7?d的17例,8~14?d的2例。
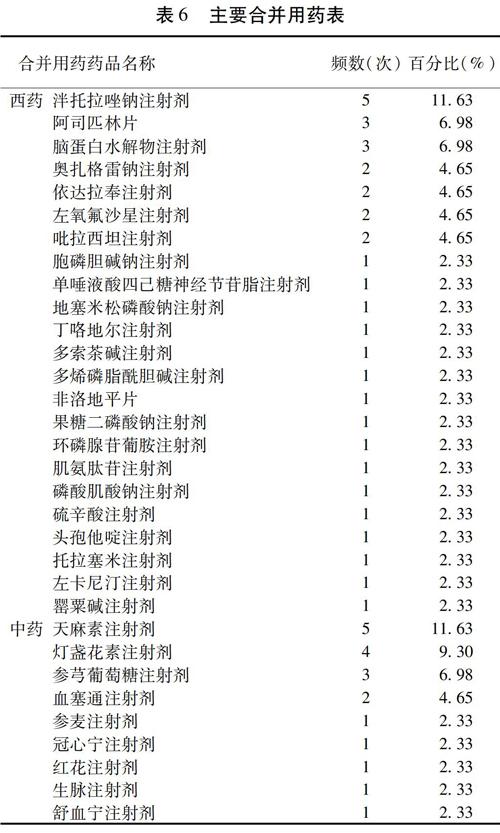
2.6.4?合并用藥?43例ADR中,有合并用藥的共41例,只有2例無合并用藥。41例ADR患者共計35種合并用藥,其中合并西藥23種,合并中藥9種。主要合并用藥及分類見表6。
2.6.5?藥品批號?43例ADR涉及了30個藥品批號。藥品批號為140410的有6例占13.95%最多;藥品批號為131220的有4例占9.30%;其余批號均只有1~2例發生。
2.6.6?不良反應影響因素分析
2.6.6.1?交叉列聯分析
采用影響因素(年齡、過敏史、合并用藥、劑量、濃度、溶媒、合并用藥)兩兩交叉列聯分析,結果顯示年齡段為60以上,特別是年齡>80歲;有過敏史;劑量>40?mL或者濃度>正常范圍;溶媒為5%葡萄糖氯化鉀注射液的患者容易發生ADR。
2.6.6.2?LASSO法對不良反應影響因素分析
先使用SMOTE抽樣方法,再將各個自變量和反應變量(是否出現不良反應)納入到LASSO模型中,找出影響較大的變量(使用R中的grpreg包),抽樣100次,進行強分層主效應分析和交互效應分析。結果顯示:年齡分段65~79,高濃度,有過敏史,合并用藥泮托拉唑鈉注射液、天麻素注射液的時候,發生ADR的可能性大。
3?討論
藥物上市后的安全性研究中,包括大樣本的醫院集中監測研究,基于國家藥品不良反應監測中心SRS數據的ADR信號發現,基于醫院信息系統數據的安全性研究、文獻分析、個案分析等。其中,大樣本、前瞻性的醫院集中監測的數據來源于真實世界,能觀察到不良反應/事件的發生和發生率,得出結論是藥物安全性研究中證據級別最高的[18],也是目前較好的藥物安全性研究方法。悅安欣苦碟子注射液臨床安全性醫院集中監測是一項前瞻性、大規模、多中心、的觀察性研究,納入20個研究中心、30?013例住院患者。研究結果表明,悅安欣苦碟子注射液不良反應發生率為1.43‰,屬于偶見不良反應,不良反應多發生在用藥當天30?min內,主要表現為皮膚瘙癢、皮疹、頭痛、嘔吐、胸悶、心悸、頭暈、腹痛、腰背痛、發冷、視覺異常、結膜出血、腹瀉、骨痛、寒戰、惡心、潮紅、紅斑疹、四肢麻木和面紅等;患者有過敏史,濃度較高,有合并用藥(合用腦苷肌肽注射液等),可能是ADR的影響因素。尤其當出現“頭痛”“頭暈”等預警信號時,臨床尤應重視,以使用藥風險控制到最小,為臨床安全用藥提供警示。
在不良事件和不良反應的觀察方面,本研究可能存在一定的低估的可能性:1)本研究為藥師主導的研究,在不良事件/反應的觀察方面,可能不如醫師直接,可能會出現漏報的情況;2)研究涉及的實驗室指標相對較少,且臨床實際工作中,對于大多數的患者僅進行了一次實驗室檢查,有可能會低估實驗室檢查異常值方面的不良事件/反應。
藥品安全性既關系到百姓用藥安全,關系到企業生存,關系到中醫藥產業的發展方向。藥品作為維護公眾健康的重要工具,藥品安全性作為建立基本醫療衛生制度的一項重要內容,一直被視為關系民生的重大問題之一。2007年12月以來,國家相繼頒布《關于印發中藥注射劑安全性再評價生產工藝評價》等7個技術指導原則等通知,可見重視。悅安欣苦碟子注射液臨床安全性評價結論為臨床安全用藥提供警示,有利于指導臨床安全合理用藥,使臨床用藥風險最小化,為藥品生產企業制定藥品風險控制計劃,完善藥品說明書中不良反應等安全性內容提供依據;也為藥品監管部門相關監管執法、風險防控、審核驗收提供依據。
參考文獻
[1]劉雪梅,陶冶,王鳳麗,等.從“腦心同治”探討苦碟子注射液對急性腦缺血后心肌血管活性物質的影響[J].北京中醫藥,2016,35(7):619-624,713.
[2]方麗萍,肖展翅,柯紅艷.苦碟子注射液對腦梗死恢復期患者血液流變學的影響研究[J].實用心腦肺血管病雜志,2016,24(3):93-94,97.
[3]張孔雁,曹俊杰,王義圍,等.苦碟子注射液聯合磷酸肌酸鈉治療老年冠心病心力衰竭患者的臨床隨機對照研究[J].世界中醫藥,2018,13(11):2758-2761.
[4]崔瑞昭,謝雁鳴,廖星,等.苦碟子注射液用藥安全性的系統評價[J].中國中藥雜志,2017,42(12):2380-2390.
[5]常艷鵬,謝雁鳴.基于文獻的苦碟子注射液(悅安欣)安全性分析[J].中國中藥雜志,2012,37(18):2800-2802.
[6]張兆康,楊薇,劉峘,等.基于傾向性評分的苦碟子注射液對腎功能影響的臨床實效研究[J].中國中藥雜志,2015,40(13):2661-2667.
[7]徐子琦,謝雁鳴,王連心,等.采用傾向性評分法分析真實世界苦碟子注射液對患者ALT和AST影響[J].中華中醫藥雜志,2016,31(3):1064-1067.
[8]國家食品藥品監督管理局.關于印發中藥注射劑安全性再評價生產工藝評價等7個技術指導原則的通知[J].藥物不良反應雜志,2010,12(5):341-342.
[9]楊薇,謝雁鳴,王永炎.中醫藥臨床實效研究——中藥注射劑注冊登記式醫院集中監測方案解讀[J].中國中藥雜志,2012,37(17):2683.
[10]黎元元,李志強,謝雁鳴.基于循證藥學的悅安欣苦碟子注射液上市后安全性研究[J].世界中醫藥,2014,9(9):1120-1124.
[11]姜俊杰,謝雁鳴.中藥注射劑醫院集中監測質量控制方案的優化[J].中醫雜志,2014,55(17):1506-1508.
[12]董景五.疾病和有關健康問題的國際統計分類:第十次修訂本[M].北京:人民衛生出版社,2008:62-67.
[13]陳佑邦,潘筱秦,金棣生,等.中醫病證分類與代碼[M].北京:中國標準出版社,1995:18-22.
[14]國家藥典委員會.中華人民共和國藥典二部(2010年版)[M].北京:中國醫藥科技出版,2010:493-495.
[15]世界衛生組織國際藥物檢測合作中心.WHO藥品不良反應術語集[M].北京:中國醫藥科技出版社,2003:263-268.
[16]《藥品不良反應報告和監測管理辦法》(衛生部令第81號)[EB/OL].[2011-5-4].http://www.sda.gov.cn/WS01/CL0053/62621.html.
[17]廣東省藥品不良反應監測中心.藥品不良反應知識[J].廣東藥學,2010,14(1):42-44.
[18]廖星,謝雁鳴,王永炎,等.藥品安全性證據分級分類探索研究——構建中藥上市后安全性證據體[J].中國中藥雜志,2015,40(24):4723-4725.
(2019-12-10收稿?責任編輯:徐穎)
基金項目:國家重點研發計劃項目(2018YFC1707400,2018YFC1707410);中央級公益性科研院所基本業務費項目(Z0439)作者簡介:黎元元(1976.02—),女,博士,副研究員,研究方向:中藥上市后臨床安全性評價,Tel:(010)64093205,E-mail:chibjyy@163.com通信作者:謝雁鳴(1959.11—),女,首席研究員,博士研究生導師,研究方向:中醫臨床評價,E-mail:datamining5288@163.com

