活血清解靈對膽汁淤積肝病大鼠膽汁酸代謝的影響
李婉華,李錫晶,張婷,沈洪昇,張桂賢,劉洪斌
1天津醫科大學,天津 300070; 2天津市醫藥科學研究所
肝內膽汁淤積是指由于多種原因引起膽汁分泌受阻的病理狀態,持續的肝內膽汁淤積使膽汁流入十二指腸減少,導致腸道膽汁缺乏和血中膽汁成分增多,從而引發膽汁淤積性肝病及相應的全身癥狀[1]。常見的膽汁淤積性肝病包括原發性膽汁性膽管炎(PBC)、原發性硬化性膽管炎(PSC)、自身免疫性肝病和藥物性膽汁淤積等。目前臨床上尚無療效確切且穩定的治療藥物[2]。在中醫學中,膽汁淤積性肝病屬“黃疸”范疇[3],治療多從清熱利濕退黃角度出發。活血清解靈由茵陳、丹參、大黃、白頭翁、敗醬草、甘草六味中藥組成,茵陳清熱利濕,利膽退黃,丹參活血祛瘀;白頭翁與敗醬草清熱解毒,祛瘀排膿,大黃逐瘀通經,利濕退黃,甘草味甘性平[4]。膽汁是一種由肝細胞生成、膽管上皮細胞吸收和轉運進入十二指腸參與代謝的復雜水溶液[5]。膽汁酸是膽汁重要的組成成分,其由膽固醇合成,在驅動膽汁流動,清除體內代謝廢物,促進脂質的消化吸收和調節膽固醇代謝等方面起重要作用[6]。近年來研究發現,膽汁酸作為一種信號分子通過與法尼醇受體(FXR)、G蛋白偶聯受體(TGR5)的結合及通過肝腸循環廣泛調節脂質代謝、免疫功能和腸道菌群[7~9]。既往少見對于膽汁淤積時各膽汁酸成分及膽汁酸代謝的研究。2018年9月~2019年10月,我們通過測定膽汁淤積性大鼠膽汁中18種膽汁酸成分含量,探討活血清解靈對膽汁淤積性肝病膽汁酸代謝的影響。
1 材料與方法
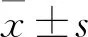
1.1 材料 實驗動物:SPF級Wistar雄性大鼠36只,體質量(220±20)g,購自北京維通利華實驗動物技術有限公司,合格證號11400700347254,飼養環境12 h光照與黑暗交替循環,溫度(22±3)℃,相對濕度(50±10)%,普通飼料喂養,自由進食飼料和水,實驗前適應性喂養1周。藥物與試劑:ANIT購自美國Alfa Aesar公司;復方甘草酸苷膠囊購自瑞陽制藥有限公司;活血清解靈配方顆粒由茵陳、丹參、大黃、白頭翁、敗醬草、甘草組成,購自北京康仁堂藥業有限公司;石膽酸(LCA)、去氧膽酸(DCA)、甘氨石膽酸(GLCA)、甘氨熊去氧膽酸(GUDCA)、甘氨豬去氧膽酸(GHDCA)購自加拿大Toronto Research Chemicals公司;鵝去氧膽酸(CDCA)、膽酸(CA)、熊去氧膽酸(UDCA)、豬去氧膽酸(HDCA)、牛磺熊去氧膽酸(TUDCA)、牛磺豬去氧膽酸(THDCA)購自中國食品藥品檢定研究院;牛磺石膽酸(TLCA)、牛磺去氧膽酸(TDCA)、牛磺鵝去氧膽酸(TCDCA)、牛磺膽酸(TCA)、甘氨去氧膽酸(GDCA)、甘氨鵝去氧膽酸(GCDCA)、甘氨膽酸(GCA)、去氫膽酸(DHCA,內標)、色譜純甲醇和甲酸均購自美國Sigma-Aldrich公司,抗體NTCP和羊抗兔二抗購自美國Abcam公司,抗體tubulin和羊抗鼠二抗購自美國proteintech公司。儀器:島津超高效液相色譜儀 LC-30A 與三重四極桿質譜儀 LCMS-8040 聯用系統;色譜柱:InertSustainC18柱(3.0 mm×100 mm, 3.0 μm);AB135-S型十萬分之一電子分析天平(Mettler Toledo公司);KQ5200B 型超聲波清洗器 (功率200 W,頻率40 kHz,昆山市超聲儀有限公司),TBA2000-FR全自動生化分析儀(日本東芝公司)。
1.2 動物造模及給藥 將48只SPF級Wistar雄性大鼠隨機分為6組,分別為空白組、模型組、復方甘草酸苷膠囊組、活血清解靈低、中、高劑量組。ANIT用橄欖油溶解,以ANIT(100 mg/kg)灌胃1次,制備膽汁淤積性肝損傷模型。復方甘草酸苷膠囊及活血清解靈配方顆粒均用蒸餾水加熱溶解,復方甘草酸苷膠囊組予復方甘草酸苷膠囊22.5 mg/kg,活血清解靈低、中、高劑量組分別給予活血清解靈4.1、8.1、16.2 g/kg,在造模后開始灌胃給藥,連續4 d。
1.3 標本采集及處理 給藥第5天,3%戊巴比妥(40 mg/kg)麻醉,大鼠取仰臥位固定,開腹,膽管插管取膽汁,儲存于-80 ℃用于LC-MS/MS檢測各膽汁酸含量。腹主動脈取血,靜置凝固后離心取上清送至天津市南開醫院檢驗科檢測總膽紅素(IBI)和總膽汁酸(TBA)含量,留取大鼠肝組織儲存于-80 ℃用于Western blotting實驗。
1.4 膽汁酸測定 通過高效液相色譜—質譜聯用法測定膽汁酸成分含量。①空白膽汁的制備:將大鼠膽汁(200 μL)用生理鹽水稀釋10倍,然后加入0.3 g活性炭,渦旋1 min,4 ℃過夜,將混合物離心(12 000 r/min)20 min,收集上清液,重復2次,將該上清液作為無膽汁酸空白膽汁[10]。②標準溶液配制:準確稱量各標準品于容量瓶中,用空白膽汁分別將其配置成1 mg/mL單標儲備液,從各單標儲備液中移取一定量用空白膽汁配制成混標儲備液,DCA、LCA配制濃度為2 μg/mL,TUDCA、GUDCA、THDCA、GHDCA、UDCA、HDCA、TLCA、GLCA、CDCA配制濃度為4 μg/mL,CA、GCDCA、TDCA、GDCA配制濃度為8 μg/mL,TCA、GCA配制濃度為16 μg/mL,TCDCA 配制濃度為24 μg/mL,內標DHCA配制濃度為400 μg/mL,標準溶液均于4 ℃條件下儲存。③樣品處理:移取膽汁樣品20 μL至2 mL離心管中,用生理鹽水稀釋10倍,加入10 μL內標,加入600 μL乙腈,渦旋1 min,離心(12 000 r/min)10 min,取上清于氮氣流下吹干,取流動相200 μL復溶,離心(12 000 r/min)10 min,取上清過濾膜,取70 μL移至進樣瓶中[11]。④色譜條件:色譜柱:InertSustainC18柱(3.0 mm×100 mm , 3.0 μm),流動相:0.01%甲酸水溶液(A)-甲醇(B)梯度洗脫(0~20 min,60~70%B,20~30 min,70~90%B),流速:0.4 mL/min,柱溫:35 ℃,進樣量:20 μL。⑤質譜條件:島津LCMS-8040液質聯用儀,離子源: ESI,負離子模式,加熱模塊溫度: 400 ℃,DL溫度: 250 ℃,霧化氣流速: 3.0 L/min,干燥氣流速: 15 L/min,離子源電壓: 4.0 kV,掃描模式: 多反應離子監測(MRM)。
1.5 肝組織中NTCP蛋白表達檢測 采用Western blotting法。取肝組織稱重,加入蛋白裂解液和蛋白酶抑制劑,在冰上進行超聲破碎,13 000 r/min離心10 min,取上清,用BCA試劑盒進行蛋白定量,將蛋白提取液于95 ℃金屬浴中加熱15 min,每個孔蛋白上樣量為50 μg,蛋白用SDA-PAGE電泳分離,轉膜,室溫下用5%脫脂牛奶封閉2 h,各條帶分別孵育一抗抗體NTCP(1∶1 000)和α-tubulin(1∶5 000)4 ℃過夜,洗膜,室溫下分別孵育羊抗兔二抗(1∶8 000),羊抗鼠二抗(1∶1 000)1 h 30 min,洗膜,加入ECL發光液于化學發光分析儀中曝光。以α-tubulin為標準化參考物,用Image J軟件測量各條帶灰度值。
2 結果
2.1 各組血清IBI和TBA水平比較 見表1。

表1 各組血清IBI和TBA水平比較
注:與空白組相比,*P<0.01;與模型組相比,#P<0.05,##P<0.01。
2.2 活血清解靈對膽汁中膽汁酸濃度的影響 見表2。

表2 各組膽汁酸濃度比較
注:與空白組相比,*P<0.05,**P<0.01;與模型組相比,#P<0.05,##P<0.01;-表示未測出。
2.3 活血清解靈對大鼠肝組織NTCP蛋白表達影響 對照組、模型組、復方甘草酸苷膠囊組、活血清解靈低劑量組、活血清解靈中劑量組、活血清解靈高劑量組NTCP相對表達量分別為1.34±0.08、0.73±0.17、0.93±0.23、0.88±0.23、1.08±0.09、1.26±0.04,與對照組比較,模型組NTCP表達降低(P<0.01);與模型組比較,活血清解靈高劑量組NTCP表達增高(P<0.05)。
3 討論
膽汁淤積性肝病病因復雜,常見病因包括病毒、細菌、藥物/毒物、寄生蟲和自身免疫等。其臨床癥狀多表現為黃疸、皮膚瘙癢、脂肪瀉、乏力和骨質疏松。病情發展最終常導致高膽紅素血癥,重者可導致肝衰竭[12]。活血清解靈通過緩解膽汁淤積,降低血膽汁酸濃度,從而減輕膽汁淤積引起的臨床癥狀和肝臟損傷。
膽汁酸作為一種兩親性的清潔劑類分子,是膽固醇在肝臟代謝的終產物,當其在肝臟內的濃度積累到一定程度后,會產生肝細胞毒性,其毒性大小受到膽汁酸分子疏水性的影響。當發生膽汁淤積時,膽汁酸不能正常轉運進入膽汁,而是通過肝細胞回流進入血液,導致膽汁中的膽汁酸成分減少,而血中的膽汁酸濃度則會增加10~20倍。本研究選擇了常見的18種膽汁酸進行檢測,其中包括6種與甘氨酸結合的膽汁酸和6種與牛磺酸結合的膽汁酸。在膽汁和和肝臟的膽汁酸池中,與牛磺酸和甘氨酸結合的膽汁酸占比超過90%[13]。本實驗中共檢出16種膽汁酸,其中LCA和HDCA在膽汁中含量較低,僅在正常組中測出。除TCDCA外,其余13種膽汁酸在模型組中均有不同程度降低,在經過活血清解靈治療后均顯示出上升趨勢,盡管其中部分膽汁酸上升趨勢不明顯。TCDCA是一種強疏水性膽汁酸,具有較強的細胞毒性作用,在本實驗結果中,TCDCA與其余13種膽汁酸表現出相反的趨勢,模型組中顯著增高,過去研究普遍認為膽汁酸的毒性作用會造成肝細胞和膽管細胞的損傷,而本實驗結果表明,這種細胞毒性作用可能是由某些特定的膽汁酸引起的,TCDCA在膽汁中的累積會進一步加重膽管上皮細胞的損傷,進而引起膽管結構的破壞,而活血清解靈高劑量組的TCDCA表現出顯著下降趨勢,表明其有效干預了膽汁酸譜的組成,降低了具有細胞毒性的膽汁酸濃度,從而有效保護了肝損傷。
研究證明,部分中藥及中藥成分可通過調節膽汁酸代謝相關信號通路影響膽固醇-膽汁酸的代謝[14]。膽汁酸在肝內代謝的主要轉運蛋白包括負責膽汁酸向肝外轉運的膽鹽輸出泵(BSEP)和肝腸循環中負責膽汁酸經門靜脈轉運入肝的NTCP。本實驗選用的造模藥物ANIT可顯著抑制BSEP的活性[15],使得膽汁酸流入膽汁障礙。而Western blotting結果表明,模型組中NTCP含量顯著降低,顯示膽汁酸在肝腸循環回流入肝時出現了轉運障礙,從而進一步加重了膽汁酸在血清中的累積,而經活血清解靈治療后,NTCP含量顯著增高,膽汁酸的轉運障礙得到了有效緩解。
綜上所述,活血清解靈可通過促進膽汁酸的代謝而有效改善肝內膽汁淤積的病理狀態。

