CDCA3在肝細胞肝癌增殖中的作用研究
劉芳 徐細明

[摘要] 目的 探討細胞周期相關因子3(CDCA3)在肝癌中的生物學行為。 方法 收集2018年1月~2019年6月在武漢大學人民醫院肝膽外科行手術治療的肝細胞肝癌患者的組織標本,共30例肝癌標本和癌旁標本;分別采用Real-Time PCR檢測不同組織中的CDCA3的表達情況;采用lip3000轉染法分別將CDCA3干擾RNA序列和對照序列轉入肝癌細胞株,應用CCK-8、EdU免疫熒光染色檢測細胞增殖,流逝細胞術檢測細胞周期。 結果 肝癌組織CDCA3的表達量明顯高于癌旁組織,差異有高度統計學意義(P < 0.01)。HepG2、Huh7、SMMC-7721細胞中CDCA3的表達量明顯高于LO2細胞,差異有統計學意義(P < 0.05或P < 0.01),而BEL-7402細胞中CDCA3的表達量與LO2細胞的表達量比較,差異無統計學意義(P > 0.05)。siCDCA3#1和siCDCA3#2下調SMMC-7721細胞CDCA3的表達量與對照組(siNC)比較,差異均有統計學意義(均P < 0.05),故選取SMMC-7721細胞完成后續研究。siCDCA3#1和siCDCA3#2下調SMMC-7721細胞CDCA3的表達量后,24 h和48 h細胞增殖數明顯低于siNC,差異均有統計學意義(均P < 0.05)。并且EdU檢測陽性細胞數明顯低于siNC。siCDCA3#2下調SMMC-7721細胞CDCA3表達量后,細胞周期的G1期時間較siNC延長,差異有統計學意義(P < 0.05)。 結論 CDCA3能夠促進肝癌細胞增殖,是潛在的治療靶點。
[關鍵詞] 細胞周期相關因子3;肝癌;增殖;細胞周期
[中圖分類號] R735.7? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-7210(2020)05(b)-0014-06
Study on the role of CDCA3 in the proliferation of hepatocellular carcinoma
LIU Fang? ?XU Ximing
Cancer Center, Renmin Hospital of Wuhan University, Hubei Province, Wuhan? ?430060, China
[Abstract] Objective To investigate the biological behavior of cell division cycle associated protein 3 (CDCA3) in liver cancer. Methods Tissue specimens of hepatocellular carcinoma patients who underwent surgical treatment in the Department of Hepatobiliary Surgery, Renmin Hospital of Wuhan University from January 2018 to June 2019 were collected. There were 30 liver cancer specimens and paracancer specimens. Real-time PCR was used to detect the expression of CDCA3 in different tissues. CDCA3 interfering RNA sequences and control sequences were transfected into hepatocellular carcinoma cell lines by lip3000 transfection. Cell proliferation was detected by CCK-8 and EdU immunofluorescence staining, and cell cycle was detected by elapse cytology. Results The expression level of CDCA3 in liver cancer tissues was significantly higher than that in paracancer tissues, and the difference was highly statistically significant (P < 0.01). The expression levels of CDCA3 in HepG2, Huh7 and SMMC-7721 cells were significantly higher than those in LO2 cells, with statistically significant differences (P < 0.05 or P < 0.01), while the expression level of CDCA3 in BEL-7402 cells was not statistically significant compared with that in LO2 cells (P > 0.05). The expression of CDCA3 in SMMC-7721 cells down-regulated by SiCDCA3#1 and siCDCA3#2 was statistically significant compared with that in the control group (siNC) (P < 0.05). Therefore, SMMC-7721 cells were selected to complete the follow-up study. After the expression levels of CDCA3 in SMMC-7721 cells were down-regulated by siCDCA3#1 and siCDCA3#2, the number of cell proliferation at 24 h and 48 h was significantly lower than that in the siNC, and the differences were statistically significant (all P < 0.05). And the number of positive cells detected at EdU was significantly lower than that in the siNC. Compared with the siNC, the G1 phase time of SMMC-7721 cell cycle was prolonged after the expression of CDCA3 in SMMC-7721 cell was down-regulated by siCDCA3#2, and the difference was statistically significant (P < 0.05). Conclusion CDCA3 can promote the proliferation of liver cancer cells and is a potential therapeutic target.
[Key words] Cell division cycle associated protein 3; Liver cancer; Proliferation; Cell cycle
原發性肝癌(以下簡稱“肝癌”)是臨床常見的惡性腫瘤,位居世界癌癥死亡率第5位,5年生存率約為18%[1]。早期肝癌患者的治療主要以手術或局部消融為主,中晚期患者則多采用介入、放化療或靶向等手段[2-3]。受限于當前缺少足夠特異和有效的手段針對高危人群進行早期診斷和臨床前篩查,因此,當肝癌確診時腫瘤已演進多時,導致僅有約1/3的患者適合手術切除。以上種種因素導致了肝癌患者往往容易復發及轉移,5年生存率仍處于較低水平[4]。鑒于當前所面臨的種種困境,尋找肝癌相關標志物,研究其調控的分子機制,具有重要的理論和臨床意義。
前期的研究中,筆者團隊通過基因芯片技術在肝癌組織和癌旁組織中篩選出具有差異表達的信使RNA(mRNA)[5-6]。基因芯片數據表明肝癌組織中細胞周期相關因子3(cell division cycle associated protein 3,CDCA3)的mRNA表達水平較正常肝組織高。CDCA3,又稱Tome-1,是細胞進行有絲分裂過程中所必需的胞質蛋白,其調控著細胞周期的進展[7]。它可以通過淘汰素、S期激酶相關蛋白L共同參與E3連接酶復合物的構成,與絲氨酸/蘇氨酸蛋白激酶、有絲分裂抑制激酶家族成員WEEL的泛素化和降解相關,它是細胞進入有絲分裂的觸發器[8],同時CDCA3也參與細胞周期G1期的調控[9]。近年來,研究發現CDCA3在非小細胞肺癌[7]、胃癌[10]、膀胱癌[11]、白血病[12]、結腸癌[13]、乳腺癌[9]等腫瘤中出現異常高表達的現象,表明其可能在腫瘤的發生發展中起到至關重要的作用,但是在肝癌中的研究較少。本研究旨在探討CDCA3在肝癌中的作用,為肝癌的診斷及治療提供新的分子靶標。
1 資料與方法
1.1 一般資料
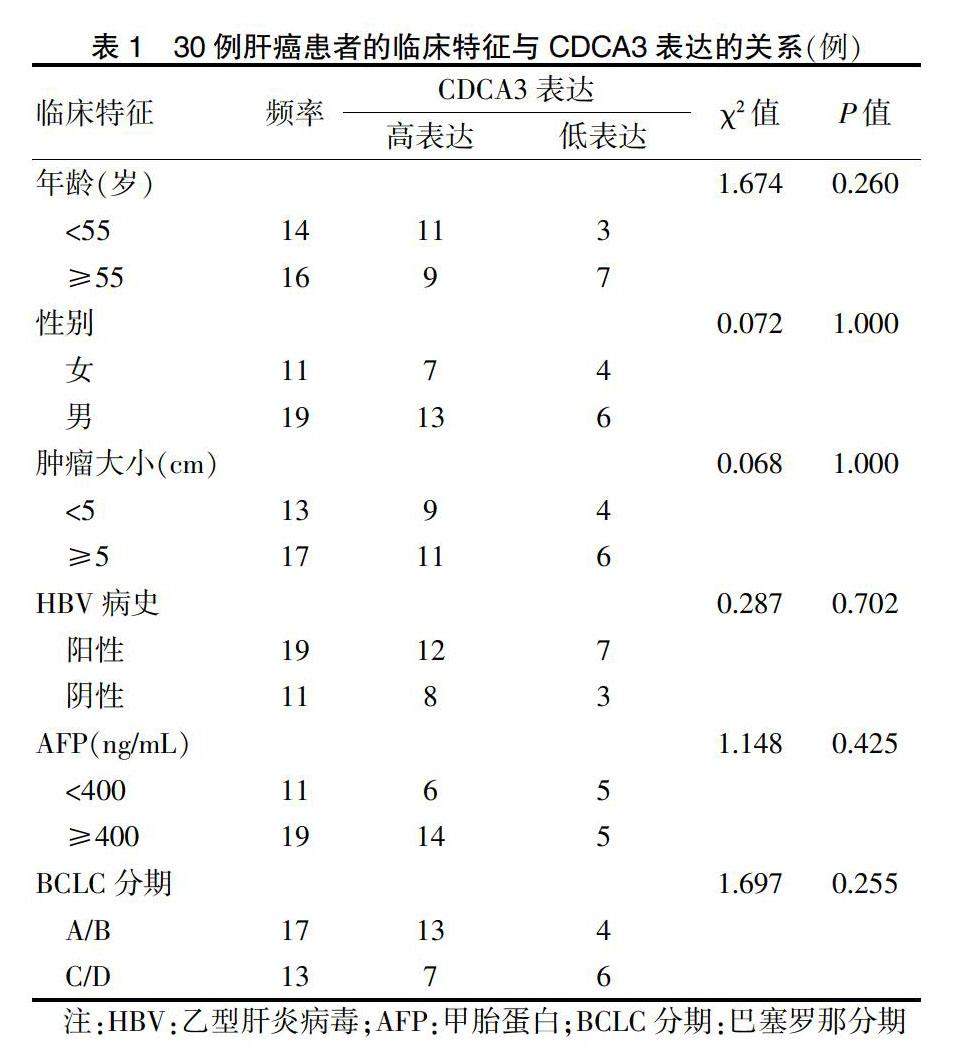
所選30對標本均來自于武漢大學人民醫院(以下簡稱“我院”)肝膽外科2018年1月~2019年6月行肝癌切除術患者所切除的肝癌組織及癌旁組織(距離手術切緣至少2 cm)。術前患者均未接受放化療、射頻消融等輔助治療,術后病理結果證實為肝細胞肝癌,患者的臨床特征如表1所示。所有標本裝入凍存管后迅速保存于液氮中。所有標本的獲取均經過患者允許,本研究經我院醫學倫理委員會審批。
1.2 細胞培養
正常肝細胞系LO2、人肝癌細胞系HepG2、SMMC-7721、Huh7和BEL-7402購買于上海細胞生物學研究所,HepG2、SMMC-7721和BEL-7402采用含有10%胎牛血清(Gibico,南美)和1%青-鏈霉素(谷歌生物,中國)的高糖培養基(Hyclone,美國),正常肝細胞系LO2和Huh7采用含有10%胎牛血清(Gibico,南美)和1%青-鏈霉素(谷歌生物,中國)的高糖培養基(Hyclone,美國)置于37℃、5% CO2細胞培養箱培養(Thermo,美國)。按照70%高糖培養基,20%血清和10%二甲基亞砜(Dimethylsulfoxide,DMSO)進行梯度凍存,保存于液氮。
1.3 細胞瞬時轉染
將生長良好處于對數生長期的肝癌細胞接種于6孔板中,當細胞融合度在70%~80%,棄培養基,換成無血清和抗生素的培養基,置于恒溫培養箱中培養。采用lip3000(L3000015,吉凱基因,中國)脂質體轉染的方法,將干擾RNA(small interfering RNA,siRNA)或者對照序列(S151029151613,銳博生物,中國)用無血清培養基按照說明進行稀釋,室溫靜置5 min后,再輕輕地加入稀釋的lip3000,室溫孵育20 min后輕輕加入6孔板對應的孔中。轉染6~12 h后,換用完全培養基繼續培養,按照實驗所需時間收集轉染細胞。
1.4 實時定量聚合酶鏈反應(Real Time-PCR)
細胞系和組織標本處理:用Trizol(C10268951,Invitrogen,美國)分別提取正常肝細胞、肝癌細胞、30例原發性肝癌組織和對應癌旁組織的總RNA,然后按TOYOBO試劑盒(QPK-201,上海基星生物科技有限公司,日本)說明書將RNA反轉錄成cDNA。
干擾CDCA3表達樣品處理:將CDCA3的siRNA及對照序列分別轉染到肝癌細胞系。轉染48 h后,用Trizol提取總RNA,并用Nano-Drop2000C紫外分光光度計(Thermo,美國)測定RNA濃度及純度。然后按TOYOBO試劑盒(QPK-201,上海基星生物科技有限公司,日本)說明書將RNA反轉錄成cDNA。
最后按照Takara qRT-PCR試劑盒說明書進行操作,20 μL體系,設立3個復孔,甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GDPH)為內參基因,7500 Fast System SDS軟件(BIO-RAD,美國)分析Ct值,按95 ℃ 10 min,90 ℃ 10 s,56 ℃ 30 s,72 ℃ 32 s,40個循環進行擴增,采用2-△△Ct法計算相對表達量。引物序列由武漢巴菲爾生物有限公司設計合成。見表2。
1.5 細胞計數(CCK-8)檢測肝癌細胞增殖
選取處于指數生長期的細胞,精確計數后將細胞調整為(3~4)×104個/mL接種于96孔板,待細胞貼壁后,對細胞進行干預實驗,設置3個重復孔。分別于0、6、24、48 h,棄培養基,加入CCK-8混合反應液,37℃孵育2 h后用酶標儀檢測各孔450 nm的吸光度值。
1.6 EdU免疫熒光檢測肝癌細胞增殖
選取(3~4)×104個/mL的肝癌細胞接種于96孔板中,待細胞貼壁后對細胞進行干預實驗,設置3個重復孔。細胞干預48 h后,棄培養基,加入按照1000∶1的比例稀釋EdU溶液(CA1170,銳博生物,中國)孵育2 h,棄培養液,用磷酸緩沖鹽溶液(phosphate buffer saline,PBS)(Hyclone,美國)清洗2遍。每孔中加入50 μL 4%多聚甲醛(谷歌生物,中國)室溫孵育20 min后,棄廢液;每孔加入50 μL甘氨酸溶液(CA1170,銳博生物,中國),清洗5 min,棄廢液;用PBS清洗5 min,棄廢液;每孔加入100 μL滲透劑(0.5% Tritonx-100的PBS)脫色搖床孵育10 min,PBS清洗5 min,棄廢液;每孔中加入100 μL的1×Apollo染色反應液(CA1170,銳博生物,中國),室溫下避光,置于脫色搖床上孵育30 min,棄廢液;加入100 μL滲透劑脫色搖床清洗2~3次,每次5 min,PBS清洗5 min;每孔加入100 μL 1×Hochest反應液,脫色搖床室溫避光孵育30 min,棄廢液,PBS清洗3次。用倒置熒光顯微鏡(Olympus,日本)觀察并拍照。
1.7 流式細胞術檢測肝癌細胞周期檢測
收集轉染48 h后的細胞,清洗離心后用固定液(1×)配成1×106個/mL的細胞懸液,再加入10 μL試劑B(70-APCC101,聯科生物,中國),室溫避光孵育30 min。用流式細胞儀分析(Becton-Dickinson,USA),采用FACS express version 3軟件分析細胞周期變化情況。
1.8 統計學方法
采用IBM SPSS 20.0(IBM,USA)對所得數據進行統計學分析,計量資料采用均數±標準差(x±s)表示,兩組比較采用t檢驗,多組樣本間比較用ANOVA檢驗;計數資料采用百分率表示,采用χ2檢驗或Fisher確切概率法。以P < 0.05為差異有統計學意義。所有的圖表運用GraphPad Prism 5(GraphPad Software,CA,USA)制作。
2 結果
2.1 CDCA3在肝癌標本中表達情況
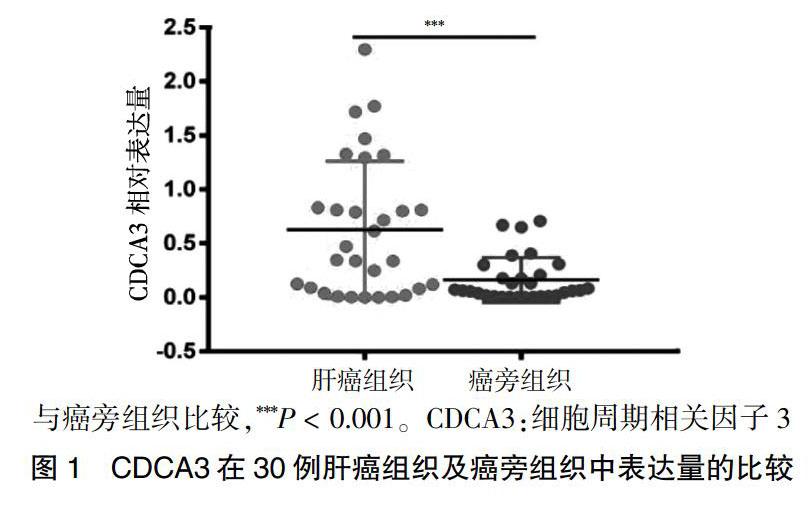
肝癌組織CDCA3的表達量明顯高于癌旁組織的表達量,差異有高度統計學意義(P < 0.01)。見圖1。進一步分析患者信息發現CDCA3表達量高低與患者年齡、性別、腫瘤大小、HBV病史、AFP和BCLC分期無相關性(P > 0.05)。見圖1。
2.2 CDCA3在肝癌細胞系中表達情況
HepG2、Huh7、SMMC-7721細胞中CDCA3的表達量明顯高于LO2細胞的表達量,差異有統計學意義(P < 0.05或P < 0.01)),而BEL-7402細胞中CDCA3的表達量與LO2細胞的表達量比較,差異無統計學意義(P > 0.05)。見圖2。故選取HepG2、SMMC-7721和Huh7細胞作為后續實驗的肝癌細胞系。
2.3 通過siRNA下調CDCA3的表達量
siCDCA3#1和siCDCA3#2下調SMMC-7721細胞CDCA3的表達量與對照組(siNC)比較,差異均有統計學意義(均P < 0.05);siCDCA3#1下調Huh7細胞CDCA3的表達量與對照組(siNC)比較,差異有統計學意義(P < 0.05),而siCDCA3#2下調Huh7細胞CDCA3的表達量與對照組(siNC)比較,差異無統計學意義(P > 0.05);siCDCA3#1和siCDCA3#2下調HepG2細胞CDCA3的表達量與對照組(siNC)比較,差異均無統計學意義(均P > 0.05),見圖3。故選取SMMC-7721作為后期研究的肝癌細胞系。
與對照組(siNC)比較,*P < 0.05。CDCA3:細胞周期相關因子3
圖3? ?不同siRNA序列與對照序列siNC分別轉染肝癌細胞后CDCA3表達量的比較
2.4 CCK-8檢測下調CDCA3表達量對肝癌細胞增殖的影響
siCDCA3#1和siCDCA3#2下調SMMC-7721細胞CDCA3的表達量后,24 h和48 h細胞增殖數明顯低于對照組(siNC),差異均有統計學意義(均P < 0.05)。見圖4。
不同時間段細胞增殖數與對照組(siNC)比較
2.5 EdU檢測干擾CDCA3表達對肝癌細胞增殖的影響
siCDCA3#1和siCDCA3#2下調SMMC-7721細胞CDCA3的表達量后,陽性細胞數(紅色)明顯低于對照組(siNC)。見圖5(封四)。
2.6 流式細胞儀檢測下調CDCA3對肝癌細胞周期的影響
與對照組(siNC)比較,siCDCA3#2下調SMMC-7721細胞CDCA3表達量后,細胞周期的G1期時間延長,差異有統計學意義(P < 0.05),細胞周期的S、G2期時間差異無統計學意義(P > 0.05)。而siCDCA3#1下調SMMC-7721細胞CDCA3表達量后,細胞周期的G1、S、G2期時間與對照組(siNC)比較,差異無統計學意義(P > 0.05)。見圖6。
3 討論
盡管分子診斷和治療策略快速發展,但目前原發性肝癌沒有特異性的治療靶點。因此,急需進一步研究發現更有效的肝癌生物標志物。研究表明細胞周期調節基因的異常表達可導致腫瘤發生,推測細胞周期調節蛋白抑制劑可能成為治療腫瘤的新療法[14]。在前期研究中,本課題組通過高通量測序發現CDCA3在肝癌組織中顯著高表達[5-6],CDCA3是細胞進入有絲分裂的觸發器,且是細胞周期蛋白依賴激酶1(cdk1)/細胞周期蛋白B(cyclin B)的適當激活和細胞進入有絲分裂所必需的蛋白質[15-16]。CDCA3編碼蛋白含有286個細胞有絲分裂的必需胞質蛋白,通過控制有絲分裂入口從而來調節細胞周期[8]。細胞周期的異常調控將導致細胞的過度增殖失控,促使惡性腫瘤的形成,其在腫瘤的發生發展中具有重要意義。CDCA3可以通過影響DNA甲基化,從影響細胞周期的進展[17]。
為了進一步驗證CDCA3在肝癌中的作用,Real Time-PCR檢測發現CDCA3在30例原發性肝癌組織中高表達,與前期高通量測序結果吻合[6]。但由于隨訪時間太短,本研究尚未確定CDCA3表達水平與患者生存時間的相關性。通過細胞實驗,發現下調CDCA3可以抑制肝癌細胞增殖和細胞周期進展。Hu等[18]發現CDCA3可能協同OY-TES-1共同參與肝癌細胞的增殖、遷移、侵襲和凋亡,與本研究結果相符。因此,本研究推測CDCA3可能是原發性肝癌的潛在生物標志物。
根據最近的研究,CDCA3可以通過激活NF-κB/cyclin D1信號通路,從而影響腫瘤細胞增殖,導致腫瘤的發生[17]。CDCA3是否能通過NF-κB/cyclin D1信號通路影響肝癌細胞增殖,后續研究會進一步證實。當然本研究也有不足之處:①只檢查了30例原發性肝癌的組織標本,可能不具有代表性;②細胞系太過單一,應選多株細胞進行實驗;③只是單從細胞水平進行了驗證,需要進一步行動物實驗來驗證CDCA3在原發性肝癌中的功能。總體而言,進一步的研究需要收集足夠的樣品,并且建立動物模型,探討CDCA3與NF-κB/cyclin D1信號通路的關系。
綜上所述,本研究提示,CDCA3可能是癌癥進展的關鍵分子,是預防和治療肝癌的潛在生物標志物和治療靶點。
[參考文獻]
[1]? Siegel RL,Miller KD,Jemal A. Cancer statistics,2019 [J]. CA Cancer J Clin,2019,69(1):7-34.
[2]? Song T. Recent advances in surgical treatment of hepatocellular carcinoma [J]. Drug Discov Ther,2015,9(5):319-330.
[3]? Meng M,Wang H,Zeng X,et al. Stereotactic body radiation therapy:A novel treatment modality for inoperable hepatocellular carcinoma [J]. Drug Discov Ther,2015,9(5):372-379.
[4]? Yang N,Li S,Li G,et al. The role of extracellular vesicles in mediating progression,metastasis and potential treatment of hepatocellular carcinoma[J]. Oncotarget,2017,8(2):3683-3695.
[5]? Zhang MX,Xu XM,Zhang P,et al. Effect of silencing NEK2 on biological behaviors of HepG2 in human hepatoma cells and MAPK signal pathway [J]. Tumor Biology,2016,37(2):2023-2035.
[6]? Yu TT,Xu XM,Hu Y,et al. Long noncoding RNAs in hepatitis B virus-related hepatocellular carcinoma [J]. World J Gastroenterol,2015,21(23):7208-7217.
[7]? Adams MN,Burgess JT,He Y,et al. Expression of CDCA3 Is a Prognostic Biomarker and Potential Therapeutic Target in Non-Small Cell Lung Cancer [J]. J Thorac Oncol. 2017,7(12): 1071-1084.
[8]? Yu J,Hua R,Zhang Y,et al. DNA hypomethylation promotes invasion and metastasis of gastric cancer cells by regulating the binding of SP1 to the CDCA3 promoter [J]. J Cell Biochem,2020,121(1):142-151.
[9]? Phan NN,Wang CY,Li KL,et al. Distinct expression of CDCA3,CDCA5,and CDCA8 leads to shorter relapse free survival in breast cancer patient [J]. Oncotarget,2018,9(6):6977-6992.
[10]? Zhang Y,Yin W,Cao W,et al. CDCA3 is a potential prognostic marker that promotes cell proliferation in gastric cancer [J]. Oncol Rep,2019,41(4):2471-2481.
[11]? Li S,Liu X,Liu T,et al. Identification of biomarkers correlated with the TNM staging and overall survival bladder cancer [J]. Front Physiol. 2017,8:947.
[12]? Bi L,Zhou B,Li H,et al. A novel miR-375-HOXB3-CDCA3/DNMT3B regulatory circuitry contributes to leukemogenesis in acute myeloid leukemia [J]. BMC Cancer,2018,18(1):182.
[13]? Qian W,Zhang Z,Peng W,et al. CDCA3 mediates p21-dependent proliferation by regulating E2F1 expression in colorectal cancer [J]. Int J Oncol,2018,53(5):2021-2033.
[14]? Matera R,Saif MW. New therapeutic directions for advanced pancreatic cancer: cell cycle inhibitors,stromal modifiers and conjugated therapies [J]. Expert Opin Emerg Drugs,2017,22(3):223-233.
[15]? Itzel T,Scholz P,Maass T,et al. Translating bioinformatics in oncology: guilt-by-profiling analysis and identification of KIF18B and CDCA3 as novel driver genes in carcinogenesis [J]. Bioinformatics,2015,31(2):216-224.
[16]? Chen J,Zhu S,Jiang N,et al. HoxB3 promotes prostate cancer cell progression by transactivating CDCA3 [J]. Cancer Lett,2013,330(2):217-224.
[17]? Zhang W,Lu Y,Li X,et al. CDCA3 promotes cell proliferation by activating the NF-κB/cyclin D1 signaling pathway in colorectal cancer [J]. Biochem Biophys Res Commun.,2018,500(2):196-203.
[18]? Hu Q,Fu J,Luo B,et al. OY-TES-1 may regulate the malignant behavior of liver cancer via NANOG,CD9,CCND2 and CDCA3:a bioinformatic analysis combine with RNAi and oligonucleotide microarray [J]. Oncol Rep,2015,33(4):1965-1975.
(收稿日期:2019-11-26? 本文編輯:顧家毓)

