基于UPLC-Q-TOF-MS 分析酵母對葡萄酒中糖苷態香氣物質釋放的影響
安效輝,苗瀛心,陳 倬,張欣珂,段長青,潘秋紅*
(中國農業大學食品科學與營養工程學院,葡萄與葡萄酒研究中心,農業農村部葡萄酒加工重點實驗室,北京 100083)
葡萄果實直接為葡萄酒提供品種香,包括萜烯類、降異戊二烯類、芳香族類、脂肪族類、吡嗪類香氣物質等[1]。這些香氣物質按照其揮發性可以分為游離態和結合態。結合態香氣物質不具有揮發性,沒有直接的香氣貢獻,通常被稱為香氣前體物,但它們可以在葡萄酒發酵和陳釀過程中,被酵母糖苷酶水解或葡萄酒環境酸水解,轉變為有揮發的、可感知的游離態香氣物質[2],進而共同貢獻于葡萄酒的品種香氣。由于結合態香氣物質在葡萄果實總香氣物質中占有很大的比例,因此,這類物質是釀酒葡萄原料中潛在的極為重要的香氣組分,對葡萄酒品質起著重要作用[3]。
結合態香氣物質根據其結合方式的不同可分為兩大類,一類是與單糖或雙糖鍵合形成的糖苷態,另一類是與氨基酸或小分子肽以硫鍵的形式結合的前體物[3]。糖苷態香氣物質的結構分為兩部分,一部分是具有揮發性的配基,另一部分是糖苷配體,二者通過β-糖苷鍵連接[1]。揮發性配基主要是單萜、降異戊二烯等香氣化合物,糖苷配體主要有單糖苷和二糖苷,單糖苷通常是β-D-吡喃葡萄糖苷,雙糖苷主要是己糖基-葡萄糖苷,如6-O-α-L-吡喃鼠李糖苷-β-D-吡喃葡萄糖苷即蕓香糖苷,也有戊糖基-葡萄糖苷,如6-O-α-L-呋喃阿拉伯糖基-β-D-吡喃葡萄糖苷、6-O-α-L-呋喃芹菜糖基-β-D-吡喃葡萄糖苷[4-6]。也有文獻報道鑒定到了單萜三糖苷,以己糖基-戊糖基-己糖苷的形式存在[7]。糖苷態香氣前體物轉化為游離態物質的最終濃度,主要取決于葡萄果汁中糖苷態香氣前體物的濃度、發酵中酵母糖苷態酶的活性、貯藏過程中的葡萄酒pH值和溫度等[3]。
糖苷態香氣前體物在葡萄酒發酵過程中分解方式主要為酶解[8],通過糖苷酶釋放香氣配基可以是一步反應也可以是連續反應。單糖苷可以通過β-葡萄糖苷酶裂解釋放,而二糖苷或三糖苷則需要特定的水解酶降解糖苷鍵,往往先順序斷裂末端的戊糖或己糖,最后裂解O-葡萄糖苷鍵。不過也存在一步切開糖苷鍵的雙糖苷酶,如β-葡萄糖苷內切酶[9]。在發酵過程中,發酵帶來的香氣可以補充品種的香氣[10],酵母中的糖苷酶對葡萄酒香氣的提升具有十分重要的作用[11],且不同菌株在發酵條件下的相對酶活性和特異性底物會有所差異[12-14],因此,釀酒時所用酵母菌株的不同也會影響到葡萄酒的感官香氣和酒體風格,釀酒師可以通過選用不同的酵母菌株對葡萄酒的整體香氣進行微調[15]。
已有研究在許多不同葡萄品種中都檢測到了糖苷結合態香氣物質存在[16-18]。糖苷結合態香氣物質的檢測通常采用氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)聯用的方法,即先固相萃取糖苷態香氣物質,接著用糖苷水解酶(如AR2000)或添加鹽酸進行水解,得到揮發性配基,采用GC-MS對香氣配基進行定性和定量分析[19]。樣品處理所采用的酸解法和酶解法都存在一定的局限性,酸解法中萜烯物質會發生分子重排,導致物質結構改變[20];而酶解法存在酶解不充分的問題,測得的水解產物不能完全代表結合態香氣物質的天然存在形式[21]。也有研究利用液相色譜-高分辨率質譜和二級質譜研究葡萄中的糖苷態香氣物質[7,22-23]。相比之下,超高效液相色譜技術具有更好的穩定性和靈敏度,擁有更好的定性能力,且已經廣泛應用于肉類、乳類藥物殘留檢測等食品安全檢測領域[24-25]。利用超高效液相色譜-四極桿-飛行時間-質譜(ultra-high performance liquid chromatography-quadrupole-time-of-flight-mass spectrometry,UPLC-Q-TOF-MS)法檢測糖苷態香氣物質,不會改變其配基和糖苷的組成,能夠檢測到物質原有的結構形式,可以更好地反映糖苷態香氣物質的含量及其變化,避免水解樣品帶來的弊端。TOF的精確質量檢測可對物質進行精準的推測,進而結合MS/MS檢測結果鑒定物質的結構[2,26]。實驗室在前人研究方法的基礎上[7,22],建立葡萄果實主要糖苷態香氣物質質譜信息庫。本實驗采用UPLC-Q-TOF-MS方法,研究2 種酵母Red Fruit和Zymaf l ore ST分別在‘北冰紅’冰酒和‘威代爾’冰酒的發酵過程中,對糖苷態香氣前體物含量的影響,以及瓶儲1 年后葡萄酒中糖苷態香氣前體物含量的變化,從而評價酵母對糖苷態香氣物質釋放的效應。
1 材料與方法
1.1 材料與試劑
所有樣品均取自吉林通化集安市鴨江谷酒莊。
Zymaf l ore ST酵母 法國Laffort公司;Red Fruit活性干酵母、Extra Zym果膠酶 意大利Enartis公司。
1.2 儀器與設備
RE-52旋轉蒸發儀 上海亞榮生化儀器廠;HX-250恒溫循環器 北京博醫康實驗儀器有限公司;SHB-IIIA循環水式多用真空泵 上海振捷實驗設備有限公司;SHZ-DIII循環水式真空泵 天津奧特塞恩斯儀器有限公司;Agela負壓真空固相萃取裝置 天津博納艾杰爾科技有限公司;1290 Infinicty II UPLC-Q-TOF(6545 Q-TOF)-MS儀 美國安捷倫科技有限公司。
1.3 方法
1.3.1 冰酒發酵流程及取樣
發酵流程:對已達到理論成熟度后70 d的‘北冰紅’葡萄和‘威代爾’葡萄果實,在-13 ℃條件下人工采收,通過振動分選臺進行穗選,用框式壓榨機壓榨,得到的葡萄汁經在線添加90 mg/L SO2,入罐至450 L發酵罐,讓其自然沉淀,并向其中添加果膠酶,6 ℃澄清3 d,分離清汁,待回溫至12 ℃后接種酵母,接種量為30 g/(h·L),發酵溫度控制在12~14 ℃之間,發酵結束(約42 d)后將溫度降低至0 ℃以終止乙醇發酵。倒罐,澄清過濾,過濾后添加100 mg/L SO2。穩定過濾后,用GAI灌裝線,裝瓶于375 mL瓶中,打入天然軟木塞。貯藏于相對濕度60%~70%,溫度(16±1)℃的酒窯中。‘北冰紅’品種每種酵母做2 個重復,而‘威代爾’每種酵母做1 個重復,共6 個發酵罐。
取樣方法:接種酵母前(葡萄汁)取樣1 次,葡萄發酵液比重每下降0.02取樣一次,發酵結束后取樣一次,每個發酵罐每次取樣500 mL于礦泉水瓶中。對用Red Fruit發酵的‘北冰紅’冰酒在過濾和瓶儲1 年后各取樣1 次。所有樣品均于-40 ℃條件下貯藏待用。
1.3.2 糖苷態香氣物質的固相萃取
用10 mL甲醇(分析純)和10 mL純凈水依次活化Cleanert PEP-SPE固相萃取柱,將2 mL冰酒樣品加入活化后的萃取柱中,依次用2 mL水和5 mL二氯甲烷分別洗滌低分子質量的糖、酸等極性化合物和游離態的非極性香氣化合物,最后用20 mL甲醇洗脫并收集糖苷態香氣前體物。將洗脫液置于蒸餾燒瓶中,30 ℃真空旋轉蒸發至干,用2 mL甲醇(優級純)復溶,充分搖勻。取1 mL提取液,加入10 μL內標(100 mg/Ln-辛基-β-D-葡萄糖苷),最后用0.22 μm有機相濾膜過濾待用。
1.3.3 糖苷態香氣物質的檢測
使用UPLC-Q-TOF-MS檢測各種糖苷態香氣物質的含量。
UPLC條件:Agilent SB C18RRHD色譜柱(150 mm×2.1 mm,1.8 μm);流動相為含0.1%甲酸溶液(A相)和含0.1%甲酸的乙腈(B相);流速0.4 mL/min;柱溫35 ℃;進樣量5 μL;梯度洗脫:0~40 min,5%~95% B。
QTOF檢測條件:采用Dual AJS電子電離源,負離子模式;每個循環采集3 個母離子;一級質譜(MS)采集范圍m/z100~900;二級質譜(MS/MS)m/z20~600;采集頻率4 sprctra/s;鞘氣(氮氣)流速10 L/min,400 ℃;干燥氣(氮氣)流速8 L/min,350 ℃;霧化氣壓60 psig;噴嘴電壓1 kV;毛細管電壓3.5 kV。使用標準混合物(調諧液)G1969-85000(Supelco Inc.)進行負質量校準,并且預期質量偏差為±0.2×10-6,校準物質為三氟乙酸銨(m/z112.985 6)和三氟乙酸陰離子加合物(m/z1 033.988 1)。
1.3.4 糖苷態香氣物質的定性定量分析
通過樣品的二級質譜信息與個人化合物數據庫和譜庫(PCDL庫)進行比對,找到具有一定斷裂規律的物質進行定性分析。由于目前可購得的糖苷態香氣物質標準品很少,而且戊糖中的阿拉伯糖、芹菜糖、木糖等化合物均具有相同分子式,大部分單萜組分也有相同的分子式且結構極為相似,在相同的碰撞能量下,同一類化合物的斷裂情況也極為相似,所以本研究只對物質進行種類的定性分析,根據各物質進行相對定量。

1.4 統計學分析
由于固相萃取效率會對實驗結果產生一定影響,每個取樣做2 個萃取重復,每個重復上機做2 個測定平行。采用SPSS統計軟件ANOVA進行顯著性分析;采用Origin Pro 9.0軟件繪圖;測定結果以 ±s表示。
2 結果與分析
2.1 ‘威代爾’和‘北冰紅’冰酒的主要理化指標
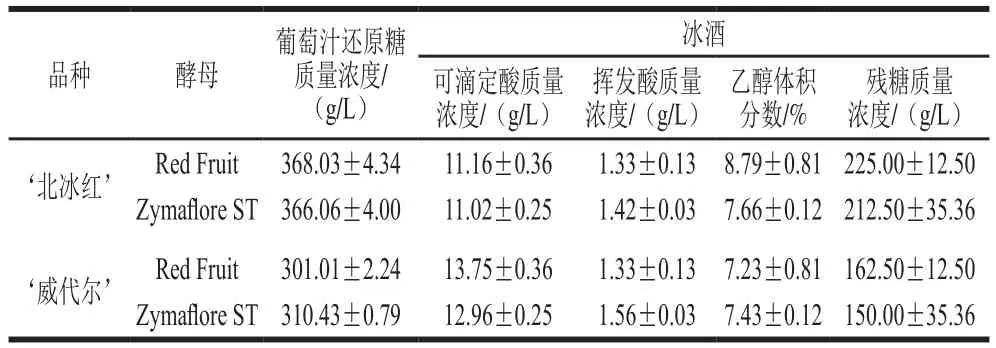
表1 ‘北冰紅’和‘威代爾’冰酒的主要理化指標Table 1 Physicochemical parameters of ‘Beibinghong’ and‘Vidal’ ice wines
2 種冰酒均采用450 L發酵罐進行發酵,如表1所示,2 種酵母發酵結束的‘北冰紅’冰酒中,殘糖質量濃度分別為(225.00±12.50)g/L和(212.50±35.36)g/L結束,乙醇體積分數分別為(8.79±0.81)%和(7.66±0.12)%;而‘威代爾’冰酒中,殘糖質量濃度分別為(162.50±12.50)g/L和(150.00±35.36)g/L,乙醇體積分數分別達到(7.2 3±0.8 1)%和(7.43±0.12)%;‘威代爾’冰酒中可滴定酸含量高于‘北冰紅’,2 種冰酒的揮發酸質量濃度在1.33~1.56 g/L之間,符合GB/T 25504—2010《冰葡萄酒》要求。
2.2 2 個品種葡萄汁中糖苷態香氣物質種類的比較
2 個品種的葡萄汁中共檢測出30多種不同的糖苷態香氣前體物質,其中單萜二醇-戊糖基葡萄糖苷(C21H36O11)、單萜醇-戊糖基葡萄糖苷(C21H36O10)等都檢測到不同的組分,在葡萄果實中,單萜醇有里那醇、香葉醇、香茅醇、橙花醇、α-萜品醇等物質,戊糖基也有阿拉伯糖基、木糖苷、芹菜糖苷等,它們有相同的分子式且結構相似,在相同碰撞能量下,同類化合物(如單萜二醇-戊糖苷葡萄糖苷)有極其相似的斷裂情況,難以確定具體的化合物,但可以通過保留時間進行組分的區分。如表2所示,‘威代爾’葡萄汁糖苷態香氣物質的種類較‘北冰紅’更為豐富,在‘威代爾’中可檢測到2 個葡萄糖苷、24 個戊糖基-葡萄糖苷和5 個己糖基-葡萄糖苷組分,而在‘北冰紅’中只檢測到11 個戊糖苷-葡萄糖苷和6 個己糖苷-葡萄糖苷組分,說明‘北冰紅’冰酒的香氣潛力相對較弱,這印證了前人的研究結果[27]。
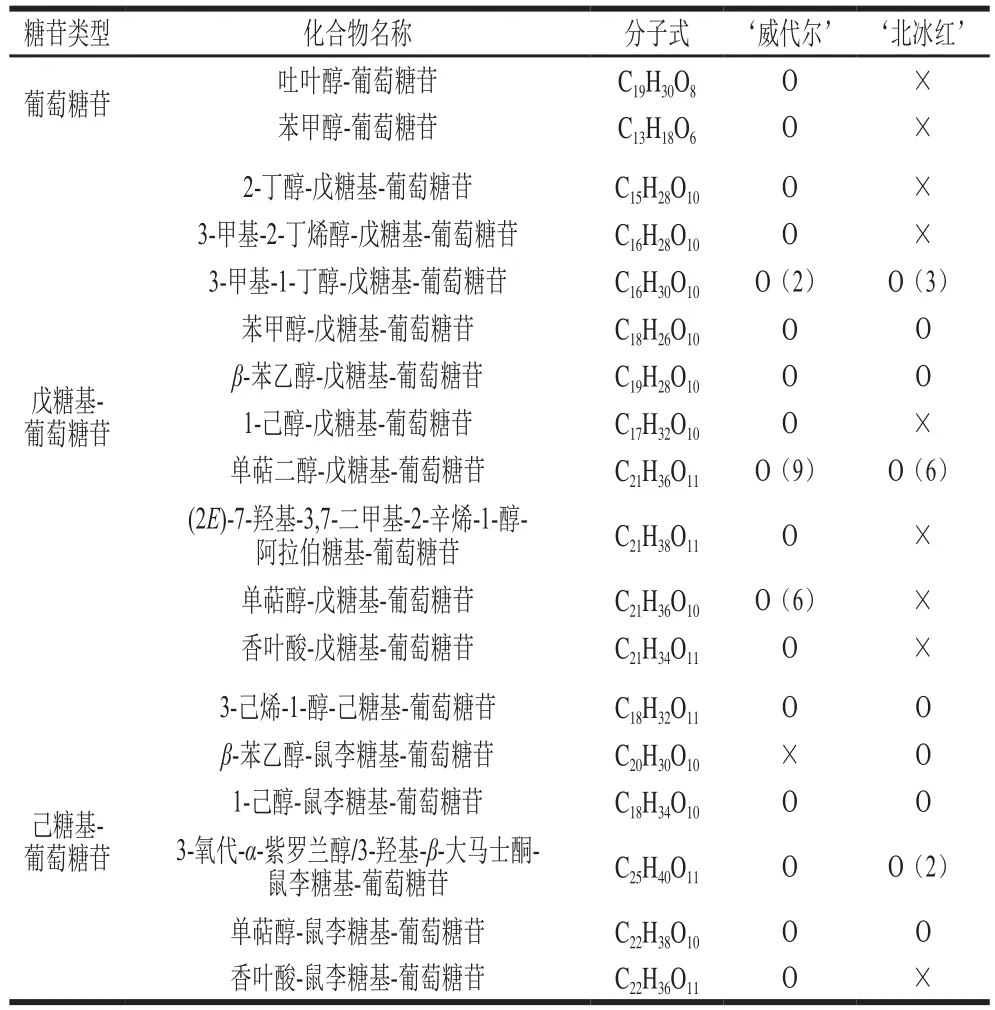
表2 ‘威代爾’和‘北冰紅’葡萄汁中糖苷態香氣物質的種類Table 2 Composition of glycosidically bound aroma compounds in‘Vidal’ and ‘Beibinghong’ grape juices
2.3 ‘北冰紅’冰酒發酵過程中2 種酵母對糖苷態香氣物質釋放的影響
2.3.1 對不同糖苷類型的香氣物質含量的影響

圖1 酵母Red Fruit和Zyma flore ST發酵的‘北冰紅’冰酒過程中不同糖苷類型香氣物質的變化(n=8)Fig. 1 Variations in various aroma glycoside compounds during fermentation of ‘Beibinghong’ ice wine by Red Fruit or Zyma flore ST (n = 8)
如圖1所示,‘北冰紅’葡萄汁在Red Fruit或Zymaflore ST酵母發酵下,戊糖基-葡萄糖苷類香氣物質的含量均逐漸下降,相比之下,Zymaf l ore ST酵母發酵的冰酒中,戊糖基-葡萄糖苷的下降較為明顯,表明該酵母中水解戊糖基-葡萄糖苷的酶活性較高。己糖基-葡萄糖苷類香氣物質的含量在Zymaf l ore ST酵母發酵過程中無顯著變化,在Red fruit酵母發酵過程中甚至有所增加,說明2 種酵母對‘北冰紅’葡萄汁中己糖基-葡萄糖苷香氣物質的水解釋放作用較小,相應的水解酶活性較低。總體上,Zymaf l ore ST酵母和Red Fruit酵母對‘北冰紅’發酵過程中糖苷態香氣物質的影響有限。

表3 ‘北冰紅’冰酒發酵過程中各類糖苷態香氣物質質量濃度的變化Table 3 Variation in various aroma glycosides compounds during ‘Beibinghong’ ice wine fermentation mg/L
2.3.2 對各類糖苷態香氣物質含量的影響
將‘北冰紅’冰酒中鑒定到的結合態組分依據其定性命名歸為9 類,如表3所示,在戊糖基-葡萄糖苷中,結合態單萜二醇是相對含量較高的一類物質,在Red Fruit酵母和Zymaf l ore ST酵母的發酵過程中,其含量均呈逐漸下降趨勢,這可能是導致這類戊糖基-葡萄糖苷總量下降的主要原因(圖1)。而其他3 類戊糖基-葡萄糖苷物質,在Red Fruit酵母發酵起始(0 d)和發酵結束時(42 d)均沒有明顯差異,而Zymaflore ST酵母發酵時,這3 類物質含量均隨著發酵進程而下降(表3)。
‘北冰紅’冰酒中鑒定到5 類己糖基-葡萄糖苷香氣物質,1-己醇-鼠李糖基-葡萄糖苷含量相對較高,其在Red Fruit酵母發酵過程中含量有所增加,而在Zymaflore ST酵母發酵過程中含量幾乎沒有改變;而3-己烯-1-醇-己糖基-葡萄糖苷在2 種酵母發酵過程中,均表現為下降趨勢。其他3 類隨Red Fruit酵母發酵,或增加或無明顯變化,但在Zymaf l ore ST酵母發酵起始與結束的酒樣中,含量變化很小(表3)。上述結果表明,2 種酵母發酵對不同的結合態組分的影響存在差異。
2.4 ‘威代爾’冰酒發酵過程中2 種酵母對糖苷態香氣物質釋放的影響
2.4.1 對不同糖苷類型的香氣物質含量的影響
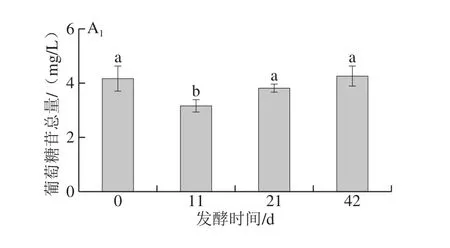
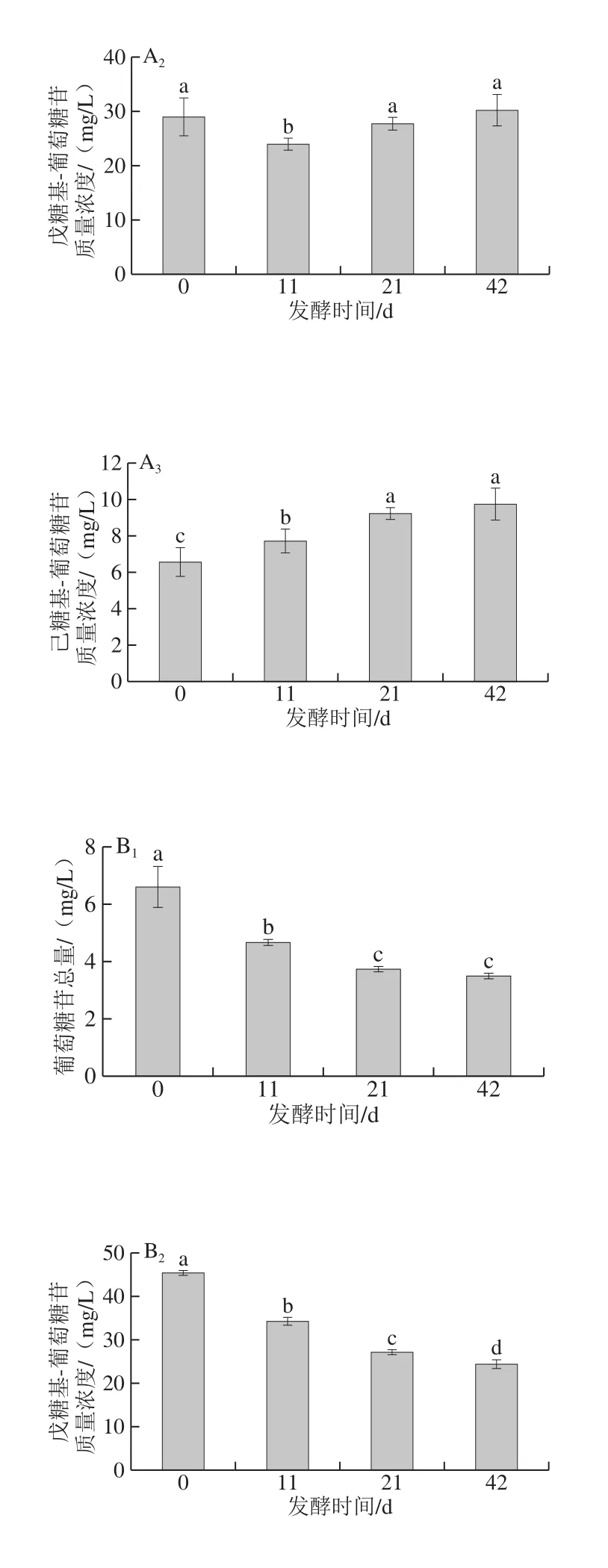
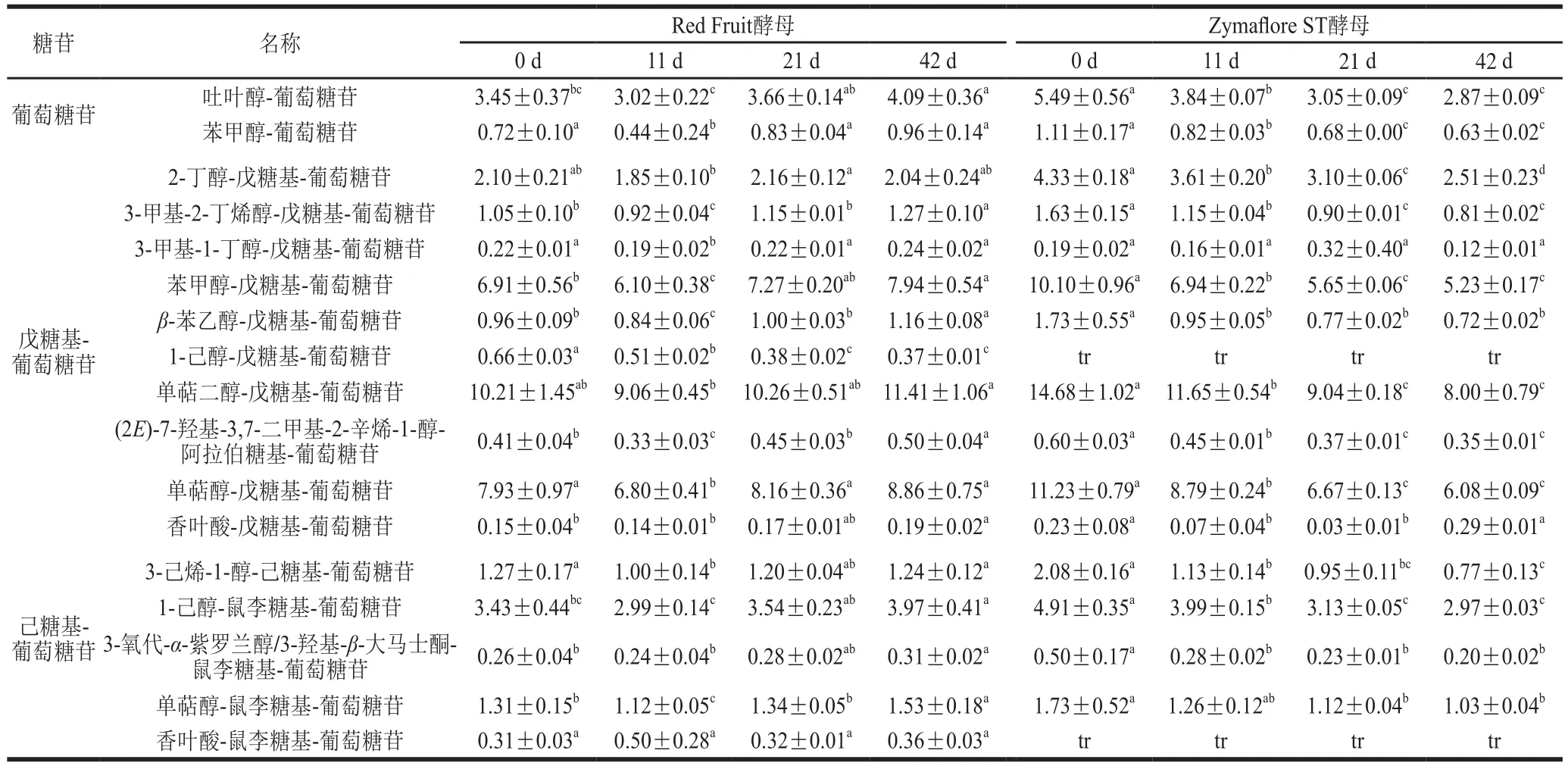
表4 ‘威代爾’冰酒發酵過程中各類糖苷態香氣物質質量濃度的變化Table 4 Variation in various aroma glycosides combounds during fermentation of ‘Vidal’ ice wine mg/L
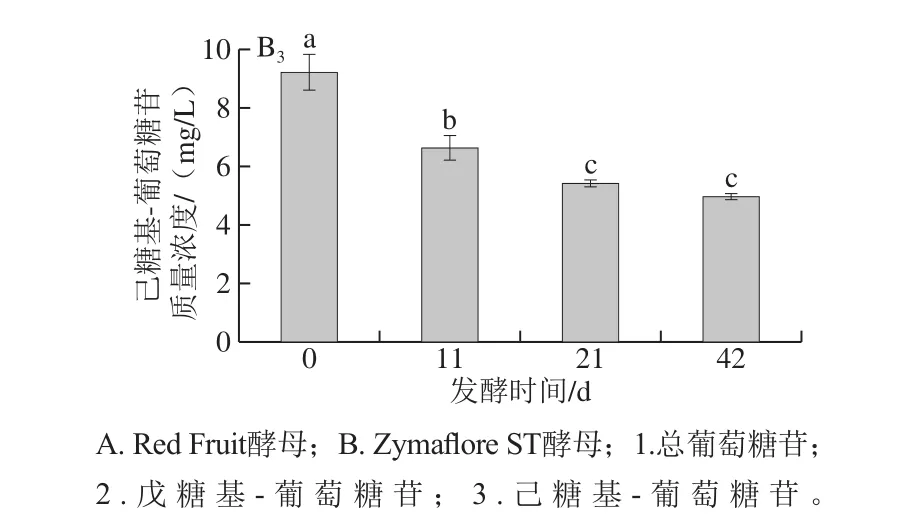
圖2 酵母Red Fruit和Zyma flore ST發酵的‘威代爾’冰酒過程中不同糖苷類型香氣物質的變化(n=4)Fig. 2 Variation in various aroma glycosides compounds during fermentation of ‘Vidal’ ice wine by Red Fruit or Zyma flore ST (n = 4)
將‘威代爾’冰酒中糖苷結合態香氣物質歸為3 大類糖苷,分別為葡萄糖苷、戊糖基-葡萄糖苷和己糖基-葡萄糖苷,如圖2所示,Zymaflore ST酵母發酵的‘威代爾’冰酒中,這3 大類結合態香氣物質的含量均呈顯著下降趨勢。相比之下,Red Fruit酵母的發酵作用下,結合態香氣物質的含量并無明顯變化(己糖基-葡萄糖苷類除外),甚至呈現增加的趨勢,在目前實驗條件下,無法解釋增加的原因,推測可能與三糖苷化合物的水解有關。以上結果說明,Zymaf l ore ST酵母發酵較利于‘威代爾’葡萄酒中糖苷態香氣前體物的釋放,在‘威代爾’基質中,Zymaflore ST酵母中水解不同類型糖苷態物質的酶活性均比較高。而Red Fruit酵母對‘威代爾’葡萄汁中結合態香氣物質的水解釋放作用較小,相應的水解酶活性較低。而Red Fruit酵母并不適合‘威代爾’冰酒的釀造。
2.4.2 對各類糖苷態香氣物質含量的影響
如表4所示,將‘威代爾’冰酒中鑒定得到的結合態香氣物質依據本研究的定性命名歸為17 類,但在Zymaflore ST酵母發酵的冰酒中,1-己醇-戊糖基-葡萄糖苷和香葉酸-鼠李糖基-葡萄糖苷不能被有效地定量,可能與該發酵罐中這2 類物質的含量較低有關。隨Zymaflore ST酵母的發酵,除含量較低的3-甲基-1-丁醇-戊糖基-葡萄糖苷沒有明顯變化之外,其他14 類結合態物質的含量均呈現下降的趨勢。相反,在Red Fruit酵母發酵‘威代爾’的過程中,與起始階段相比,發酵結束時大多數結合態香氣物質含量略有升高或幾乎不變。這些結果進一步說明,采用Zymaf l ore ST酵母發酵,能夠使‘威代爾’葡萄醪中的各種糖苷態香氣物質轉化為具有揮發性的游離態香氣。
2.5 ‘北冰紅’冰酒過濾和瓶儲1 年后糖苷態香氣物質含量的變化
如表5所示,在葡萄酒發酵結束后進行過濾處理,經過瓶儲1 年后,所有結合態香氣物質含量均下降,水解率在19.1%~54.5%之間,最高的是單萜醇-鼠李糖苷-葡萄糖苷,結果表明瓶儲過程中糖苷態香氣前體物發生了較明顯的水解,該水解反應主要是酸催化的[28],且這一過程對底物沒有選擇性。這也說明冰酒經過1 年的瓶儲會有更多的結合態香氣前體物釋放出來。
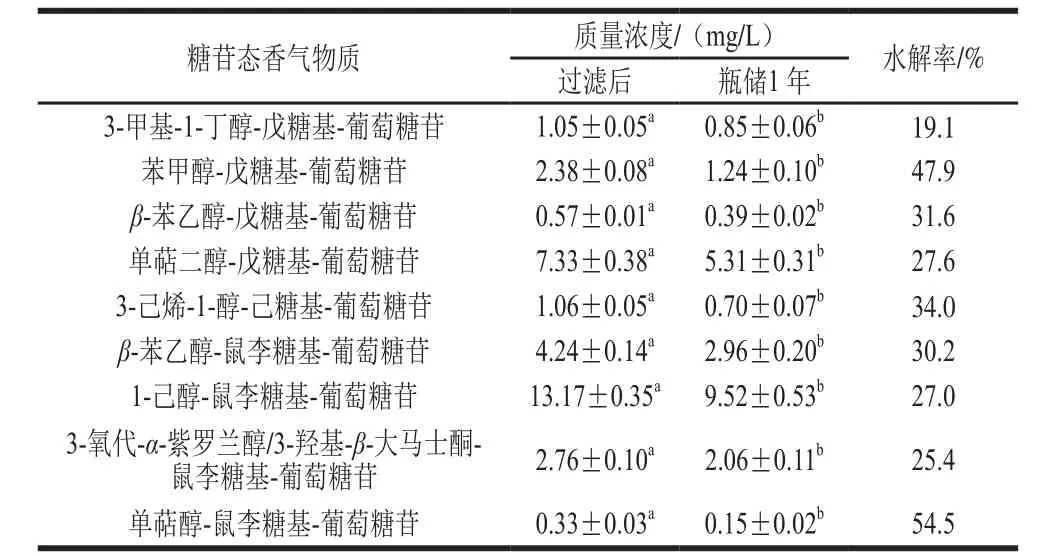
表5 ‘北冰紅’冰酒(Red Fruit酵母)瓶儲1 年糖苷態香氣物質的變化(n=8)Table 5 Variation in glycosidically bound aroma compounds of‘Beibinghong’ ice wine after aging for one year (n= 8)
注:同行不同字母表示差異顯著(P<0.05)。
3 討論與結論
糖苷結合態香氣前體物沒有揮發性,需要經過水解釋放揮發性苷元,水解可通過酶催化或酸催化進行[8],通過糖苷酶釋放苷元的過程可以是一步反應,也可以是一系列連續反應,簡單的葡萄糖苷可以通過β-葡萄糖苷酶裂解(一步反應),然而結合了一個非葡萄糖的雙糖,則需要特定的外切酶水解糖苷鍵,如α-鼠李糖苷酶等,接著β-葡萄糖苷鍵再水解釋放出揮發性苷元[8]。酵母在發酵過程中具有糖苷酶活性[20],不同菌株在發酵條件下的酶相對活性和特異性底物會有所不同[29],本研究也發現,無論是對‘北冰紅’還是‘威代爾’,用Red Fruit酵母發酵對糖苷態香氣物質的影響都明顯不同于用Zymaflore ST酵母。Chassagne等[30]發現在‘霞多麗’葡萄酒的發酵過程中,不同酵母菌株對糖苷鍵的水解效果在17%~57%之間變化。
除酵母自身水解酶種類和活性存在差異之外,發酵基質對酶的活性也會產生影響,本研究發現Zymaf l ore ST酵母發酵‘威代爾’冰酒時,糖苷態香氣物質有較明顯的水解作用,但發酵‘北冰紅’冰酒時則沒有這種效果。Zinnai等[31]發現一些葡萄酒成分,特別是乙醇對β-葡萄糖苷酶活性具有抑制作用。同時,較低的pH值、高葡萄糖濃度也會使酵母中糖苷酶的穩定性喪失,導致酶活性的降低[32]。因此在釀酒過程中,對于不同葡萄品種,釀酒師可以通過選用不同的酵母菌株,更好地發掘葡萄酒的香氣潛力,充分體現出葡萄酒的風格。
在葡萄酒陳釀期間,糖苷則經歷緩慢的酸水解,已有很多研究證據表明,酸水解對糖基基團沒有選擇性,在低pH值和高溫下會發生得更快[3],這解釋了本研究結果,瓶儲1 年的葡萄酒中,幾乎所有的糖苷態香氣物質含量都下降。
本研究采用UPLC-Q-TOF-MS探究2 個葡萄品種分別在2 種酵母發酵下糖苷態香氣物質的變化,研究認為,酵母Red Fruit和Zymaflore ST對發酵過程中‘北冰紅’糖苷態香氣釋放影響較為有限,糖苷態香氣釋放可能主要在陳釀階段,相對而言,酵母Zymaf l ore ST發酵較有利于‘威代爾’糖苷態香氣的釋放。該結果為冰酒的釀造和陳釀工藝設計提供了參考。

