A 群輪狀病毒一步法RT-ddPCR 方法的建立
徐蕾蕊,馬 丹,魏詠新,李 丹,魏海燕,劉 莉,張西萌,汪 琦,付溥博,趙曉娟,曾 靜*
(北京海關技術中心,北京 100026)
20世紀70年代之后,各國學者相繼發現諾如病毒(norovirus,NoV)、輪狀病毒(rotavirus,RV)、人星狀病毒(human astrovirus,HAstV)、腺病毒、札如病毒等是引起兒童、老年人以及免疫力低下人群急性水樣腹瀉和重癥腹瀉的主要病原體[1-4]。其中,RV是世界范圍內引起兒童急性腹瀉和兒童重癥腹瀉的最常見病毒,全球每年約有1.14億兒童發生RV腹瀉,最近監測顯示全國范圍內因腹瀉入院的5 歲以下兒童中RV檢測陽性率高達47.8%[5-6]。
R V是一種R N A病毒,屬于呼腸孤病毒科(Reoviridae)輪狀病毒屬(Rotavrus)。RV基因組由11 條雙鏈RNA組成,共編碼11 種蛋白質,包括6 種結構蛋白(VP1~4、VP6和VP7)和5 種非結構蛋白(NSP1~5)[7-8]。根據抗原蛋白VP6不同,RV可分為A~H八個群,只有A、B、C和H群RV能感染人類,A群RV是嬰幼兒腹瀉的主要病原體[9-10]。非結構蛋白NSP3編碼基因序列具有高度保守性[11-12],參與RV侵染宿主細胞過程,具有轉錄調節作用[13-14]。本研究根據NSP3基因序列特征,建立檢測A群RV一步法逆轉錄微滴式數字聚合酶鏈式反應(reverse transcriptase droplet digital polymerase chain reaction,RT-ddPCR)方法,該方法不需要建立標準曲線可實現A群RV的精準定量,旨在為開展A群RV的流行病學調查及感染水平的定量分析提供新的技術手段和數據基礎。
1 材料與方法
1.1 材料與試劑
蟶子、胡蘿卜、生食蔬菜(生菜)、冷凍桑葚 市購。
A群RV陽性糞便樣本(2003—2004年收集自北京兒童醫院)均為本室分離、鑒定和保存;NoV(基因型GI、GII)、HAstV、甲肝病毒RNA由本實驗室保存。
焦碳酸二乙酯(diethyl paracabonate,DEPC)處理水北京天根生化科技有限公司;Trizol、質粒載體pcDNAII、SuperScript?III Platinum?One-Step Quantitative RT-PCR System 美國Invitrogen公司;QIAamp Viral RNA Mini Kit 德國Qiagen公司;Dynabeads?mRNA Purification Kit 美國Life Technology公司;One-step RT-ddPCR advanced kit for probes 美國Bio-Rad公司。
1.2 儀器與設備
7900HT Fast RT-PCR儀、Veriti 96-Well Thermal Cycler 美國ABI公司; QX200 Droplet Digital PCR System 美國Bio-Rad公司;CP413電子天平 奧豪斯儀器(上海)有限公司。
1.3 方法
1.3.1 A群RV RNA標準物質制備
應用QIAamp Viral RNA Mini Kit從A群RV陽性的生物糞便樣品中提取RNA,采用針對A群RV NSP3基因的特異性引物ATG CTC AAG ATG GAG TCT ACTC/GGT CAC ATA ACG CCCC TAT AG擴增NSP3基因全長,長度1 049 bp。將該特定基因片段與pcDNAII連接構建重組質粒pcDNAII-RV,轉化到Top10感受態細胞內,構建含有重組質粒的大腸桿菌,通過大腸桿菌的增殖,大量制備提取pcDNAII-RV;采用BamHI限制性內切酶將pcDNAIIRV單酶切;以酶切后的線性化pcDNAII-RV為模板,通過T7啟動子體外轉錄合成獲得A群RV NSP3基因RNA片段,經測序驗證符合實驗預期后,根據ISO指南35∶2006[15]要求,制備A群RV RNA標準物質,確定該標準物質的特性值為(5.8±1.5)×107拷貝/μL,置于-80 ℃保存備用。
1.3.2 引物探針設計和篩選
根據A群RV VP6和NSP3基因序列,通過NCBI在線工具進行序列分析和比對,利用Prime Express軟件V4.0(ABI, Foster City, CA, USA)設計出4 組引物和探針組合,用提取的A群RV RNA和SuperScript?III Platinum?One-Step Quantitative RT-PCR System對設計的引物探針進行篩選。反應參數:50 ℃反轉錄15 min,95 ℃熱啟動2 min;95 ℃變性15 s,60 ℃退火及延伸1 min,40 個循環。
1.3.3 一步法RT-ddPCR驗證篩選的引物探針的特異性
應用提取的A群RV RNA和NoV(基因型GI、GII)、HAstV、甲肝病毒等其他常見食源性病毒RNA進行一步法RT-ddPCR方法擴增,驗證篩選的引物探針的特異性。參考One-step RT-ddPCR advanced kit for probes試劑盒說明書配制反應體系和生成微滴。將微滴置于Veriti 96-Well Thermal Cycler中按以下條件進行反應:60 ℃反轉錄30 min,95 ℃熱啟動5 min;94 ℃變性30 s,60 ℃退火延伸1 min,40 個循環;98 ℃酶滅活10 min;4 ℃ Hold。升降溫速不低于2.5 ℃/s。反應結束后,用QX200微滴讀取儀檢測得到20 μL反應體系中RNA的拷貝濃度。按照下式計算模板RNA拷貝濃度:

1.3.4 一步法RT-ddPCR擴增溫度優化
按One-step RT-ddPCR advanced kit for probes試劑盒說明書配制反應體系和進行一步法RT-ddPCR檢測,以出現最高的陽性微滴簇為標準,對退火溫度(52.5~62.5 ℃)進行優化。
1.3.5 A群RV一步法RT-ddPCR方法學考察
1.3.5.1 定量限和準確度分析
將制備的A群RV RNA標準物質分別按稀釋倍數102、103、104、105、106、2×106、4×106和107稀釋,每個稀釋倍數各取2 μL作為模板,按One-step RT-ddPCR advanced kit for probes試劑盒說明書配制反應體系和進行一步法RT-ddPCR檢測。每個梯度進行4 個重復檢測,計算各檢測梯度的相對偏差,確定各ddPCR檢測方法的定量限,分析各ddPCR檢測體系的檢測值與理論值之間的關系,驗證其檢測準確度。
1.3.5.2 重復性和復現性分析
將制備的A群RV RNA標準物質10 倍梯度稀釋,取高、低兩個梯度各2 μL,按One-step RT-ddPCR advanced kit for probes試劑盒說明書配制反應體系和進行一步法RT-ddPCR檢測。取3 個標準物質平行樣品管進行稀釋,每個樣品每個梯度重復檢測3 次,同時設置1 個空白對照(以DEPC水代替模板RNA)。每隔1 周復檢1 次,連續監測3 次。計算組內變異系數和組間變異系數,分析檢測方法的重復性和復現性。
1.3.6 不同食品基質中的A群RV一步法RT-ddPCR檢測
采用本實驗室保存的A群RV陽性糞便制備染毒樣品。將該陽性糞便樣品充分混勻后,表層、中層、底層3 個不同取樣點吸取100 μL樣品溶液,經Trizol充分提取RNA后,用建立的A群RV一步法RT-ddPCR方法檢測,每個采樣點重復檢測5 次,采用單因素方差分析方法比較不同采樣點的檢測值,確定該陽性糞便樣品中A群RV濃度,梯度稀釋制備成從高到低4 個濃度A群RV染毒液。
1.3.6.1 食品樣品類型及染毒
選取有代表性的4 種食品基質:貝類(蟶子)、硬表面食品(胡蘿卜)、生食蔬菜(生菜)和軟質水果(冷凍桑葚)。染毒前先檢查牡蠣樣品的外殼是否完整,提取消化腺后勻漿,分裝為2 g/份;胡蘿卜分裝為若干份,生菜和冷凍桑葚分裝為25 g/份。分別取各濃度染毒液100 μL加入分裝好的蟶子消化腺,點涂到胡蘿卜表面(點涂面積≤100 cm2),添加到分裝好的生菜和冷凍桑葚表面,室溫吸附30 min,每種食品類型的每個染毒梯度均添加3 個樣品,每個樣品重復檢測3 次。
1.3.6.2 染毒樣品前處理及核酸提取
參照歐盟CEN ISO/TS 15216:2013[16]對染毒的食品樣品進行病毒洗脫和濃縮,然后采用Trizol提取病毒RNA溶于100 μL DEPC水,再進行一步法RT-ddPCR檢測。
1.3.6.3 回收率計算
不同濃度染毒樣品經前處理、核酸提取、一步法RT-ddPCR檢測得到的檢出值與染毒液中A群RV理論含量的比值即為回收率,當回收率高于1%時,認為人工染毒樣品中模擬病毒的回收和提取有效。
1.4 統計分析
采用SPSS 17.0統計軟件分析,組間均數比較采用t檢驗和F檢驗,檢驗水準α=0.05。
2 結果與分析
2.1 特異性引物探針
根據A群RV的VP6和NSP3基因序列,設計出4 組引物和探針組合。篩選結果表明:僅VP6-F2/R2/P2(序列未給出)未擴增出靶基因(圖1)。特異性驗證結果說明,擴增強度最大的NSP3-F1/R1/P1(序列見表1)特異性較好(圖2),故選取該組引物探針建立A群RV一步法RT-ddPCR方法。
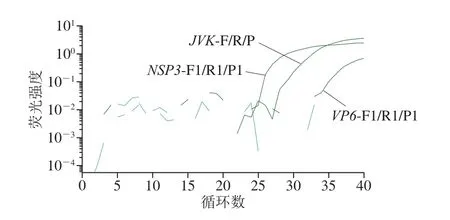
圖1 熒光PCR方法篩選A群RV引物探針Fig. 1 Screening of primers and probes by fluorescence PCR method for RV group A strains
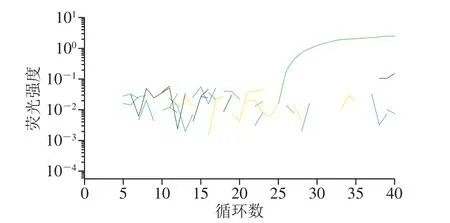
圖2 熒光PCR方法驗證NSP3-F1/R1/P1特異性Fig. 2 Speci ficity veri fication of NSP3-F1/R1/P1 by fluorescence PCR method
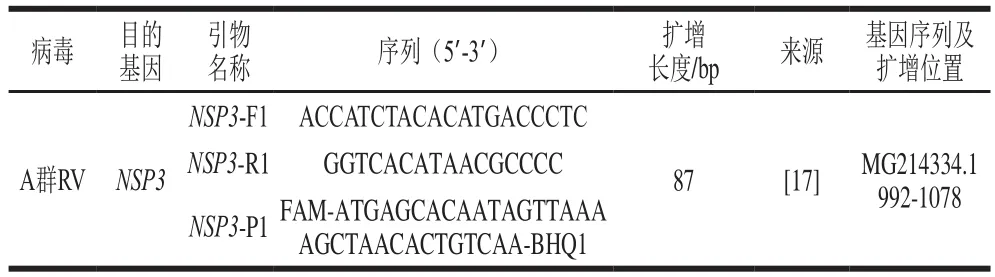
表1 一步法RT-ddPCR引物和探針序列Table 1 Primer and probe sequences used for RT-ddPCR
2.2 A群RV一步法RT-ddPCR檢測方法的建立及退火溫度優化
2.2.1 一步法RT-ddPCR檢測方法
應用篩選的引物探針NSP3-F1/R1/P1,建立A群RV一步法RT-ddPCR檢測方法。該法僅能檢出A群RV RNA,出現陽性擴增的微滴,其余病毒RNA均呈陰性微滴,證明該檢測方法具有良好的特異性(圖3)。
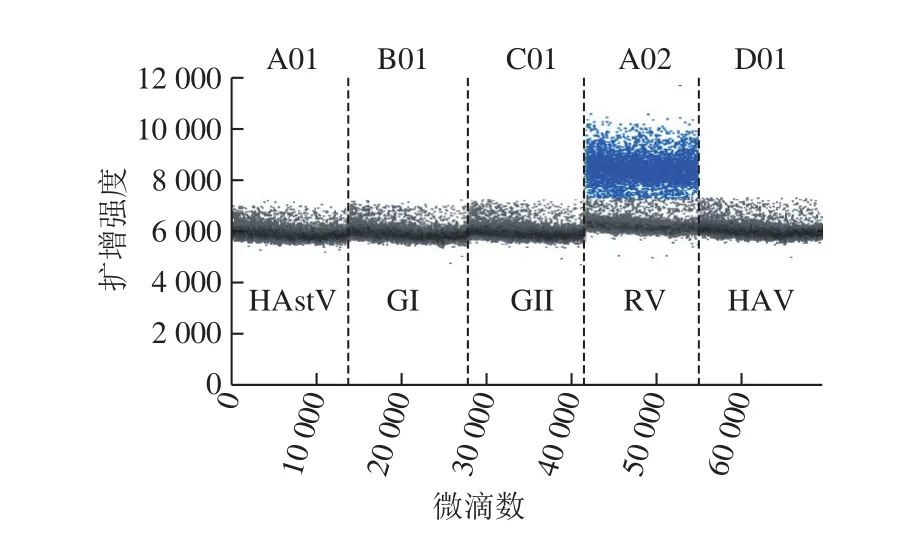
圖3 A群RV一步法RT-ddPCR體系特異性Fig. 3 Specificity of RT-ddPCR for assay of RV group A strains
2.2.2 退火溫度的優化
退火溫度55 ℃和60 ℃均可出現比較明顯的陽性微滴簇,且在55 ℃擴增的熒光信號略高于60 ℃,因此,將55 ℃作為最佳退火溫度(圖4)。
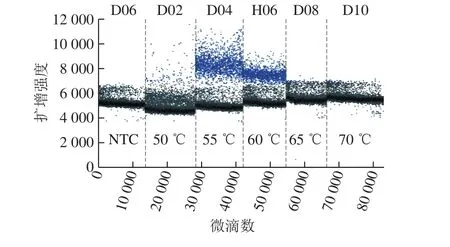
圖4 A群RV一步法RT-ddPCR體系退火溫度優化Fig. 4 Optimization of annealing temperature for RT-ddPCR assay of RV group A strains
2.3 A群RV一步法RT-ddPCR檢測方法的定量限和準確度
將制備的A群RV RNA標準物質分別按稀釋倍數102、103、104、105、106、2×106、4×106和107稀釋,每個稀釋倍數的理論濃度分別為580 000.00、58 000.00、5 800.00、580.00、58.00、29.00、14.50、5.80 拷貝/μL。結果表明,理論濃度為580 000.00 拷貝/μL的溶液超過了一步法RT-ddPCR的檢測范圍,其他稀釋梯度的檢測相對標準偏差(relative standard deviation,RSD)為3.6%~16.0%,且理論濃度與檢測濃度之間呈線性關系,方程:Y=1.029X-11.444,R2=0.998 7,P<0.000 1,說明A群RV一步法RT-ddPCR檢測方法可準確定量檢測A群RV RNA濃度(表2,圖5)。當A群RV RNA標準物質稀釋至5 拷貝/μL左右時,理論值與檢測體系檢測的實際值仍然接近,4 次重復的RSD均小于25%,表明該檢測體系定量限可達5 拷貝/μL。
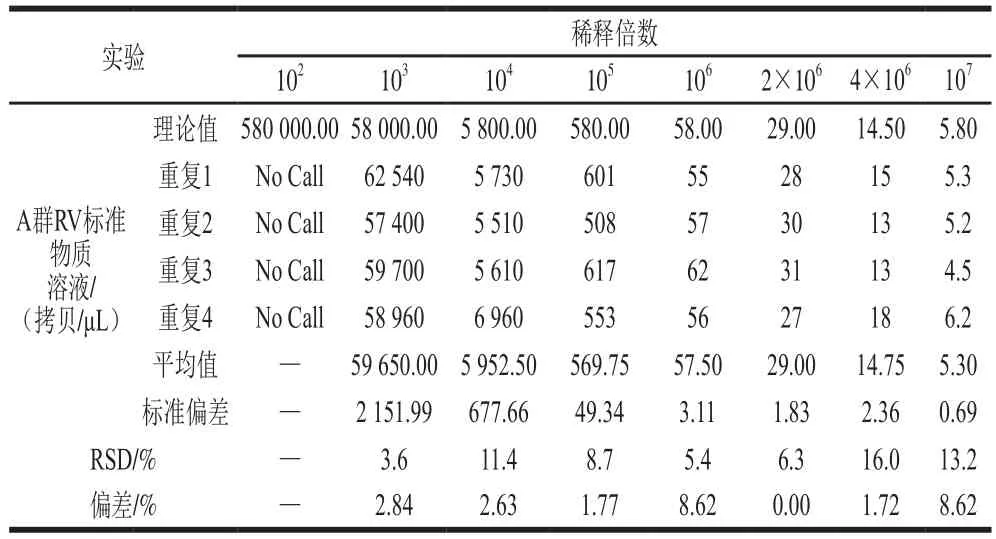
表2 A群RV一步法RT-ddPCR檢測方法的定量限和準確度Table 2 Limit of quanti fication and accuracy of RT-ddPCR
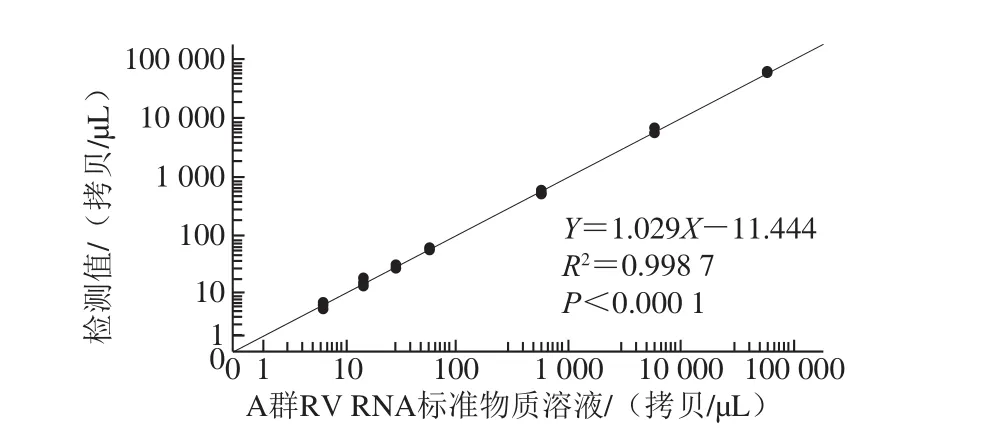
圖5 A群RV一步法RT-ddPCR檢測方法的線性關系Fig. 5 Linearity of RT-ddPCR
2.4 A群RV一步法RT-ddPCR檢測方法的重復性和復現性
對于濃度5.8×103拷貝/μL,組內RSD為5.79%、6.27%和5.70%,與理論值的偏差分別為0.17%、0.43%和2.68%;濃度5.8 拷貝/μL,組內RSD分別為10.40%、12.09%和6.01%,與理論值的偏差分別為0.52%、5.86%和3.28%(表3)。單因素方差分析發現,2 個濃度的3 次重復檢測值之間差異不顯著(P>0.05),說明A群RV一步法RT-ddPCR檢測方法具有良好的重復性和復現性。
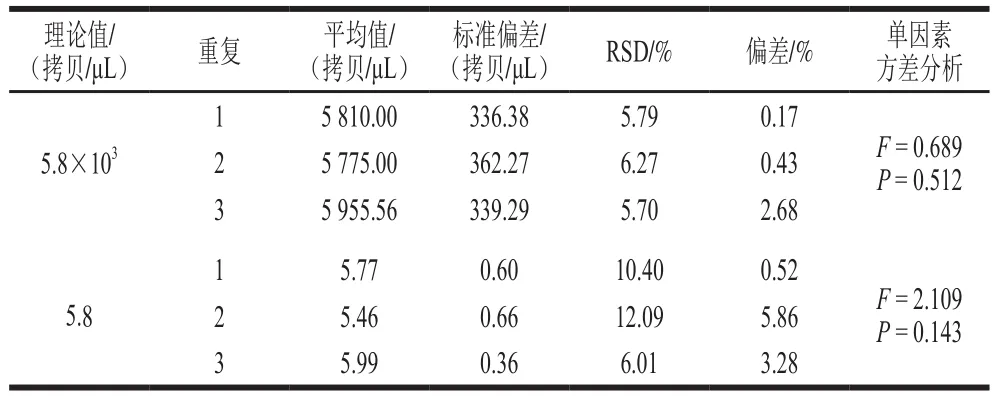
表3 A群RV一步法RT-ddPCR檢測方法的重復性(n=9)Table 3 Repeatability of RT-ddPCR (n= 9)
2.5 A群RV陽性糞便樣品一步法RT-ddPCR定量結果
不同取樣部位的一步法RT-ddPCR檢測平均值相近,單因素方差分析表明,差異沒有統計學意義(P=0.122),Tukey多重比較分析發現,不同取樣點定量結果之間沒有顯著差異(P>0.05),同一取樣點的5 次重復取樣檢測RSD均小于15%(表4)。將不同采樣點檢測值的平均值作為A群RV陽性糞便樣品的濃度,為1.579×1 06拷貝/μ L,染毒液濃度分別為1.5 7 9×1 04、1.579×103、1.579×102拷貝/μL和1.579×101拷貝/μL。
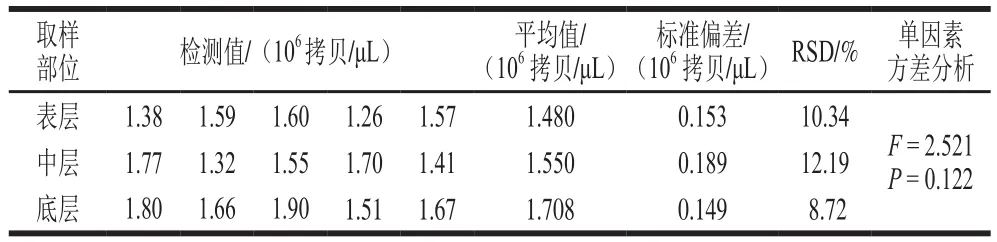
表4 A群RV陽性糞便樣品一步法RT-ddPCR定量檢測結果Table 4 Quantitative results of RV group A strains in positive fecal samples by RT-ddPCR
2.6 不同食品基質中A群RV一步法RT-ddPCR檢測結果
分別以蟶子、胡蘿卜、生菜和冷凍桑葚為代表的4 種食品基質(貝類消化腺、硬表面食品、生食蔬菜和軟質水果)的回收率分別為27.82%~53.82%、23.08%~38.27%、2.37%~7.63%和1.15%~2.73%。單因素方差分析結果表明,各染毒量中不同食品基質的A群RV檢出量和回收率差異顯著(P<0.001),蟶子和胡蘿卜的檢出量和回收率明顯高于生菜和冷凍桑葚。冷凍桑葚中各染毒量的回收率均小于3%,而當實際染毒量為1 579 拷貝時,從生菜和冷凍桑葚染毒樣品檢出量的RSD大于25%,有的染毒樣品不能檢出A群RV RNA,說明提取的RNA溶液濃度低于一步法RT-ddPCR的檢測限(表5)。進一步進行Tukey多重比較發現,各染毒劑量下,不同食品基質之間差異均有統計學意義上的顯著性(P<0.05)。
3 討 論
dPCR可將PCR擴增產生的熒光信號由經典指數形式轉換為單分子信號,將檢測靈敏度提高到單分子水平[18-19]。目前,ddPCR是常見的dPCR系統之一,采用油包水的方式分割PCR體系為微滴,PCR后,微滴逐一通過檢測器,有熒光信號的微滴記為“1”(存在PCR擴增產物),無熒光信號的微滴記為“0”(不存在PCR擴增產物),從而產生“數字”的概念[20-21]。按照泊松分布原理,根據陽性微滴的數量,計算反應體系內的模板拷貝數濃度,實現核酸的精準定量[21-24]。因此,ddPCR不依賴標準曲線和擴增循環閾值,可直接定量檢測核酸,屬于終點檢測,某些程度上,擴增不會造成定量的偏倚,對PCR抑制劑更為耐受,在改善定量分析準確性和變異性上有較大優勢[25-26]。本研究發現,A群RV一步法RT-ddPCR定量檢測值與標準物質溶液理論濃度相符,相關系數為0.998 7,定量范圍包括104~100拷貝/μL 5 個數量級,定量限可達5 拷貝/μL,檢測方法具有良好的重復性和復現性。
不同的食品基質A群RV的污染方式不同[27]:貝類通過濾食將水體中的A群RV濃縮到消化腺內,水果(包括硬表面水果和軟質水果)和生食蔬菜等通過澆灌含有A群RV的肥料和灌溉水被污染;此外,食品中蛋白質、多糖等某些大分子物質,能直接影響病毒洗脫、RNA提取及分子檢測過程,影響定量檢測結果,因此不同的食品基質需要采用針對性的前處理方法以洗脫和濃縮病毒顆粒。本研究參照歐盟的CEN ISO/TS 15216:2013[16]對染毒的食品樣品進行洗脫和濃縮。通過計算檢出量和回收率發現,不同食品基質中存在顯著差異(P<0.001),且蟶子和胡蘿卜明顯高于生菜和冷凍桑葚,而低染毒量時,部分生菜和冷凍桑葚染毒樣品未檢出A群RV RNA,說明食品基質對A群RV一步法RT-ddPCR定量檢測量有較大影響。
貝類中病毒洗脫和濃縮主要通過將貝類消化腺撕裂后,采用蛋白酶K和65 ℃高溫處理相結合的方法破壞消化腺組織,釋放病毒顆粒[28],再超速離心濃縮病毒顆粒,直接提取RNA。該方法已成功在0.15 g牡蠣消化組織中檢測出諾如病毒[29-30],相對于采用異硫氰酸酯/苯酚為主的試劑直接提取食品中的食源性病毒RNA方法回收率更高[31-32]。洗脫液的pH值對軟質水果與生食蔬菜中食源性病毒顆粒的洗脫效果影響比較大,通常采用堿性緩沖液(pH≥9)洗脫此類食品表面的食源性病毒[33]。同時采用牛肉膏和甘氨酸減少病毒顆粒對食品基質的非特異性吸附,可分別使此類樣品中的食源性病毒回收率提高數倍[34]。草莓、桑葚等軟質水果含有的果膠會影響洗脫效果,需要采用果膠酶破壞這些果膠分子,保證這類軟質水果的洗脫效率。硬表面食品的范圍可包括堅果、蘋果、胡蘿卜等多種食品類型,它們的共同點是表面比較堅硬,可通過棉拭子擦拭法將食品表面吸附的病毒顆粒擦拭下來,操作簡便,具有相當的回收率。
定量食品中的A群RV需要將病毒與食品基質分離、濃縮,得到病毒懸液,提取RNA后,用A群RV一步法RT-ddPCR進行檢測。在不考慮病毒分離、濃縮效率和RNA核酸提取效率時,本研究建立的A群RV一步法RT-ddPCR定量檢測方法的檢測限可達到5 拷貝/μL。但病毒濃縮、RNA提取的過程中存在回收率和RNA提取效率未知等不確定因素,很難檢測到食品中可能存在的全部病毒核酸,因此利用一步法RT-ddPCR方法檢測的病毒核酸含量不等于實際樣品中食源性病毒的實際載量。后續研究中,需要建立一種簡便可操作性強的過程控制程序監控病毒濃縮、核酸提取過程,反映實際樣品中A群RV回收率,并且通過回收率計算樣品中A群RV的實際載量。

