氧化鋁赤泥制備催化劑研究
劉德杰?楊方圓?張川普?楊立敏

摘要:本文采用檸檬酸溶膠-凝膠法,以氧化鋁赤泥為原料,制備出鈣鈦礦結構赤泥/BaTiO3催化劑,并利用X射線衍射(XRD)、掃描電鏡(SEM)和傅里葉變換紅外光譜定量分析方法研究了赤泥/BaTiO3催化劑的結構及其對性能的影響。討論了反應溫度、氧氣濃度、空速對氮氧化物轉化率的影響。結果表明:溶膠-凝膠法結合燒結制備出的催化劑結構晶相好,并且在500 ℃燒結的赤泥/BaTiO3復合催化劑,在300 ℃時氮氧化物催化氧化性能最佳(0.054%NO,GHSV=8000h-1,15%O2,N2balance)為50%。這種方法制備的赤泥/BaTiO3復合催化劑成本較傳統貴金屬催化劑的低,并且催化性能大幅提升,極大地節約了生產成本,促進了生產效率,具有廣泛應用于生產的潛力。
關鍵詞:催化氧化;氮氧化物;赤泥/BaTiO3
中圖分類號:X324 文獻標識碼:A
氮氧化物是光化學煙霧的重要組分,對水體、土壤和大氣均造成污染。控制氮氧化物含量一直以來都是污染防控的重要任務。近年來,隨著公民對環境的日益關注,有效地減少氮氧化物是環境研究者關注的重點,而氮氧化物研究的關鍵為高效催化劑的研究,因此,防控氮氧化物的課題也是催化領域學者關注的重點。常見的非均相催化劑有貴金屬、金屬氧化物及非金屬碳材料等。雖然催化劑的種類繁多,但是其高昂的制備成本一直是催化領域面臨的難題。目前,隨著工業上變廢為寶的呼聲越來越高,通過工業固體廢棄物制備催化劑,原料廉價易得既降低了催化劑成本難題,又解決了工業固體廢棄物的處理難題。
目前,氧化鋁的生產大多采用拜耳法,在拜耳法生產氧化鋁過程中堿處理鋁土礦石時會排出污染性的固體廢渣,即赤泥。氧化鋁赤泥的主要成分為金屬氧化物(氧化鐵、氧化鋁、二氧化鈦、氧化硅、氧化鈣氧化鉀等),是一種對環境有害的強堿性廢棄污染物。其中鐵氧化物具有很好的催化脫硝活性,赤泥平均粒徑小(小于10μm)、分布較均勻,并具有較高的熱穩定性、抗燒結及抗毒化性能,因此,氧化鋁赤泥被廣泛用于制備催化劑和催化劑載體。目前,赤泥作為催化劑應用于污染物催化降解、催化裂解、催化氫化、廢氣凈化、脫氫脫硫等催化體系中[1-4]。例如,Wang S et al[5]利用赤泥作催化劑對水中有機污染物進行催化降解。Oliveira et al[6]通過CVD法,以乙醇為原料,制備了具有兩親性的赤泥催化性,成功解決了長期以來赤泥不能直接催化降解燃油中的有毒污染物的問題。Nguyen-Huy[7]首次將赤泥應用于催化裂解。Alvare et al[8]對赤泥進行硫化處理,進一步提高了赤泥的抗失活能力,降低了催化劑的比表面積和表面鐵的流失,促進催化氧化反應活性。雖然氧化鋁赤泥催化性能已經得到改善,但是,相比于商業催化劑,赤泥催化活性普遍偏低,且赤泥的改性局限于算溶解再沉淀法,因此,需要尋找新的赤泥催化劑制備方法,并優化催化劑的性能。已經有學者[9-10]對BaTiO3、BaSnO3、BaZrO3等進行研究,發現這類鈣鈦礦結構具有很好的抗SO2中毒性能和儲氮性能,并且具有抗高溫穩定的特性,是一類良好的催化劑。本文在總結學習前人研究的基礎上,提出了簡便可行的制備方法,并以空速、氧濃度、溫度為變量研究了對氮氧化物的催化轉化性能的影響因素,可對實際生產應用有一定指導作用。
1 實驗部分
1.1 催化劑制備
采用溶膠-凝膠法結合浸漬法制備氧化鋁赤泥/BaTiO3催化劑。以硝酸鋇、硫酸鈦、檸檬酸為原材料,按m[Ba(NO3)2]:m(TisO4):m(CH2COOH COHCOOH CH2COOH)=1:1:1的比例稱取對應物質的質量。用檸檬酸溶解硝酸鋇,去離子水溶解硫酸鈦,然后將兩種溶液混合,再加入適量的表面活性劑,再氨水調節 pH值至8.5,最后將破碎后的赤泥置于BaTiO3溶液中浸漬,浸漬后置于攪拌器上充分攪拌3 h。加入乙醇作溶劑置換,得到溶膠。室溫下放置數天進行自然干燥,用馬弗爐燒結,先在110 ℃下恒溫燒結2 h,然后在200 ℃、300 ℃、350 ℃和400 ℃各恒溫燒結0.5 h,再于500 ℃焙燒4 h自然冷卻至室溫,研磨過篩取粒徑20~40目備用。
1.2 催化劑活性評價
本實驗參考前人采用的常壓固定床反應器裝置[11],該反應器由石英玻璃制成。反應器溫度由加熱爐溫度控制器控制。反應器進口氣體中氧化氮的體積分數為0.054%,O2的體積分類為4%,其余為N2出口氣體由傅里葉紅外光譜儀FT-IR(美國Nicoler公司,Protege460型)在線監測,用配套軟件進行定量處理。氧化氮轉化率計算式為:
2CO+2NO=催化劑=N2+2CO2
2 結果與討論
2.1 樣品表征
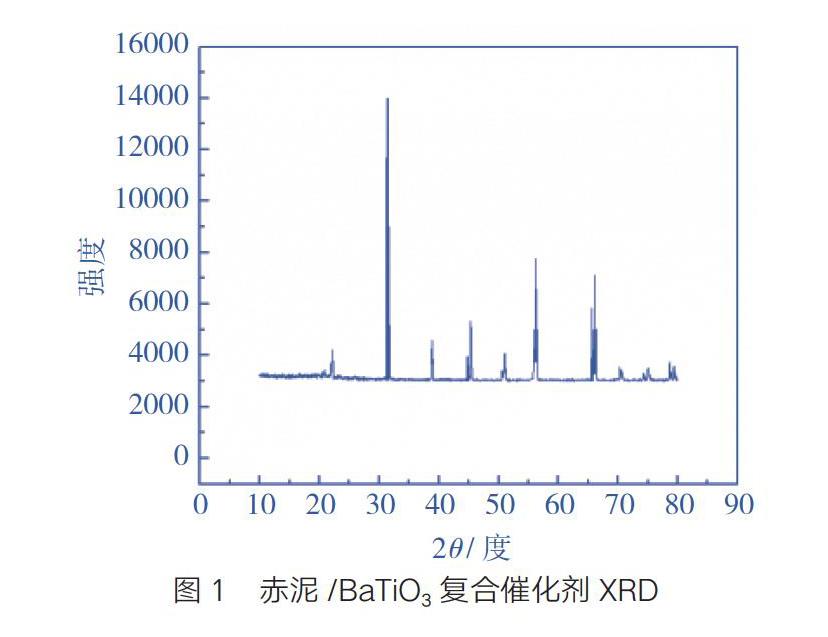
XRD檢測:用Philips X,Pert PRO SUPER型轉靶X射線衍射儀對樣品進行晶相分析,掃描角2θ=10°~70°。赤泥/BaTiO3復合催化劑經高溫燒結后的衍射圖如圖1。
如圖1所示,樣品在2θ=21.14°、30.19°、37.25°、43.24°、49.23°、53.61°、62.72°、71.17°、86.97°處出現明顯的衍射峰。通過與BaTiO3標準XRD圖譜進行比照,可知制備出的樣品主要成分為BaTiO3,說明本實驗采用的制備條件是合適的。另外在圖1中,還存在其他的衍射峰,這是因為本實驗采用的制備方法除了生成BaTiO3主產物外,還有一些副產物的生成及一些未反應的物質存在,如二氧化鈦、硝酸鋇等,由于反應不可能百分之百進行反應生成主產物,所以這種現象是正常的。
2.2 SEM分析
對制備出的赤泥/BaTiO3復合催化劑進行掃描電鏡分析,如圖2所示,可以看出燒結后的催化劑顆粒表面粗糙,形貌各異,尺寸分布不均勻,但并未出現催化劑顆粒團聚。催化劑燒結呈現珊瑚似層狀,層與層之間存在明顯孔隙。這種結構使其比表面積增大,在與反應氣的接觸過程中,有利于反應器的充分接觸。赤泥/BaTiO3復合催化劑的這種結構是NO高轉化率的原因之一。
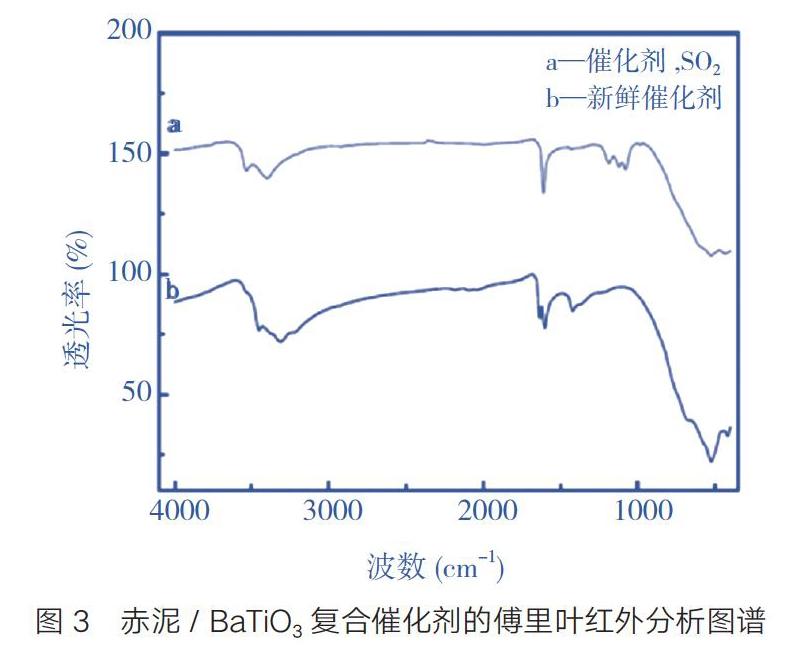
2.3 傅里葉變換紅外光譜
3圖中a譜線是經過與水蒸氣和400 mg/g的SO2和反應后的催化劑,b譜線是新制備催化劑的紅外分析圖譜。從圖3的a紅外譜圖可知,1609 cm-1和1420 cm-1為特征峰,結合紅外特征峰出現的位置,應分別為水和硝酸根的吸收峰[12]。從圖中兩條譜線可以看出特征吸收峰的位置和形貌基本相同,說明催化劑與SO2和水蒸氣反應后雖然在表面形成部分堆積覆蓋,但對催化活性基本無影響。a譜線中在1250~1000 cm-1有特征吸收峰,但強度弱。結合此反應的產物可知,其中1186 cm-1附近應為N2O5的特征吸收峰,表明氮氧化物煙氣經催化劑處理后的產物,可能以硝酸鹽或亞硝酸鹽的形態存在。另外,a曲線1120 cm-1附近的特征吸收峰是由SO42-震動引起的。曲線b吸收峰1384 cm-1附近應為硝酸鹽,催化劑的制備所用的試劑有硝酸鹽類,初步認為是反應中沒有完全分解的原因[13]。這與XRD的分析結果一致。
2.4 溫度對氧化氮轉化率的影響
本實驗對赤泥/BaTiO3復合催化劑在150~350 ℃范圍內,分別對NO轉化率進行測試。從圖4中可以看出300 ℃以下,隨著溫度的升高,NO的轉化率提高。但是300 ℃以上轉化率卻隨溫度的升高而降低。這是因為煙氣與氧氣的反應為吸附反應,二者均吸附于催化劑的表面進行反應。催化劑的表面積有限,因此催化反應存在反應平衡問題。催化反應未達到平衡之前,催化率隨著溫度的升高而提高,反應一旦達到平衡,溫度對轉化率無影響甚至為負影響。氧化反應的產物NO2在催化劑表面的吸附能力更強,繼而生成硝酸鹽占據于催化劑的表面,對NO的進一步吸附起到阻礙作用,隨著溫度升高,NO2發生脫附,這樣就不利于生成硝酸鹽,催化劑表面可以吸附更多的NO進行反應,反應速率隨之加快,至300℃左右達到最高轉化率。赤泥/BaTiO3復合催化劑的活性中心是BaTiO3,鈣鈦礦結構的BaTiO3存在外表面反應和內表面反應,低溫下主要是催化劑外表面吸附氧氣的過程,高溫下催化劑內部的氧離子參與反應,所以溫度升高后催化劑BaTiO3活性增加,NO的轉化率隨著提高。
2.5 氧氣濃度對氧化氮轉化率的影響
本實驗選擇在5%、10%、15%3個不同氧氣濃度下,研究NO的轉化率的變化。圖5中,同等反應溫度下,隨著氧氣濃度的增加,NO的轉化率也呈現明顯增加的趨勢。這是因為,氧氣是吸附在催化劑的表面與NO反應,隨著氧氣濃度的增加,反應器中氧分壓增加,在催化劑表面吸附的O2增多,在煙氣空速不變的情況下,催化劑表面吸附的氧氣增加,故NO的轉化率增高。當催化劑表面吸附的O2達到飽和時,NO的轉化率曲線出現平衡趨勢,NO氧化率的最高值可以達到50%左右,與同等實驗條件下康靜娜等[10]研究的赤泥/BaZrO3催化劑表現的高溫活性接近,赤泥/BaZrO3催化劑在反應溫度400 ℃時,NO的催化氧化活性最大值為50.0%。唐曉龍竺[14]研究的過渡金屬氧化物催化劑如含有錳、鉻、鈷等,在低溫下~180 ℃時,NO的轉化率可以達到57%。與之相比,赤泥/BaTiO3復合催化劑在反應溫度方面還欠缺,需要進一步研究。同時從圖5中可以看出氧氣含量不同時,3條曲線均在300℃左右達到最大值,說明氧氣含量對催化劑的最優活性溫度點無明顯影響。
2.6 空速對對氧化氮轉化率的影響
在本實驗中,空速指煙氣(主要成分SO2)的體積空速,即單位時間內催化劑處理煙氣的體積量,它反映的是煙氣在反應器中的停留時間。煙氣的停留時間越長,煙氣與催化劑接觸的越充分,這樣有利于氣體向催化劑的內部結構中進行擴散,進而發生吸附反應,催化反應進行的越徹底。空速值與停留時間成反比,空速值越高,煙氣在反映器中的停留時間越短,催化劑活性越大。本實驗中是通過改變模擬氣體的流量來控制空速的。本實驗分別對空速8000 h-1、10 000 h-1、12 500 h-1、15 000 h-1下的NO轉化率進行研究。從圖6中可以看出,空速15000 h-1時催化劑的轉化率可以達到45.2%,8000 h-1時催化劑的轉化率可以達到49.8%,催化劑的轉化率降低。結果表明,隨著空速增加,催化劑反應的時間縮短,確實影響催化劑的轉化率。這是由于煙氣在催化劑上的反應過程,不但包括催化反應本身,還包括煙氣在催化劑中的傳遞過程,模擬煙氣從催化劑外表面通過外擴散、內擴散,才能到達催化劑活性部位發生反應。空速較低時,催化劑與氣體接觸時間長,可能存在煙氣還未進入催化劑活性部位甚至還未吸附在催化劑表面,就已經從反應器中流出,因此,造成煙氣轉化率低。另外從圖6中可以看出,空速對催化劑的最佳反應溫度值的位置沒有影響。
3 結論
為消除工業煙氣中氧化氮對空氣污染的問題,本文采用檸檬酸溶膠-凝膠法,以氧化鋁赤泥為原料,制備出鈣鈦礦結構的的赤泥/BaTiO3催化劑,并利用XRD、SEM和傅里葉變換紅外光譜定量分析方法研究了催化劑的結構。并通過氧化氮轉化率性能測試,揭示了以赤泥/BaTiO3為催化劑影響NO轉化率的影響因素。主要研究結論如下:當燒結溫度在500 ℃左右時,從SEM 圖中可以看到催化劑的晶型結構比較好,比表面積大,所以催化劑活性很高。實驗空速為9000 h-1、O2含量為15%、0.054%NO、N2平衡的條件下,燒結的催化劑的活性可以達到50%左右。煙氣中NO的轉化率隨著空速的提高而有所降低,隨著O2濃度的增加而提高,隨著NO濃度提高也會稍微降低。
參考文獻
[1] 胡忠攀,張凌峰,袁忠勇.赤泥在催化工業領域中的應用[J].石油學報(石油加工),2019,35(1):183-195.
[2] 王超,李長明,皇甫林,等.赤泥催化劑的制備及其對模擬煙氣中微量氨的脫除性能[J].化工學報,2019,70(3):1056-1064.
[3] 汪晨.赤泥及其改性材料在環境領域的應用[J].云南化工,2019,46(5):142-143,145.
[4] 李建芬,肖波,楊家寬,等.工業廢渣制備生物質裂解用催化劑載體及其性能[J].環境工程,2006,24(6):56-58.
[5] Wang S,ANG H M,TADE M O.Novel applications of red mud as coagulant,adsorbent and catalyst for environmentally benign processes[J].Chemosphere,2008,72(11):1621-1635.
[6] Oliveira A S,Teixeira I F ,Christofani T,et al.Biphasic oxidation reactions promoted by amphiphilic catalysts based on red mud residue[J]. Applied catalysis B:environmental,2014(144):144-151.
[7] Ncuyen H C,Pham V H,Kim D K,et al.Role of macroporosity in macro-mesoporous red mud catalysts for slurry-phase hydrocracking of vacuum residue[J].Applied catalysis A:general,2013(468):305-312.
[8] Alvarez J,Ordonez S,Rosal R,et al.A new method for enhancing the performance of red mud as a hydrogenation catalyst [J].Applied catalysis A:general,1999,180(1):399-409.
[9] 高愛梅,林培琰,屠兢,等.含貴金屬的BaZrO3儲存NOxt催化劑結構及性能研究[J],物理化學學報,2004,17(4):485-488.
[10] 康靜娜,張劍鋼.赤泥/BaZrO3催化劑的制備及性能研究[J],物理化學學報,2004,17(4):485-488.
[11] 王輝,趙秀閣,肖文德,等.FTIR多組分定量分析方法及其應用[J],華東理工大學學報(自然科學版).2001(14).1-5.
[12]Qi G,Yang R T,Chang R.MnOx-CeO2 mixed oxides prepared by co-precipitation for selective catalytic reduction of NO with NH3 at low temperatures[J]. Applied catalysis B:environmental,2004,51(2):93-106.
[13] 中本一雄.無機和配位化合物的紅外和拉曼光譜[M].4版.黃德如,汪仁慶,譯.北京: 化學工業出版社,1991:277.
[14] 唐曉龍,李華易,紅宏,等.過渡金屬氧化物催化氧化NO實驗研究[J].環境工程學報,2010,4(3):639-643.

