淫羊藿苷對藻酸鹽3D體外培養下小鼠軟骨細胞周期蛋白、β-catenin表達的影響
王鵬珍,熊喜峰,秦勝男,張金麗,李愛國
廣州市紅十字會醫院 廣州市創傷外科研究所,廣州510000
損傷關節軟骨的重塑和修復,需要足量、有活性的關節軟骨細胞[1,2]。關節軟骨是無血管和高度特異化的組織,內襯在活動關節表面。軟骨層可以降低關節面之間的摩擦,并可以起到緩沖減震、承載壓力的作用[3]。值得注意的是,關節軟骨一旦發生損傷,其固有的無血管、低細胞密度和低細胞遷移能力的特點都會限制軟骨組織的再生。如何獲得大量活性高、增殖能力強的軟骨細胞,在細胞治療關節軟骨損傷的過程中起關鍵作用[4,5]。文獻報道,適宜濃度的淫羊藿苷(ICA)可以顯著促進關節軟骨細胞增殖并提高細胞活性[2,6];我們的前期研究中也發現,ICA在10-6μmol/L 時可以顯著促進原代小鼠關節軟骨細胞增殖[7]。但是,其具體作用機制尚不清楚。2019年3~12月,我們擬在軟骨細胞-藻酸鹽3D培養條件下,研究ICA對體外小鼠關節軟骨細胞增殖相關蛋白Cyclin D1、Cyclin E、β-catenin表達的影響,旨在為ICA用于細胞工程治療骨關節炎提供理論基礎。
1 材料與方法
1.1 主要材料 ICA購于北京北奧創新科技有限公司,批號為20090503,經HPLC測定ICA 含量不低于98%;出生2 d的C57BL/6雄性小鼠均購自廣東省醫學實驗動物中心,許可證號SCXK-2013-0002,本實驗設計及過程均符合本院動物倫理委員會規定。DMEM完全培養基,含10% 小牛血清、100 U/mL青/鏈霉素、20 mmol/L L-谷氨酰胺;Ⅰ型膠原酶(9001-12-1,Sigma),D型膠原酶(11088866001,Roche)。抗兔HRP/DAB 免疫試劑盒批號(b64261,Abcama),兔抗鼠β-catenin(sc-7963,Santa Cruz),兔抗鼠Cyclin D1 (sc-2978,Santa Cruz),兔抗鼠Cyclin E(sc-2925, Santa Cruz);熒光定量PCR試劑盒TB Green Premix ExTaq Ⅱ (RR066A, Takara),熒光定量PCR儀(qTOWER 2.2,Analytik Jena AG)。
1.2 實驗方法
1.2.1 軟骨細胞的分離和培養 參考本課題組前期文獻的操作方法[7],取新生2 d的小鼠關節軟骨組織;用0.7 mg/mL的Ⅰ型膠原酶消化30 min,移入含0.7 mg/mL Ⅰ型膠原酶和3 mg/mL D型膠原酶的PBS混合液中,37 ℃消化6 h。用直徑180 mm的濾膜過濾消化下來的軟骨細胞,離心后用PBS洗3次,將細胞重懸在DMEM完全培養基中;在5% CO2、37 ℃條件下培養,每3 d換液1次[8,9]。
1.2.2 藻酸鹽3D復合體構建及冰凍切片制作 原代軟骨細胞用胰酶消化后,用 2%(w/v)滅菌的藻酸鹽溶液重懸細胞,制成1×106/mL 的細胞懸液,吹打均勻;吸取20 μL滴入裝有102 mmol/L 無菌CaCl2溶液的6孔板中,藻酸鹽與軟骨細胞很快凝結成三維復合物;待復合物形狀穩定后,小心吸走無菌CaCl2溶液;將復合物分為兩組,ICA組和對照組分別加入含10 μmol/L ICA 、不含ICA的DMEM完全培養基,每組設3個復孔;在37 ℃、5% CO2的培養箱中培養14 d,培養基每3 d更換1次。軟骨細胞-藻酸鹽3D復合物用PBS洗滌3次后,分為3份樣品。其中2份放入 4%多聚甲醛中固定,制作冰凍切片,切片厚度為 4 μmol/L,-80 ℃冰箱保存,用于阿利新藍組織學染色、免疫組化實驗;另外1份樣品中加TRIzol裂解,進行RNA提取,用于熒光定量PCR實驗。
1.2.3 軟骨細胞活性和酸性黏多糖合成情況觀察 采用阿利新藍組織學染色[10]。將冰凍切片從冰箱中取出,復溫5 min;用PBS洗滌3次,每次5 min。將切片放入1%阿利新藍染液中,染色10 min;用PBS洗滌3次,每次5 min。最后進行封片及鏡檢,依次進行梯度乙醇脫水,二甲苯透明,中性樹膠封片,于倒置顯微鏡下觀察拍照。成簇狀排列的軟骨細胞增多表示軟骨細胞活性增加,阿利新藍染色強度加深表示軟骨細胞酸性黏多糖合成增加。
1.2.4 軟骨細胞中Cyclin D1、Cyclin E、β-catenin蛋白檢測 采用免疫組化法。將冰凍切片從冰箱中拿取出,復溫5 min;PBS洗3次,每次5 min;3% H2O2孵育10 min,PBS洗3次,每次5 min。常溫下,血清封閉45 min。用濾紙吸去封閉液,直接滴加兔多克隆抗Cyclin D1(1∶3 000)、Cyclin E(1∶3 000)、β-catenin(1∶3 000)一抗工作液,4 ℃過夜,IgG作為陰性對照。次日,PBS洗3次,每次3 min。HRP標記二抗室溫下孵育 30 min。PBS 洗3次,每次3 min。DAB顯色5 min,自來水終止反應。PBS洗3次,每次3 min。蘇木素復染核30 s,自來水沖洗,封片及鏡檢。梯度乙醇脫水,二甲苯透明,中性樹膠封片,用倒置顯微鏡下觀察拍照。在顯微鏡下,隨機選擇組織切片的3個視野計數陽性細胞和總細胞,細胞內有目標蛋白表達且呈棕色為陽性細胞[9]。蛋白陽性表達率=陽性細胞/總細胞×100%。
1.2.5 軟骨細胞中Cyclin D1、Cyclin E、β-catenin mRNA檢測 采用熒光定量PCR法。用TRIzol試劑盒對樣品進行RNA抽提,用Nanodrop 2000分光光度計測定RNA濃度;將PrimeScriptTMMaster Mix試劑盒RNA進行逆轉錄,合成cDNA。用TB GreenTMPremix Ex TaqTM進行熒光定量分析,反應程序采用兩步法。反應條件:95 ℃預變性30 s,95 ℃變性5 s;60 ℃退火及延伸 34 s。以β-actin作為內參[10],用2-△△Ct對mRNA表達進行相對定量分析。目的基因引物序列見表1。
2 結果
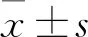
2.1 兩組軟骨細胞活性和酸性黏多糖合成情況 ICA組成簇狀排列的軟骨細胞明顯多于對照組,阿利新藍染色強度明顯深于對照組,并可見大量酸性黏多糖集聚與軟骨陷窩及周邊,表明ICA增加小鼠關節軟骨細胞活性和酸性黏多糖合成。見圖1。

圖1 兩組軟骨細胞活性和酸性黏多糖合成情況(阿利新藍染色)
2.2 兩組軟骨細胞中Cyclin D1、Cyclin E、β-catenin蛋白及mRNA表達比較 與對照組比較,其ICA組軟骨細胞中Cyclin D1、Cyclin E、β-catenin蛋白及mRNA表達均增加(P均<0.05)。見表2、圖2。
3 討論
膠原酸性黏多糖的蛋白核心結構上附著硫酸化糖胺聚糖(GAG),使其形成一個大的高度帶負電荷的分子,容易與酸性染料阿利新藍結合,阿利新藍染色的深淺可反映軟骨細胞酸性黏多糖合成量的多少[11]。本研究結果顯示,10 μmol/L的ICA可促進小鼠關節軟骨細胞的增殖與活性,并能提高細胞增殖相關蛋白的轉錄和表達水平。ICA顯著增加了小鼠軟骨細胞酸性黏多糖的合成與分泌,酸性黏多糖以及Ⅱ型膠原的致密結構又將軟骨細胞圍在致密的軟骨陷窩里,保證軟骨細胞代謝的營養供給,從而提高軟骨細胞的活性[12];同時,軟骨細胞外基質產生的因子本身也會增強軟骨細胞活性。
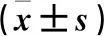
表2 兩組軟骨細胞Cyclin D、Cyclin E、 β-catenin的表達情況
注:與對照組比較,*P<0.05。

注:箭頭所示為目標蛋白在細胞中的表達部位。
圖2兩組軟骨細胞中Cyclin D1、Cyclin E、β-catenin蛋白表達情況(免疫組化法)
本研究顯示,在藻酸鹽3D培養下,ICA促進小鼠關節軟骨細胞周期蛋白Cyclin D1、Cyclin E 蛋白和mRNA的表達。Cyclin D1屬于周期蛋白家族成員之一,其功能是調節細胞周期,主要在G1期表達,驅動細胞向S期過渡,從而合成更多的DNA物質,為細胞分裂做準備。有研究表明,用RNA手段干擾大鼠軟骨細胞Cyclin D1表達,大鼠軟骨細胞細胞分裂停滯在G1期[13,14]。Cyclin E/周期依賴性激酶2(CDK2)復合體是細胞分裂從G1期進入S期重要的調節元件。文獻報道,ICA通過上調Cyclin E、CDK2以及下調p21、p27的表達,提高胚胎干細胞的自我更新能力[13]。β-catenin作為一種多功能的蛋白質,主要介導細胞間黏附和參與基因的表達,以此參與成骨細胞和軟骨細胞的增殖和分化[16,17]。本研究中,ICA激活了β-catenin的表達,Cyclin D1作為其靶基因和細胞分裂G1/S期的陽性助推器[18,19],表達水平也顯著上調。但是,具體是通過HIF-1α/β-catenin通路激活β-catenin,還是Wnt/β-catenin通路調控β-catenin表達,仍需要進一步深入研究。
本研究發現,小鼠關節軟骨細胞中β-catenin與Cyclin D1、Cyclin E均表達增加。究其機制,可能是藻酸鹽這種材料使細胞聚集成團,形成內部相對致密三維立體環境[8,20,21]。這種環境與軟骨細胞本身所處的軟骨外基質非常相似,為小鼠關節軟骨細胞提供了一個適宜軟骨細胞增殖和代謝的微環境。在這種條件下,ICA通過某種信號通路,激活β-catenin的轉錄和表達,從而誘發及其下游基因Cyclin D1、Cyclin E的表達。而且,藻酸鹽具有軟骨結構非常相似的致密立體結構,有利于軟骨細胞增殖和細胞之間的信號傳遞。由此可見,ICA可以通過上調β-catenin、Cyclin D1、Cyclin E表達,提高小鼠關節軟骨細胞活性,促進小鼠關節軟骨細胞增殖,該結論可為ICA用于細胞工程治療骨關節炎提供理論基礎。

