艾滋病模型中關鍵指標SIV DNA 絕對定量微滴式數字PCR 技術的創新應用
張麗麗,陸佳涵,薛 婧,叢 喆,魏 強
(中國醫學科學院醫學實驗動物研究所,北京協和醫學院比較醫學中心,國家衛健委人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,新發再發傳染病動物模型研究北京市重點實驗室,北京 100021)
SIV 感染恒河猴后,猴體內可產生持續性感染并形成病毒的儲存庫,與HIV 感染人的過程極其類似[1]。 清除儲存庫的策略研究是當前艾滋病研究中的熱點,因此準確評估病毒儲存庫的大小就顯得非常重要。 目前常用的病毒儲存庫的定量檢測方法是實時熒光定量PCR, 即qPCR,該方法通過標準曲線計算出樣本中的病毒DNA 拷貝數,實現相對意義上的“絕對定量”[2]。 數字PCR(digital PCR,dPCR)是近年來發展成熟起來的新技術,相比于qPCR 定量不需要依賴標準品,能直接檢測出樣品中的拷貝數,實現真正意義上的絕對定量[3]。
本研究依托 Bio-Rad 公司微滴式 dPCR(ddPCR)技術平臺,建立了SIV DNA 載量的絕對定量方法,并對微滴式dPCR 用于SIV DNA 檢測的范圍及準確性進行評估,以期為病毒儲存庫的定量提供可靠的技術保障。
1 材料和方法
1.1 實驗材料
1.1.1 質粒標準品
所用pGEM-SIVgag477 質粒,是將SIVmac251病毒RNA gag 基因上1360 ~1837 之間長度為477 bp 的片段克隆到pGEM T 載體上構建而成,由中國醫學科學院醫學實驗動物研究所艾滋病課題組制備并保存[4]。 對該質粒進行10 倍系列稀釋,取濃度分別是1、10、102、103、104、105、106、107copies/μL 的8 個標準品進行本研究,同時設置PCR 水為陰性對照(Neg)。
1.1.2 樣本
本研究中所用7 份DNA 樣本均是從SIV 感染猴外周血PBMC 中提取,對應編號依次是S1、S2、S3、S4、S5、S6、S7。
1.2 主要試劑與儀器
試劑盒為病毒核酸提取使用QIAamp? DNA Mini kit ( QIAGEN, 51306 ); TaqManTMGene Expression Master Mix (Thermo Fisher, 4369016)用于實時熒光定量PCR,微滴式dPCR 中用到的ddPCRTMDroplet Reader oil (Bio-Rad, 1863004)、Droplet Generation Oil for Probes ( Bio-Rad,1863005)、ddPCRTMSupermix for Probes(Bio-Rad,1863023)。 引物和探針由invitrogen 公司合成(表1),加水稀釋至10 μmol/L 備用[5]。

表1 微滴式dPCR 檢測SIV DNA 載量所使用的引物和探針Table 1 Primer and probe sequences for the quantification of SIV DNA detected by droplet dPCR
1.3 實驗方法
1.3.1 微滴式dPCR 實驗
主要實驗步驟如下:首先配制20 μL 定量反應體系(混合液10 μL,900 nmol/L 的引物1.8 μL,250 nmol/L 的探針0.5 μL,5.0 μL 的DNA 模板,補充水至20 μL),然后將其加入到DG8 cartridge 中間一排的8 個孔內,在最底下一排8 個孔中各加入70 μL 微滴生成油(DG Oil),蓋上膠墊,開始生成微滴。微滴生成于cartridge 最上面一排孔內,將生成的油滴轉移到96 孔板中,封膜后進行PCR 反應,最后用QuantaSoft 軟件進行數據讀取。 微滴式dPCR 反應條件:95℃10 min(×1),95℃30 s(×40),60℃1 min(×40),98℃10 min(×1)。
1.3.2 退火溫度的優化
本研究中,根據qPCR 的退火溫度,選擇57℃、58℃、59℃、60℃、61℃、62℃六個溫度進行實驗,優化ddPCR 的退火溫度。 模板選擇使用104的pGEM-SIVgag477 質粒標準品,將擴增拷貝數最高的溫度確定為最佳的退火溫度。
1.4 統計學方法
利用 QX200 Droplet Digital System 提供的Quantasoft 軟件進行ddPCR 反應的圖像處理,graphpad 進行顯著性差異分析。
2 結果
2.1 微滴式dPCR 信號識別
本研究中,所有反應的微滴生成正常,單個反應的總微滴數均超過10000(圖1a),最高是17626,最低是13264,目標分子的分布符合泊松分布的統計學原理[6],保證了后續分析結果的可靠性和準確性。 圖1b 中紅色為閾值線,陰性反應峰與陽性反應峰明顯分開,該方法可準確檢測出陰性微滴數與陽性微滴數。
2.2 微滴式dPCR 反應退火溫度的優化
ddPCR 退火溫度在57℃~62℃之間均能檢測到熒光信號。 57℃、62℃所得拷貝數較低,分別為(346±19.23)copies/μL 和(345±3.68)copies/μL,58℃~61℃測得的拷貝數比較高且接近,60℃時拷貝數最高,為(460±16.97)copies/μL,因此60℃為反應最適退火溫度(圖2)。
2.3 10 倍系列稀釋pGEM-SIVgag477 質粒標準品微滴式dPCR、qPCR 檢測結果及兩種方法的相關性評估
pGEM-SIVgag477 質粒ddPCR 檢測的一維散點圖顯示,107copies/μL 標準品為全陽性微滴,無陰性微滴(圖3a),超出了檢測上限;從10 ~106copies/μL的標準品,ddPCR 的檢測值在0.3 ~3.96 × 104copies/μL 時,qPCR 與ddPCR 測定結果線性關系良好,r=0.9981,提示該檢測方法可靠。 1copies/μL標準品用qPCR 方法未檢出(見圖3b),ddPCR 方法也大部分顯示陰性,雖然個別孔檢測出數值,但明顯偏離線性曲線,因此也判定為陰性(見表2)。
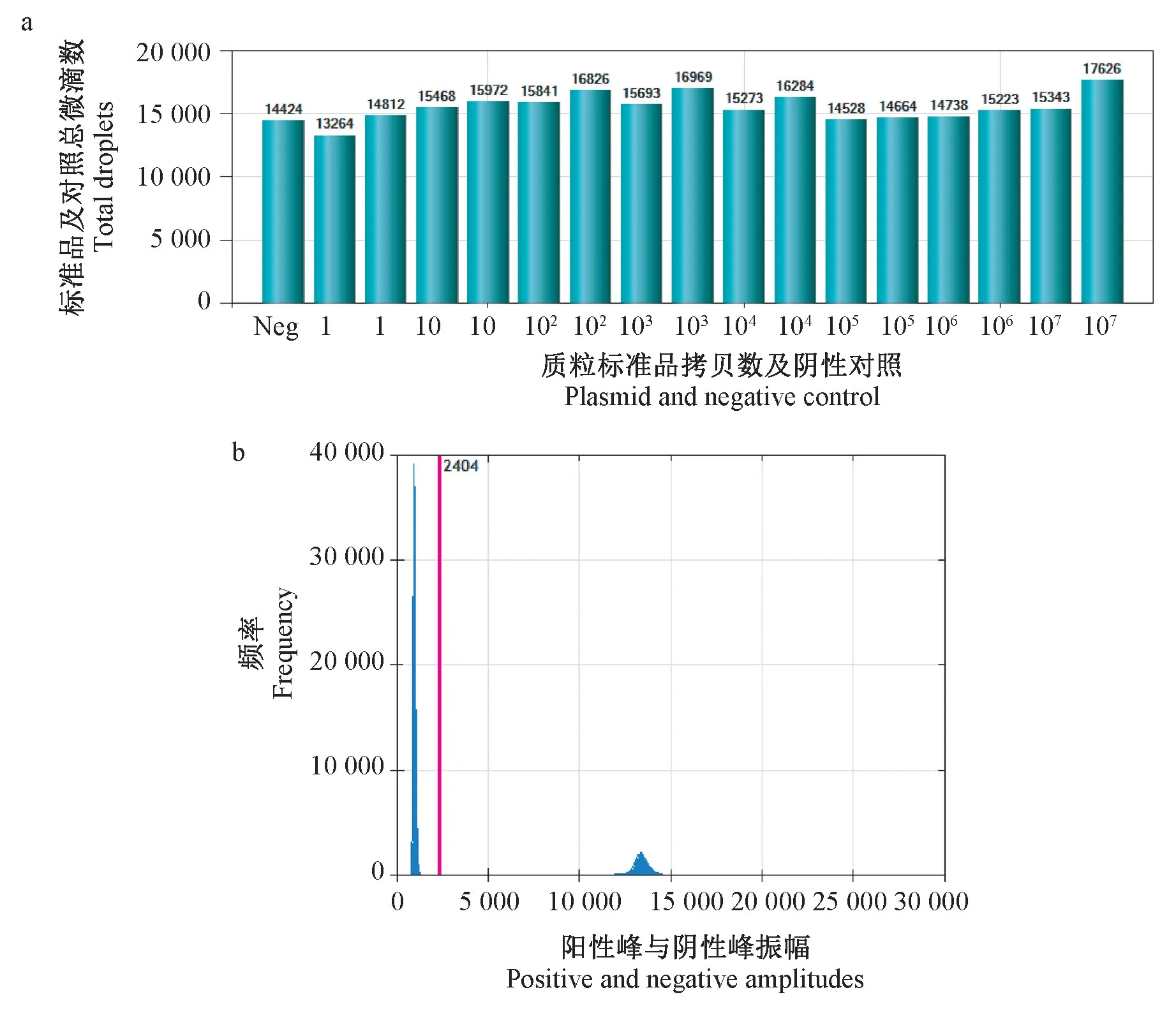
圖1 總微滴數生成柱狀圖及檢測結果直方圖Note. a, histogram of total droplet number for pGEM-SIVgag477.b, histogram of test results for different concentrations.Figure 1 Histogram of total droplet number and histogram of test results
2.4 樣本檢測
分別使用ddPCR 及qPCR 兩種方法檢測了7份SIV 感染猴PBMC 的DNA 樣本。 ddPCR 檢測樣本的CV 值介于1.34%~16.13%之間,隨著拷貝數減少變異系數逐漸增大。 但(1.7±0.14)copies/μL以上的樣本檢測變異系數均低于10%,顯示了良好的穩定性。 S6、S7 的檢測結果均小于1copies/μL,CV 值均大于15%(見表3)。
3 討論
艾滋病毒感染機體后形成的病毒儲存庫,是目前艾滋病治療中的最大障礙。 如何準確評估病毒儲存庫的大小就顯得尤為迫切。 第三代PCR 技術——數字PCR 自問世以來,就被寄予厚望。 不同于現階段被廣泛應用的實時熒光定量PCR 技術,它能夠直接計算出待檢樣本的拷貝數,不依賴Ct 值及標準曲線,實現了真正意義上的絕對定量。 尤其近年來在突破了樣品分配的瓶頸后,其在生物醫藥領域的應用越來越廣泛,包括拷貝數變異分析[7]、復雜樣本基因表達檢測[8]以及病毒拷貝數檢測[9]等。 本研究中,我們嘗試建立了微滴式dPCR 方法,用于定量檢測SIV DNA 拷貝數。 結果顯示在0.3 copies/μL 到3.96 × 104copies/μL 的范圍內,能夠實現有效擴增,線性關系良好。 與qPCR 相比,靈敏度基本保持一致。 但隨著樣本拷貝數的降低,微滴式dPCR 檢測結果變異度也還是明顯加大,檢測結果不太穩定。 如果樣本拷貝數超出檢測上限,也不能實現有效擴增,需要對其進行稀釋后再檢測。ddPCR 的檢測范圍過窄,可能和該技術需要對樣本進行極限稀釋有關。
另外,本研究還發現,現階段微滴式dPCR 實驗過程稍顯繁瑣,對操作人員的技術要求較高。 例如整個操作過程需要多次轉板易造成樣本的損失;加樣產生微小氣泡妨礙油滴生成,繼而導致PCR 無法正常擴增。 這些操作可能限制了該技術的普及和大規模使用。 但作為一項新興技術,微滴式dPCR還是給艾滋病研究帶來了很大的驚喜,對艾滋病毒儲存庫更真實準確地定量檢測,將對清除儲存庫策略研究、抗艾滋病疫苗及藥物研究提供有效的技術保障。
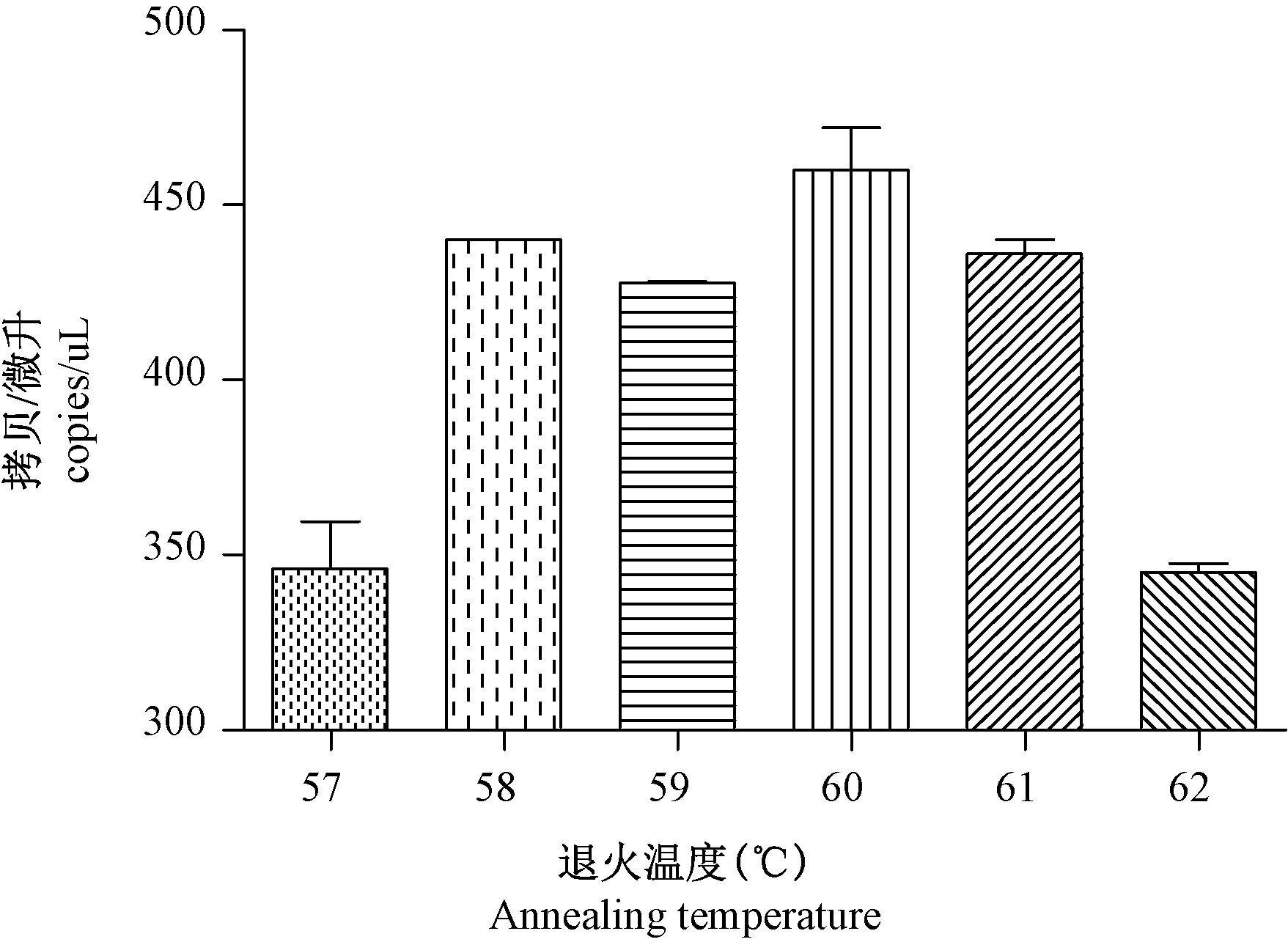
圖2 ddPCR 不同退火溫度下測定pGEM-SIVgag477質粒的拷貝數結果Figure 2 Copy numbers of pGEM-SIVgag477 detected by ddPCR at different annealing temperatures
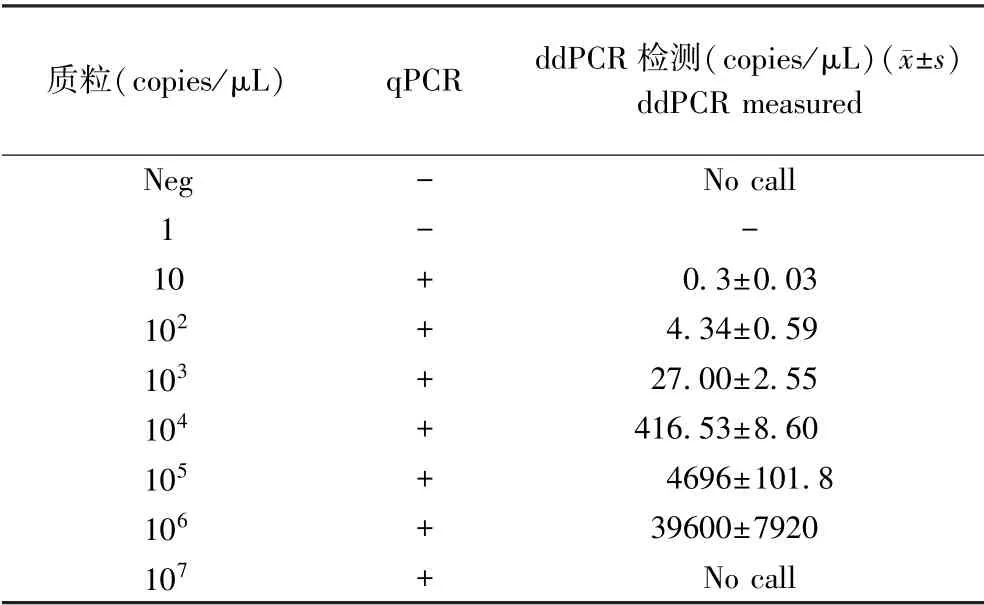
表2 10 倍系列稀釋pGEM-SIVgag477 質粒標準品qPCR 及ddPCR 檢測結果Table 2 10-fold serial dilution output of pGEM-SIVgag477 detected by ddPCR and qPCR

圖3 標準品擴增一維散點圖及不同檢測方法相關性評估Note: a, One-dimensional scatter plot of pGEM-SIVgag477 detected by ddPCR. b, liner correlation analysis of ddPCR and qPCR.Figure 3 One-dimensional scatter plot and liner correlation analysis

表3 ddPCR 及qPCR 測定SIV 感染猴PBMC 中total DNA 拷貝數結果Table 3 The results of DNA samples detected by ddPCR and qPCR separately

