母嬰分離模型的常見行為范式評價及研究進展
張獻強,孫浩然,孫延超,高衛星,張希妹,李長江*
(1.心理學系教研室,濰坊醫學院,山東 濰坊 261052; 2.臨床醫學院,濰坊醫學院,山東 濰坊 261053;3.精神心理科,陸軍第八十集團軍醫院,山東 濰坊 261021)
分離焦慮是指個體與其依戀對象分離,或與其家庭分離相關的過度焦慮和發展方面的不適[1]。作為重要的早期社會剝奪現象,母嬰分離(maternal separation,MS)是指發生在出生后至斷乳前的年幼個體與其依戀對象的分離[2],這種早期應激方式會導致持久的大腦結構改變,影響神經網絡及功能,并增加個體成年后甚至更早發生精神障礙的風險[3]。 本文通過對MS 模型大、小鼠不同行為范式的綜述,揭示生命早期應激對個體行為學及大腦生物學機制的影響,有助于選擇對生命早期應激的更加科學的干預策略,避免其對個體身心健康所造成損害,對兒童生理及心理發展有重要意義[4]。
1 母嬰分離模型的建立
新生動物斷奶前(出生后1 ~21 d)的早期社會環境剝奪包括早期干預(early handling,EH)以及MS 兩種方式。 EH 是指每天將母鼠與子鼠短暫地分離3~15 min;而MS 則是將母鼠與子鼠長時間地分開(1~24 h)[5]。 MS 模型構建方法多樣,其主要區別在于MS 的頻率和持續時間,并且不同的分離頻率與每次分離的持續時間產生的實驗效果也存在明顯差異。 MS 的主要方式有兩種,即動物出生后(postnatal day,PND)1~21 d 中的某一天(一般為第9 天)進行24 h 的MS,和連續1~3 周對新生動物每天進行一段時間(3~6 h)的MS[6-7]。 母嬰分離應激在豚鼠和鳥類中都有研究,但在大鼠和小鼠動物模型中的應用較為廣泛[7]。
MS 動物模型中,母鼠是構成其子代幼鼠個體社會環境的重要組成部分,為幼鼠提供了營養、熱量、軀體感覺、運動覺、嗅覺及聽覺刺激等重要資源[8]。 一般認為,EH 分離時間較短,等同于正常情況下母親離巢覓食等行為的時間,因此并不構成嚴重的剝奪;而MS 的分離時間較長,可以代表一種嚴重的環境剝奪[9]。 同時,MS 可使個體前脈沖抑制減弱,產生分離焦慮,出現抑郁樣行為[10]及認知功能損傷。 通過MS 這種方式干擾大鼠早期生活環境,會對大鼠的神經功能及行為產生持久的影響,因此常被用作生命早期應激模型[11]。
2 MS 動物模型前脈沖抑制范式及其生物學機制
2.1 MS 動物模型的前脈沖抑制
驚反射是人與動物對于威脅刺激的一種迅速反應,對適應環境有重要意義,但對動物的認知和行為活動產生一定的干擾作用,中樞神經系統能夠抑制驚反射以減少其對認知和行為的干擾。 驚反射的前脈沖抑制(pre-pulse inhibitation,PPI)是指在強的驚反射刺激之前的一定時間內,給予弱感覺刺激對驚反射產生抑制作用,這種作用可以降低強脈沖刺激所引發的反應,是對腦內信息加工過程的一種保護機制[12]。 Ellenbroek 等[13]研究認為MS 對PPI 的影響具有延遲效應,即MS 雄性或雌性Wistar大鼠均表現出PPI 的顯著降低。 還有研究發現[14],出生后MS(PND9,24 h)對Wistar 大鼠PPI 的影響較小,而出生后MS(PND9,12 h/d;PND11,12 h/d)的Wistar 大鼠PPI 受到了嚴重影響,即驚反射的前脈沖抑制減弱,更易產生驚反射。 提示MS 分離頻率越高,對個體的行為及神經發育產生的影響越大。
2.2 MS 動物模型的前脈沖抑制的生物學機制
Long-Evans 大鼠早期的MS 會極大地增加后代對多巴胺興奮劑的敏感性而減少對多巴胺拮抗劑的敏感性[15]。 研究表明,MS(PND9,24 h)對PPI 有明顯的損害效果。 給予多巴胺受體激動劑可破環PPI[16], 這一作用可能是由伏隔核( nucleus accumbens,NAcc)的多巴胺D2 受體介導的。 NAcc接受來自內側前額葉(medial prefrontal cortex,mPFC)等腦區的谷氨酸能纖維投射,是整合感覺信息和產生運動的交接腦區[17]。 MS 的Wistar 大鼠NAcc 內多巴胺代謝產物高香草酸水平顯著高于對照組[18]。 有研究將多巴胺D2 受體激動劑喹吡羅或多巴胺注入NAcc 導致PPI 降低,而當給予多巴胺D2 受體拮抗劑后PPI 的降低效應消失[19]。 另外,如果人為提高NAcc 多巴胺受體的敏感性,原本對PPI 作用較弱的低劑量阿撲嗎啡也能顯著地減弱PPI。 也有報道稱D4 受體拮抗劑NGD94-1 可以逆轉阿撲嗎啡導致的PPI 降低,顯然多巴胺受體的各亞型所起的作用是不同的。 并且,在NAcc 的核心區和外周區注入谷氨酸能受體激動劑AMPA 都能減弱PPI,NAcc 可能是通過谷氨酸能和多巴胺能系統的相互作用共同調節PPI[20],但其具體機制還有待進一步探討。
此外,Fijal 等[21]研究發現抗精神病藥改善PPI的機制中,5-羥色胺(5-hydroxytryptamine,5-HT)受體也參與了部分作用。 也有研究表明全身應用5-HT 釋放劑或部分受體興奮劑可以使Sprague-Dawley(SD)大鼠的PPI 降低[19]。
3 MS 動物模型焦慮樣抑郁樣行為及其生物學機制
3.1 MS 動物模型的焦慮樣與抑郁樣行為
MS 焦慮樣與抑郁樣行為可運用曠場實驗(open field test,OFT)、高架十字迷宮實驗(elevated plus maze,EPM)、強迫游泳實驗(forced swimming test,FST)、糖水偏好實驗(sucrose preference test,SPT)等進行評價。
3.1.1 曠場實驗
曠場實驗是通過觀察并記錄實驗動物在新異環境中的自發活動行為而對其焦慮水平進行評價的一種行為學范式。 研究表明MS(PND3 ~14,3 h/d)可顯著增加成年期Wistar 大鼠在曠場測試中的自發運動水平[22],然而,也有研究發現經歷MS(PND1~14,3 h/d)的雄性C57BL/6 小鼠進入曠場的中央區域的時間顯著減少,相同處理下的雌性小鼠也表現出類似的結果[23]。 這說明在相同的MS處理條件下,子代大、小鼠在曠場中的焦慮水平可能因實驗動物品種的差異而產生不同的結果。
3.1.2 高架十字迷宮實驗
高架十字迷宮實驗也是利用動物對新異環境的探究和對高架開放臂的恐懼來評估動物焦慮水平的行為學范式。 研究發現,與對照組相比,經歷MS(PND1 ~21,4.5 h/d)的Wistar 大鼠在開放臂的停留時間顯著降低,表現出更為明顯的焦慮情緒[24]。 此外,MS(PND1 ~14,3 h/d)處理后的雄性C57BL/6 小鼠進入開放臂與進入所有臂的次數之比明顯低于正常雄鼠,表現為焦慮水平的提高,而雌性C57BL/6 小鼠在EPM 測試中則不受母嬰分離的影響[23],這說明性別差異可能在MS 誘發的焦慮障礙等疾病中發揮著重要的調控作用。
3.1.3 強迫游泳實驗
強迫游泳實驗最早由法國學者Porsolt 等[25]提出,用于大、小鼠等實驗動物抑郁樣行為的研究,常用不動時間的變化作為檢測指標。 Paternain 等[10]研究發現,經歷MS(PND2 ~21,3 h/d)后的成年Wistar 大鼠,靜止不動行為時間顯著高于對照組。而另一項研究發現MS(PND2 ~14,3 h/d)對SD 大鼠的不動時間沒有影響[26],這些研究結果的不同或許與大鼠的品系以及母嬰分離的頻率和時程有關。
3.1.4 糖水偏好實驗
糖水偏好實驗是通過計算糖水偏好百分比(糖水偏好百分比=糖水消耗量/總體消耗量×100%)來檢測快感缺乏的一種行為范式[27]。 有研究表明,與對照組的Wistar 大鼠相比,經歷MS(PND2 ~21,3 h/d)處理的Wistar 大鼠糖水偏好百分比顯著下降,出現快感缺乏的癥狀,而MS 后的Wistar 大鼠與對照組在總體水的攝取量上沒有差異[28]。 這些動物實驗結果表明MS 處理能夠誘發大鼠產生顯著的抑郁樣行為,并且不同的分離方式和動物品系可能產生不同的實驗結果。
3.2 MS 動物模型的焦慮與抑郁樣行為的生物學機制
大量的前期研究已證實,實驗動物的焦慮、抑郁樣行為可能與下丘腦- 垂體- 腎上腺(hypothalamic-pituitary-adrenal,HPA)軸的功能失調密切相關[29]。 經歷MS(PND2~14,3 h/d)的成年期Wistar 大鼠在出現焦慮、抑郁樣行為的同時,HPA軸功能亢進,表現為腎上腺皮質激素(Adrenal cortical hormone,ACTH)和皮質酮(Corticosterone,CORT)濃度顯著升高[26-28]。
此外,炎性細胞因子在MS 引發的焦慮、抑郁樣行為中也發揮著重要作用[30]。 MS 處理能增加炎性細胞因子IL-1β 在腹側海馬、PFC 及血清中的表達,同時降低腹側海馬IL-10 的表達水平,并且該現象能被逆轉并改善焦慮抑郁樣行為。 近期研究顯示,抑制元素-1 沉默轉錄因子(Repressor element-1 silencing transcription factor,REST)能通過與抑制元素-1 特異性結合,調控受MS 影響的促腎上腺皮質激素釋放激素(Corticotropin releasing hormone,CRH)的表達水平。 研究表明,MS(PND2 ~14,3 h/d)增加了REST4 蛋白質及mRNA 的含量,并在經歷MS 的SD 大鼠mPFC 中發現了REST4 的瞬時過度表達[26]。 綜上,HPA 軸的失調以及炎性細胞因子可能與焦慮、抑郁樣行為的產生有密切聯系,同時REST 對相關激素的調節功能或許在動物應激行為的恢復過程中發揮著關鍵作用。
4 MS 動物模型認知、學習記憶障礙及其生物學機制
4.1 MS 動物模型的認知與學習記憶能力
目前有多種實驗被用來評價大腦認知和學習記憶能力的改變。 其中認知記憶的改變常用新穎物體識別測試(object recognition test)來評價,Morris水迷宮(Morris water maze)和T 迷宮(T-maze)通常用來檢測模型動物空間記憶能力的改變,而與恐懼相關的學習記憶能力的變化則通過條件性恐懼記憶測試來檢測。
4.1.1 新穎物體識別測試
新穎物體識別測試利用動物先天對新物體的探究傾向并通過動物對熟悉與新鮮刺激的鑒別來檢測實驗動物認知記憶的改變。 該項試驗對研究記憶的獲得、鞏固與再鞏固有重要意義[31]。 在一項不同母嬰分離時間對Wistar 大鼠不同發育階段影響的研究顯示,不同類型的MS 會產生不同程度的認知損傷。 研究發現,MS(PND1~10,4 h/d)會導致青春期的Wistar 大鼠目標識別損傷;而MS(PND1 ~21,4 h/d)則會將這種損傷一直持續到成年期[32]。
青春期前食物中的膽堿水平也會引發成年期大鼠認知行為的改變,攝入少于需求量膽堿的Wistar 大鼠在經歷MS(PND1 ~14,3 h/d)后表現出對新穎物體識別的能力降低,攝取的食物中含有超量膽堿的MS 大鼠對新物體的識別能力顯著高于機會水平;而對照組中只有無膽堿攝入組對新物體的識別能力低于機會水平[33]。 以上結果為膽堿能夠恢復由母嬰分離所引起的認知功能障礙提供了新依據。
4.1.2 Morris 水迷宮
Morris 水迷宮通過強迫實驗動物游泳,學習尋找隱藏在水中的平臺來檢測其空間記憶能力。 結果顯示[34-35],MS(PND1 ~10,3 h/d;PND2 ~14,3 h/d)與MS(PND1~14,6 h/d)均造成了成年SD 大鼠空間學習記憶能力的下降。 而在Tata 等人的研究顯示,雖然MS(PND1 ~6,3 h/d)也明顯降低了Wistar 大鼠的空間記憶能力,但MS(PND1 ~6,15 min/d)并未影響Wistar 大鼠的空間記憶能力。 這提示MS 的持續時間可能是影響大鼠的空間記憶能力的關鍵因素之一。 且有研究顯示,隨著MS 每天分離時間的增強,大鼠空間記憶能力的損傷也在不斷增大[36]。 此外,在Morris 水迷宮的反向測試實驗中,MS 處理損傷了SD 大鼠獲取新的學習記憶的能力[12],導致青春期和成年初期的Wistar 子鼠反向學習能力下降[22]。 這些結果表明子代大鼠的學習和記憶能力均受到MS 的影響,存在一定的記憶功能損傷。
然而,目前的研究所采用的不同的MS 處理方式對實驗的結果及影響仍存在較大爭議,不同的實驗數據顯示MS 的頻率和持續時間與大鼠的學習記憶能力之間可能存在交互作用,而這兩種影響因素對大鼠的學習記憶能力、反向學習能力之間的具體關系,還需要進一步的研究探索和驗證。
4.1.3 條件性恐懼記憶測試
條件性恐懼記憶作為一種獨特的記憶形式,是通過將動物的一個厭惡事件(通常是足部電擊)與一個中性刺激條件(例如環境、燈光或聲音)結合在一起,并在再次經歷中性刺激條件時誘發條件反射,通過測試再次經歷刺激時一定時間內動物的僵住時間來判斷恐懼相關記憶的形成[37-38]。 Chocyk等[39]通過研究發現,MS(PND1 ~14,3 h/d)后的Wistar 大鼠在青春期會表現出環境相關和聽覺相關恐懼條件反射的降低。 同時,另一項研究顯示,經歷MS(PND1~21,6 h/d)的雌性Wistar 大鼠在成年后恐懼記憶測試中表現為僵住時間的降低[40]。 這表示MS 可能對不同成長階段的大鼠恐懼條件反射的建立均能造成影響。
4.2 MS 動物模型的認知與學習記憶障礙的生的學機制
海馬區神經細胞對糖皮質激素(glucocorticoid,GC)的脆弱性被認為是影響認知功能的最重要機制之一。 海馬體具有高密度的糖皮質激素受體(glucocorticoid receptor,GR),在調節HPA 軸中發揮重要的作用。 Sapolsky 等[33]提出的糖皮質激素級聯假說認為,高水平的GC 會導致海馬體的神經元缺失,進而導致GR 的減少。 由于GR 在GC 的負反饋中起作用,它的丟失可能導致GC 水平的增加。因此,早期MS 與海馬體中CRH 的表達和記憶損傷有很強的聯系。 此外,鼻周皮層的改變同樣可能是引起認知損傷的原因之一。 鼻周皮層是一個高級聯合區域,其中某些神經細胞對熟悉物體的反應性較低。 這種認知缺乏產生原因的一種解釋是,MS會導致乙酰膽堿酯酶的增加,而當使用乙酰膽堿酯酶抑制劑如加蘭他敏時,這種認知損傷可以被逆轉[32]。 因此,鼻周皮層乙酰膽堿酯酶的調控可能是治療母嬰分離導致的認知損傷的重要靶點。
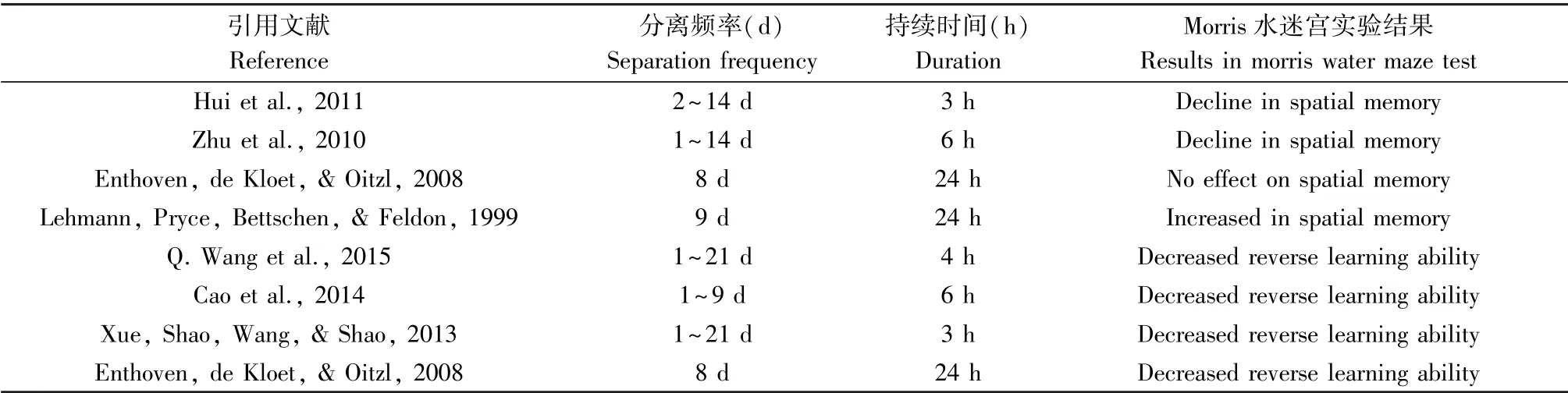
表1 各文獻中MS 方式與Morris 水迷宮實驗結果比較Table 1 Comparison of maternal separation methods and experimental results using the Morris water maze in the literature
腦源性神經營養因子 ( brain-derived neurotrophic factor,BDNF)廣泛分布于中樞神經系統及周圍神經系統,尤其在海馬中的表達水平最高。BDNF 對學習相關的突觸可塑性和長期記憶的維持至關重要[41]。 研究表明[39]MS(PND10 ~15,3 h/d)處理的Wistar 子鼠海馬內BDNF 的mRNA 在第16天時降低,但在第30 天和第60 天卻顯著增加。Roceri 等[42]在研究中發現,經歷MS(PND2 ~14,3 h/d)的SD 大鼠在出生后第17 天海馬內BDNF mRNA 以及BDNF 蛋白質水平顯著升高,但在第35天和第90 天與對照組無顯著性差異。 而Shu 等[43]研究顯示,受MS(PND2~14,3 h/d)的影響,成年期MS 的SD 大鼠海馬內BDNF 的表達顯著低于對照組。 這些不同的研究結果表明,作為大腦代償機制的一部分,在經歷過MS 刺激后,BDNF 的表達會在一個短暫時間的降低后出現明顯的上調,而在分離后期則會趨向一個相對穩定的水平。 目前,BDNF這種相對穩定的表達水平與MS 實驗條件的關系尚不明確,個體在經歷MS 后海馬內BDNF 的具體變化過程也需要進一步研究。
5 結 論
MS 作為一種早期社會剝奪方式,可用于早期生命應激研究的動物模型的建立。 該模型在動物行為學實驗及生理學實驗研究中表現出較好的應用前景。 但MS 建模方式中分離頻率和持續時間之間的交互作用對實驗結果的影響尚未完全明確。同時,大部分對相關分子機制的研究僅僅只是呈現某一年齡階段的結果,較少有研究對MS 導致的相關分子變化的連續檢測來反映其在MS 的影響下一個持續反應變化的過程。 隨著表觀遺傳學的不斷發展,表觀遺傳修飾在早期的生活經驗中通過改變某些神經元基因的表達水平,從而控制學習和記憶的相關機制已經成為一個新的研究熱點。 因此,在今后的研究中,針對分離方式的深入研究及分析,以及對相關分子的持續性變化過程的檢測和相應的表觀遺傳修飾的研究是有必要的。 本文對大、小鼠中母嬰分離常見的行為學范式及相關生物學機制的研究成果進行了綜述,闡明MS 應用于早期生命應激研究中建模以及行為學實驗的可行性與廣泛適用性,為今后采用該模型進行深入研究提供一定的理論基礎及實驗指導。 另一方面,我們還需更嚴格地控制實驗條件,進而為應激損傷的治療研究奠定基礎,這對提高其社會實用價值具有重要意義。

