注射用還原型谷胱甘肽鈉的過敏性試驗研究
馬 會,高 梅,李 雪,張文濤,朱立欣
(山東省藥學科學院 山東省化學藥物重點實驗室,山東 濟南 250101)
還原型谷胱甘肽是人類細胞能自然合成的一種三肽,由谷氨酸、甘氨酸、半胱氨酸組成,含豐富的巰基,可激活多種酶,促進糖、蛋白質和脂肪的代謝,影響細胞整個代謝過程[1]。注射用還原型谷胱甘肽鈉主要通過巰基與體內的自由基結合,將其轉化為容易代謝的酸類物質從而加速排泄,臨床主要用于治療肝臟疾病、放射治療患者、化療患者、急性胰腺炎、慢性阻塞性肺疾病及中毒等癥狀[2-5]。在臨床使用過程中,還原型谷胱甘肽可能會作為抗原,誘發機體產生過敏反應,常見癥狀包括皮疹、惡心、嘔吐、血壓下降、脈搏異常等[6]。
根據《藥物刺激性、過敏性和溶血性研究技術指導原則》[7]要求,局部給藥發揮全身作用的注射劑需考察Ⅰ型過敏反應,考察方法包括主動全身過敏試驗(ASA)和被動皮膚過敏試驗(PCA)。本研究按照指導原則的要求對注射用還原型谷胱甘肽鈉進行了豚鼠ASA試驗和大鼠PCA試驗,評價其Ⅰ型過敏反應情況。
1 儀器與材料
1.1 儀器
UW2200H電子天平(日本島津);JW-1032離心機(安徽嘉文);CO2麻醉箱(北京美綠洲);HFsafe-1200生物安全柜(上海力申);AY220電子天平(日本島津公司)。
1.2 試劑
注射用還原型谷胱甘肽鈉(批號180401,由山東省藥學科學院提供);牛血清白蛋白(批號829L054,Solarbio);0.9 %氯化鈉注射液(批號3218052304,青州堯王制藥有限公司);弗氏完全佐劑(批號SLBR3877V,Sigma);伊文思藍(批號161222,上海藍季);戊巴比妥鈉(批號M20180705152530,Merck)。
1.3 實驗動物
SPF級Hartley豚鼠,由青島康大生物科技有限公司提供,體重300~400 g,實驗動物生產許可證號SCXK(魯)2016 0002;SPF級SD大鼠,由北京維通利華實驗動物技術有限公司提供,體重150~250 g,實驗動物生產許可證號SCXK(京)2016-0006。動物飼養于SPF級飼養室,實驗動物使用許可證號:SYXK(魯)2018 0031,飼養室溫度20~26 ℃,濕度40 %~70 %,晝夜明暗交替時間12 h/12 h。
2 方法[7]
2.1 豚鼠ASA試驗
2.1.1 實驗動物分組 選取24只健康Hartley豚鼠,隨機分為4組,分別為陰性對照組、注射用還原型谷胱甘肽鈉低、高劑量組、陽性對照組,每組6只,雌雄各半。
2.1.2 致敏與激發 陰性對照組給予0.9 %氯化鈉注射液,低劑量組和高劑量組分別給予注射用谷胱甘肽鈉(180,360 mg/ml),陽性對照組給予牛血清白蛋白(20 mg/ml),致敏途徑為腹腔注射,給藥體積為0.5 ml/只,隔日1次,共致敏3次,于末次致敏后第14天分別取3只動物(2雌1雄)快速靜脈注射激發,第21天取剩余3只動物激發。激發時足跖靜脈注射2倍致敏劑量的抗原。
2.1.3 判斷標準 激發給藥后即刻至3 h詳細觀察并記錄每只豚鼠的反應,按照表1判斷過敏反應發生程度,計算過敏反應率(每組發生過敏反應的動物數/該組動物總數),根據過敏反應發生率和發生程度綜合評價過敏反應情況。
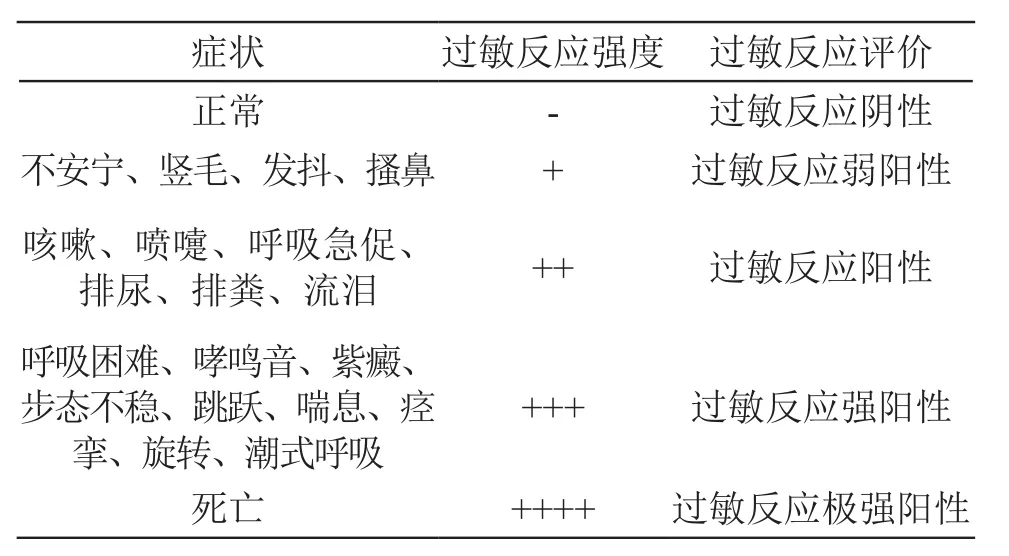
表1 全身過敏反應評價標準
2.2 大鼠PCA試驗
2.2.1 抗體血清制備 選取16只健康SD大鼠,隨機分為陰性對照組、注射用還原型谷胱甘肽鈉低、高劑量組、陽性對照組,每組4只,雌雄各半。陰性對照組給予0.9 %氯化鈉注射液,低劑量組和高劑量組分別給予注射用還原型谷胱甘肽鈉溶液(100,200 mg/ml),陽性對照組給予牛血清白蛋白(20 mg/ml)。致敏時,各組均皮下注射相應抗原與弗氏完全佐劑等體積混合液1 ml,隔日1次,共致敏3次。末次致敏后第10天,采用戊巴比妥鈉麻醉動物后腹主動脈取血,2000 r/min離心10 min,分離抗體血清。
2.2.2 大鼠同種PCA試驗 另取24只健康SD大鼠,按抗體血清制備階段的組別隨機分組,每組6只,雌雄各半。將動物背部脫毛,距離中線兩側1.5 cm處選擇4個注射點,分別皮內注射不同稀釋度(原液,1:2,1:4,1:8)的抗體血清0.1 ml,24 h后尾靜脈注射與致敏劑量相同的激發抗原與等體積的0.5 %伊文思藍混合液1 ml,激發給藥后約30 min測量皮膚內側的藍斑直徑,大于5 mm時為陽性。
2.3 數據統計
3 結果
3.1 豚鼠ASA試驗結果
3.1.1 一般狀態觀察 致敏期間,陰性對照組、低劑量組和陽性對照組動物未見異常。高劑量組動物在首次、第二次致敏后未見異常,末次致敏后即刻出現不安寧、跳躍癥狀,約2 min恢復正常。
3.1.2 體重 激發時,注射用還原型谷胱甘肽鈉高劑量組豚鼠體重明顯低于同期陰性對照組(P<0.05),其余各組與陰性對照組比較差異無統計學意義(P>0.05)。結果見表2。
3.1.3 過敏評價結果 激發給藥后3 h內觀察,陰性對照組、注射用還原型谷胱甘肽鈉低、高劑量組均未見過敏反應癥狀,過敏反應陰性。陽性對照組均出現搔鼻、步態不穩、呼吸困難、排尿、死亡等全身過敏反應癥狀,過敏反應為強陽性,陽性發生率100 %。結果見表3。
3.2 大鼠PCA試驗結果
3.2.1 一般狀態觀察 致敏期間觀察,注射用還原型谷胱甘肽鈉低、高劑量組、陽性對照組和陰性對照組所有動物一般狀況良好,自主活動正常,體重增長正常,未見其他異常反應。
3.2.2 體重 注射用還原型谷胱甘肽鈉低、高劑量組、陽性對照組動物體重與陰性對照組比較,差異無統計學意義。結果見表4。
3.2.3 過敏評價結果 陰性對照組、注射用還原型谷胱甘肽鈉低、高劑量組動物注射部位各稀釋度下均未出現藍斑,過敏反應陰性。陽性對照組6只動物均出現藍斑,抗體血清原液和1:2,1:4,1:8抗體血清的藍斑平均直徑大于5 mm,陽性反應率100 %。結果見表5。
表2 注射用還原型谷胱甘肽鈉對豚鼠體重的影響( ±s,n=6)
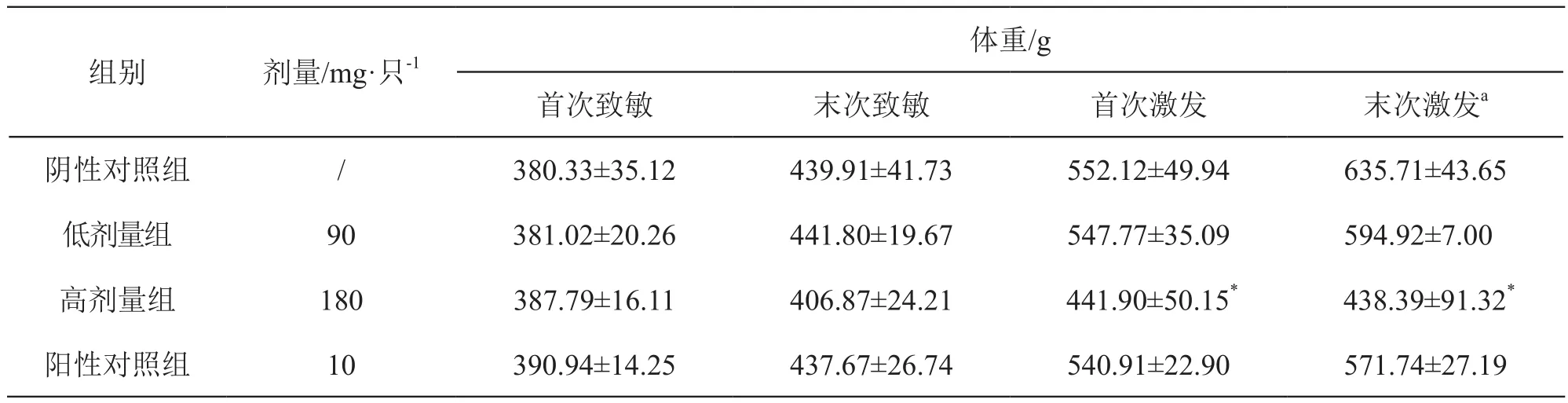
表2 注射用還原型谷胱甘肽鈉對豚鼠體重的影響( ±s,n=6)
注:*P<0.05 vs 陰性對照組;a動物數為3只
體重/g首次致敏 末次致敏 首次激發 末次激發a陰性對照組 / 380.33±35.12 439.91±41.73 552.12±49.94 635.71±43.65低劑量組 90 381.02±20.26 441.80±19.67 547.77±35.09 594.92±7.00高劑量組 180 387.79±16.11 406.87±24.21 441.90±50.15* 438.39±91.32*陽性對照組 10 390.94±14.25 437.67±26.74 540.91±22.90 571.74±27.19組別 劑量/mg·只-1
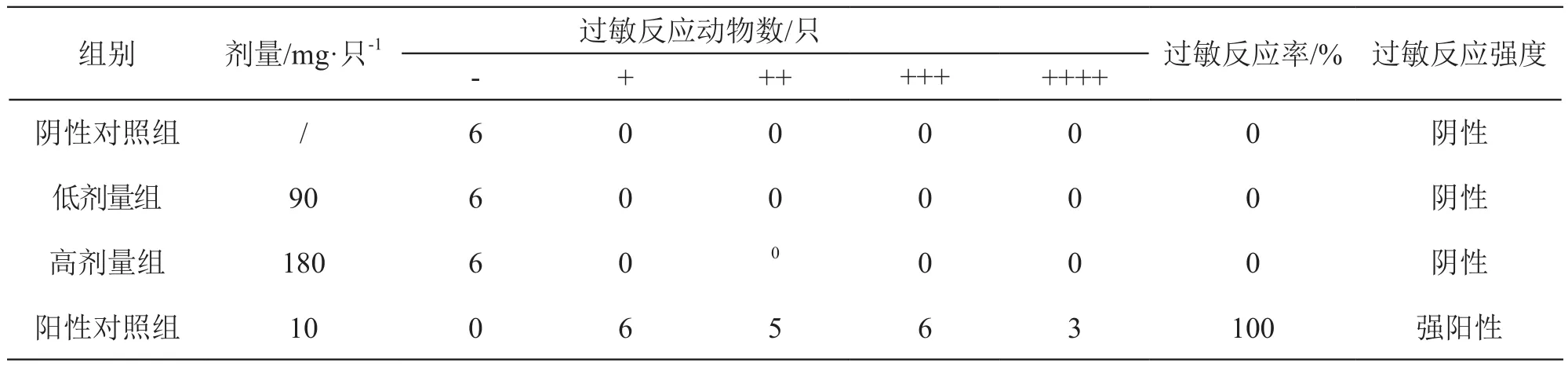
表3 全身過敏試驗觀察結果(n=6)
表4 注射用還原型谷胱甘肽鈉對大鼠體重的影響( ±s)
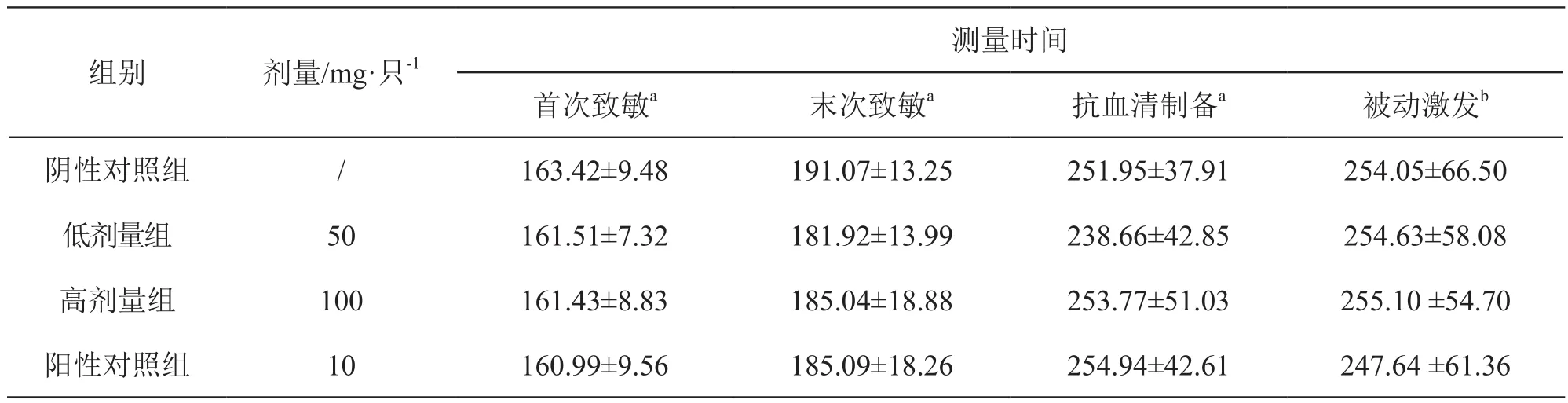
表4 注射用還原型谷胱甘肽鈉對大鼠體重的影響( ±s)
注:a動物數為4只,b動物數為6只
測量時間首次致敏a 末次致敏a 抗血清制備a 被動激發b陰性對照組 / 163.42±9.48 191.07±13.25 251.95±37.91 254.05±66.50低劑量組 50 161.51±7.32 181.92±13.99 238.66±42.85 254.63±58.08高劑量組 100 161.43±8.83 185.04±18.88 253.77±51.03 255.10 ±54.70陽性對照組 10 160.99±9.56 185.09±18.26 254.94±42.61 247.64 ±61.36組別 劑量/mg·只-1

表5 過敏性評價結果
4 討論
過敏反應根據作用機制分為Ⅰ、Ⅱ、Ⅲ、Ⅳ 4類,其中Ⅰ型過敏反應是最常見、研究最多的一類,臨床表現為過敏性休克、胃腸道及皮膚過敏反應等[8]。Ⅰ型過敏反應又稱為速發型過敏反應,當藥物作為抗原初次進入體內會引起免疫應答,產生抗體,致敏肥大細胞,而致敏的肥大細胞再次接觸相同抗原時會釋放組胺等活性介質,引發多種病理性免疫反應[9-10]。
注射用還原型谷胱甘肽導致的過敏反應相對較少,但也有文獻報道過敏反應的發生[6,11],主要表現為皮疹、蕁麻疹、瘙癢等皮膚過敏癥狀,臉上蒼白、血壓下降、脈搏異常等類過敏癥狀,惡心、嘔吐、食欲不振等消化系統癥狀,甚至是過敏性休克等嚴重過敏反應。
本研究結果顯示,在豚鼠ASA試驗末次致敏時,注射用還原型谷胱甘肽鈉高劑量組動物出現不安寧、跳躍等異常反應。為進一步研究這些異常反應是否與藥物過敏反應有關,另取4只健康豚鼠直接靜脈注射高劑量藥物制劑,動物均未見異常,推斷致敏期間出現的異常癥狀非藥物過敏反應引起。但對于這些異常癥狀產生原因是否與藥物毒性(高劑量約為人臨床劑量的11.25倍,低劑量約為人臨床劑量的5.6倍)或給藥方式(動物致敏期間采用腹腔注射,藥物臨床給藥途徑為靜脈注射、肌肉注射)有關需進一步討論研究。激發時,注射用還原型谷胱甘肽鈉低、高劑量動物靜脈快速注射兩倍抗原后未引起全身主動過敏反應癥狀,ASA試驗結果為陰性。在大鼠PCA試驗中,試驗佐劑選擇弗氏完全佐劑,致敏過程中做到與藥物充分混勻至油包水狀態,陽性對照組得到了理想的試驗結果,陽性率達到100 %,試驗結果與文獻[12]報道一致。注射用還原型谷胱甘肽鈉低、高劑量組未見藍斑,結果為陰性。
綜上,由豚鼠主ASA試驗和大鼠PSA試驗結果可知,注射用還原型谷胱甘肽鈉未引起過敏反應,安全性良好,符合注射劑安全性要求。

