聯合中性粒細胞/淋巴細胞比值與纖維蛋白原在分析胃腸道間質瘤預后中的價值
手術和靶向治療是治療胃腸道間質瘤(gastrointestinal stromal tumor,GIST)的主要方法。GIST組織中的自然殺傷(NK)細胞受體亞型可誘導NK細胞產生干擾素γ發揮抗腫瘤作用,免疫炎性反應因素與GIST的發病、進展及預后有關。持續的細胞增殖并伴有炎性細胞浸潤、生長因子表達升高以及DNA損傷,會增加腫瘤發生的風險。高血清中性粒細胞/淋巴細胞比值(NLR) 與多種腫瘤包括腎癌、肺癌、卵巢癌、結腸癌和胃癌、GIST的不良預后有關[1]。 血漿纖維蛋白原(fibrinogen,FIB)可以在血漿中聚集,起到增強細胞炎性因子表達的作用[2]。FIB能刺激腫瘤血管生長,致腫瘤進展,與結直腸癌病人不良預后相關[3-4]。本研究旨在評價術前NLR、FIB對GIST術后預后的影響。
對象與方法
一、對象
2010年1月~2015年12月收治的GIST病人170 例,術前均未行靶向治療并接受根治性手術切除術,相關資料齊全。納入標準:(1)無遠處轉移,且術前未行伊馬替尼(格列衛)等靶向治療;(2)行根治性手術切除。排除標準:(1)無明確手術后病理診斷或術后病理診斷提示為其他組織來源惡性腫瘤;(2)除外伴有免疫性疾病及活動性感染性疾病;(3)隨訪資料不全。
二、方法
1.危險度分級及隨訪:根據術后石蠟病理結果,參照2008年改良版美國國立衛生署(NIH)GIST危險度分級標準將腫瘤進行分級[5]。170例病人中,極低危18例,低危65例,中危37例,高危50例。均以電話、門診復診等方式定期隨訪,術后2年內每3個月隨訪1次,以后每6個月隨訪1次,5年后每年隨訪1次。局部復發或轉移均經多排螺旋CT或核磁、胃腸鏡等至少一項影像學檢查證實。無復發生存時間(recurrence free survival,RFS)定義為自接受根治性手術之日起至出現腫瘤復發或遠處轉移所持續的時間。隨訪截止日期為2016年12月1日,仍然存活并且無腫瘤復發或遠處轉移的影像學證據病人,或者由于非GIST原因導致死亡的病人我們將其定為截尾數據。170例病人中,隨訪期間有24例出現轉移復發,因復發死亡15例,因車禍死亡1例。術后5年RFS率為75%。
2.觀察指標:收集術前最后一次檢測的實驗室結果,包括血常規、凝血指標,即中性粒細胞計數、淋巴細胞計數、FIB,計算中性粒細胞計數與淋巴細胞計數比值(NLR)。血漿FIB正常范圍為2.00~4.00 g/L。
三、統計學分析
采用SPSS 18.0軟件處理數據。采用 ROC曲線評估各指標的預測能力,選取各指標的最佳截點值;各指標間的關系用χ2檢驗、非參數秩和檢驗,相關性分析采用Pearson 相關檢驗;遠期生存采用 Kaplan-Meier 生存分析并使用Log-rank法檢驗做單因素分析,多因素分析采用Cox比例風險模型。P<0.05為差異有統計學意義。
結 果
1.ROC曲線分析:以生存結局(出現轉移或復發)為狀態變量繪制ROC曲線(圖1)選取指標的最佳截點值。本研究中,當 NLR為1.864時,曲線下面積為0.608,靈敏度為83.3%,特異度為39.7%,約登指數最大值0.231,95%可信區間(CI)為0.488~0.729,故以1.864作為NLR指標的最佳截點值;當 FIB為3.24 g/L時,曲線下面積為0.758,靈敏度為0.875,特異度為0.616,約登指數最大值0.491,95% CI為0.666~0.850,故以3.24 g/L作為FIB指標的最佳截點值。
2.術前 NLR 和臨床變量間的關系見表1。結果顯示,高NLR組(NLR≥1.864)109例,低 NLR 組61例。兩組年齡、性別、腫瘤大小、部位、危險度分級間比較,差異有統計學意義(P<0.05),高NLR主要集中在非胃以外的部位、腫瘤直徑在5 cm以上及NIH危險度分級的中高危組病人,提示有這些特征的GIST病人術后預后較差,生存時間相對較短。
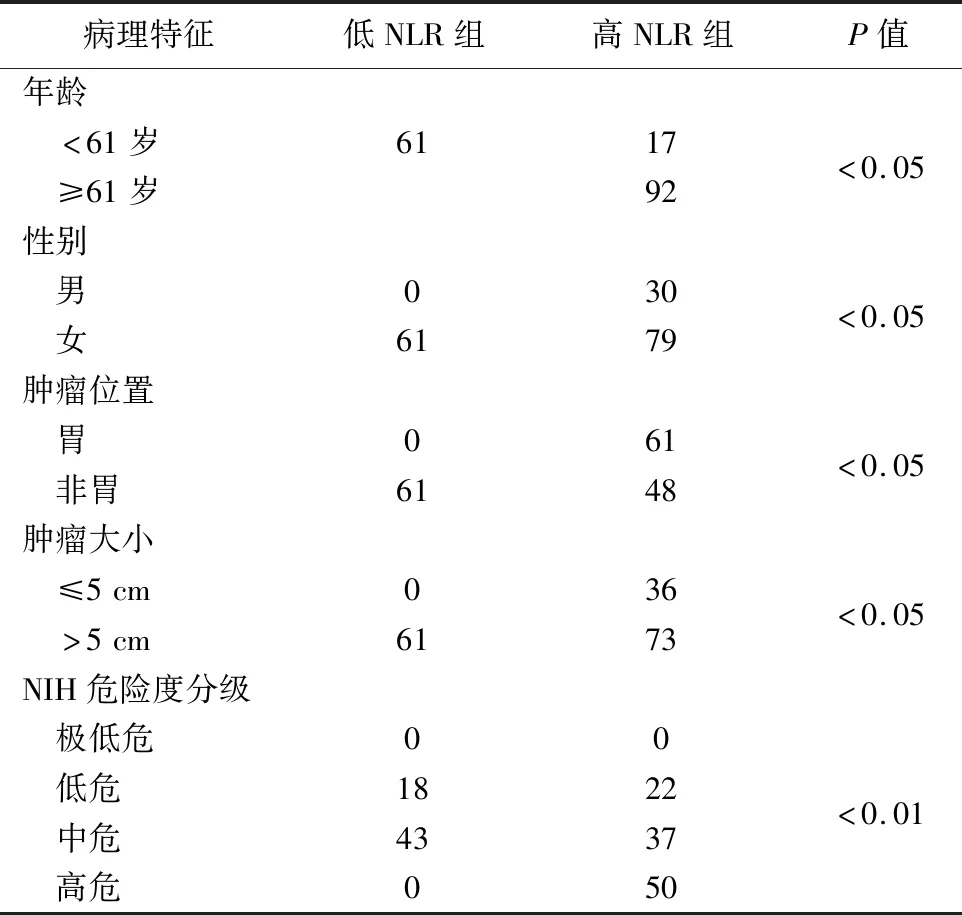
表1 兩組相關臨床病理特征比較(例)
3.術前 FIB 和臨床變量間的關系見表2。結果顯示,高FIB組(FIB≥3.24 g/L)75例,低FIB組95例。兩組年齡、性別、腫瘤大小、部位、危險度分級比較,差異有統計學意義(P<0.05)。GIST發生在非胃部位、直徑≥5 cm、中高危組病人時,其FIB水平傾向于高值,預后較發生在胃部位、直徑<5 cm、危險度分級中的極低與低危組病人差、生存時間短。
4.術前NLR與FIB的相關性分析見表3。結果顯示,NLR 與FIB間存在正相關關系,相關系數為0.665(P<0.05)。
5.術前NLR、FIB與GIST病人預后的關系見圖2。隨訪截止時,170例病人中,有24例病人出現死亡,其中因GIST復發出現死亡15例,因車禍死亡1例。Kaplan-Meier分析和Log-rank檢驗結果表明,高 NLR組5年RFS差于低 NLR組(分別為 62%,90%,P<0.05),高FIB組差于低FIB組(分別為50%,95%,P<0.05)。
聯合NLR與FIB并將其分為4組:組1 NLR<1.864與FIB<3.24 g/L、組2 NLR<1.864與FIB≥3.24 g/L、組3 NLR≥1.864與FIB≥3.24 g/L、組4 NLR≥1.864與FIB<3.24 g/L。上述4組5年RFS率分別為100%、78%、38%和92%(P<0.05),即組3(高FIB、高NLR)的5年RFS率明顯差于組1、組2、組4(圖3)。
將術前血NLR、FIB及腫瘤大小、部位、危險度分級等重要的預后因素通過向前法納入Cox比例風險模型,并以是否服用格列衛等分子靶向治療為基線分層后,篩選影響GIST病人術后預后的危險因素。結果提示,FIB(P<0.05,HR=0.098,95%CI:0.029~0.333)、NIH危險度分級(P<0.05,HR=0.128,95%CI:0.037~0.443)是影響GIST病人術后預后的獨立危險因素,即高FIB組、NIH危險度分級的中高危組術后較低FIB組、NIH危險度分級的極低與低危組出現復發的時間提前(表 4)。
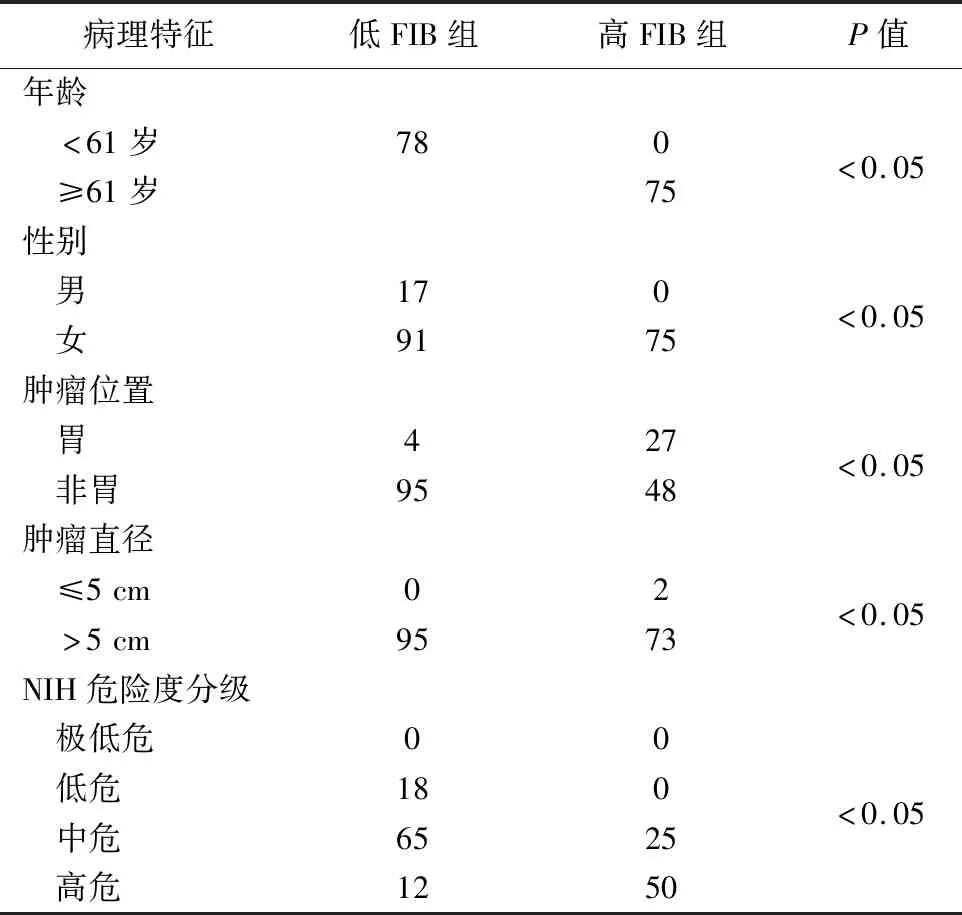
表2 兩組相關臨床病理特征比較(例)
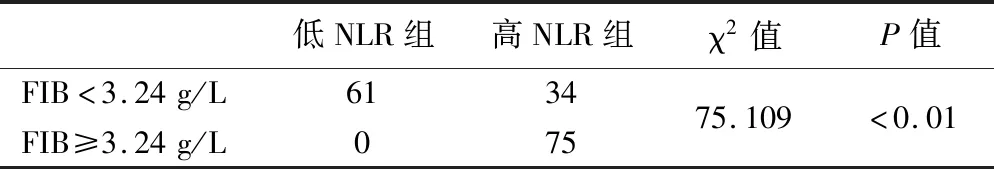
表3 NLR與FIB的相關分析(例)

表4 分層后GIST病人病理資料及預后的多因素分析
注:HRK-Hazard ratio,風險比
討 論
腫瘤相關的炎癥細胞通過釋放炎性介質、細胞因子和酶類物質等,導致血管的通透性發生改變,從而誘發更多的炎癥細胞參與其中,大量釋放出炎性介質,造成氧化損傷、DNA突變及腫瘤微環境的改變,使得這種環境更有利于細胞發生轉化、腫瘤細胞生存和繁殖加速[6]。慢性炎癥在多種惡性腫瘤的發生發展中起著重要的作用,具體表現為外周血細胞水平的特異性改變,主要是中性粒細胞升高和淋巴細胞減少。NLR檢測方便,費用低廉。有研究表明,高NLR的腫瘤病人機體自然殺傷細胞的活性會受到抑制,腫瘤炎癥反應和抗腫瘤炎癥反應之間的平衡被打破,炎癥反應向促使腫瘤生長[7]。本研究發現,NLR較高者GIST病人術后預后比NLR正常者差,提示 NLR 值可作為評估GIST病人術后的預后指標之一。
FIB是血漿中含量最高的凝血因子,是形成血栓的重要分子及反映機體凝血狀態的主要指標[8]。惡性腫瘤病人FIB增高的可能機制是腫瘤細胞進入血液循環,與血管內皮細胞和血小板發生作用,激活血小板或釋放細胞因子,誘導肝細胞合成并釋放FIB;腫瘤的轉移與黏附密切相關,FIB可作為不同黏附分子的配體,在腫瘤轉移中發揮重要作用;腫瘤細胞的生長能夠促使組織產生炎性蛋白質[9]。FIB和炎性介質作用一致,都能夠隨著腫瘤的生長、轉移而合成增多。
本研究將NLR與FIB聯合起來,研究其與GIST病人術后預后間的關系。結果表明,NLR、FIB均與GIST病人的性別、年齡、腫瘤部位、大小、危險度分級之間存在相關關系,且NLR與FIB之間也存在正相關關系,生存分析發現,高NLR、高FIB均與GIST病人術后差的預后有關。將NLR與FIB聯合并分為4組做生存分析,發現高NLR與高FIB組預后差于其他3組,差異有統計學意義。對GIST病人術后預后有影響的變量進行多因素分析發現,FIB、NIH危險度分級是影響GIST術后預后的獨立危險因素,高FIB、高NIH危險度分級組較低FIB、低危險度分級組病人出現復發的時間提前。此結論與文獻報道一致[10]。
NLR與FIB聯合檢測可作為GIST病人術后判斷預后的參考指標之一;對于高NLR與FIB的病人,術后早期給予輔助治療,以期獲得好的預后。進一步追蹤觀察GIST病人在治療過程中NLR、FIB的變化與預后之間關系,有利于深入探討NLR、FIB檢測在腫瘤臨床實際應用中的意義。本研究為一項回顧性研究,存在一些偏倚,研究結果還需更大樣本量的前瞻性研究來進一步驗證。

