林麝化膿病病原菌化膿隱秘桿菌與銅綠假單胞菌互作機制研究
袁陽, 李靜, 張愛雪, 林家富, 褚以文, 王欣榮, 趙克雷
(抗生素研究與再評價四川省重點實驗室,四川抗菌素工業研究所,成都大學,成都610052)
林麝Moschusberezovskii是一種重要的經濟野生動物資源,主要分布在我國西南地區。雄性林麝產生的麝香既是藥用價值較高的中藥材,也是名貴香料的主要原料之一。由于人為捕殺以及棲息地的縮減,林麝被列為國家Ⅰ級重點保護野生動物,林麝人工養殖獲取麝香可以大大緩解市場對麝香不斷增加的需求。我國人工養麝可以追溯到20世紀50年代,但到目前為止仍然沒有形成大規模養殖,其中化膿性疾病是重要制約因素之一(羅燕等,2006;趙克雷等,2011)。
近年研究發現,化膿隱秘桿菌Trueperellapyogenes是導致林麝化膿病的原發病原菌,在林麝化膿性病灶中檢出率達到100%(Zhaoetal.,2011)。化膿隱秘桿菌是一種革蘭氏陽性條件致病菌,可以導致多種反芻動物多器官與組織的化膿性病變。雖然化膿隱秘桿菌是引起林麝化膿性病變的主要病原菌,但是在瀕臨死亡或者已經死亡林麝的化膿性病灶中往往能檢測到大量的銅綠假單胞菌Pseudomonasaeruginosa、大腸桿菌Escherichiacoli等病原菌(趙克雷等,2011;Zhaoetal.,2019a)。研究發現,病原菌之間存在多種物理或化學的交流方式,可以聯合各病原菌種群共同促進疾病的進程,導致治療變得更棘手(Shortetal.,2014;Pragmanetal.,2016;袁陽等,2019)。在林麝化膿病發病過程中,化膿隱秘桿菌作為原發致病菌通常不會直接導致宿主死亡,而機體免疫力下降引起銅綠假單胞菌等強毒致病菌的繼發性感染可能是導致林麝死亡的根本原因(Jost & Billington,2005;Zhaoetal.,2011,2013)。
與其他常見病原菌相比,銅綠假單胞菌具有相對較大的基因組和較多的基因,以靈活多變的胞內調控網絡適應多種生存條件,同時還具有復雜而龐大的群體感應(quorum-sensing,QS)網絡調控系統,在營養獲取、毒力發揮和種間競爭中發揮著關鍵作用(Stoveretal.,2000;Balasubramanianetal.,2013;Valentinietal.,2018;Zhaoetal.,2018,2019a)。銅綠假單胞菌的QS系統由3個層級排列的次級調控系統(las、rhl和pqs)組成,其中las系統處于頂端調控位置(Dandekar & Greenberg,2013)。las和rhl系統具有完整的信號分子合成蛋白(LasI/RhlI)和調控蛋白(LasR/RhlR),屬于自誘導調控系統,且rhl系統的表達激活主要受las系統調控。pqs系統則只具有調控蛋白PqsR(MvfR),其表達激活需要接收其他路徑(LasR和RhlR相關)產生的信號分子Pseudomonasquinolone signal(PQS),進而調控部分受LasR和RhlR控制的基因的表達,屬于外源誘導調控系統(Choietal.,2011;Balasubramanianetal.,2013;Dandekar & Greenberg,2013)。Zhao等(2017)研究發現,銅綠假單胞菌的QS信號分子可以抑制化膿隱秘桿菌的生長,而Huang等(2018)進一步研究證實了該過程同樣發生在體內感染。這些研究結果暗示,林麝化膿病病灶中出現的優勢菌替換現象可能與銅綠假單胞菌利用QS系統抑制化膿隱秘桿菌的生長有關。本研究通過構建銅綠假單胞菌多種QS突變菌株,利用平板互作模型詳細研究了化膿隱秘桿菌與銅綠假單胞菌的種間關系,可為林麝化膿病的診治方案和抗菌藥物開發、改進提供參考。
1 材料
1.1 菌株來源
野生型銅綠假單胞菌模式菌株PAO1(Zhaoetal.,2018)、rhlR基因敲除菌株PAO1-ΔrhlR(Zhaoetal.,2019b)和pqsR基因敲除菌株PAO1-ΔpqsR(Jacobsetal.,2003)為實驗室保存。化膿隱秘桿菌TP13早期分離自林麝肺臟膿液(Zhaoetal.,2013)。
1.2 培養基
LB肉湯培養基、LB營養瓊脂培養基、金氏B培養基(Zhaoetal.,2019b)。
1.3 主要試劑和儀器
慶大霉素、磷酸鹽緩沖液(PBS)、PCR(Bio-Rad)、瓊脂糖凝膠電泳儀(Bio-Rad)、UV5500PC型紫外可見分光光度計(上海元析儀器有限公司)。
2 方法
2.1 銅綠假單胞菌群體感應基因敲除菌株構建
參照課題組前期已建立的銅綠假單胞菌基因敲除方法(Zhaoetal.,2019b),利用基因同源重組和轉化接合對野生型銅綠假單胞菌PAO1、PAO1-ΔrhlR、PAO1-ΔpqsR菌株進行lasR基因敲除,獲得PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔlasRpqsR菌株。所用引物如表1所示。
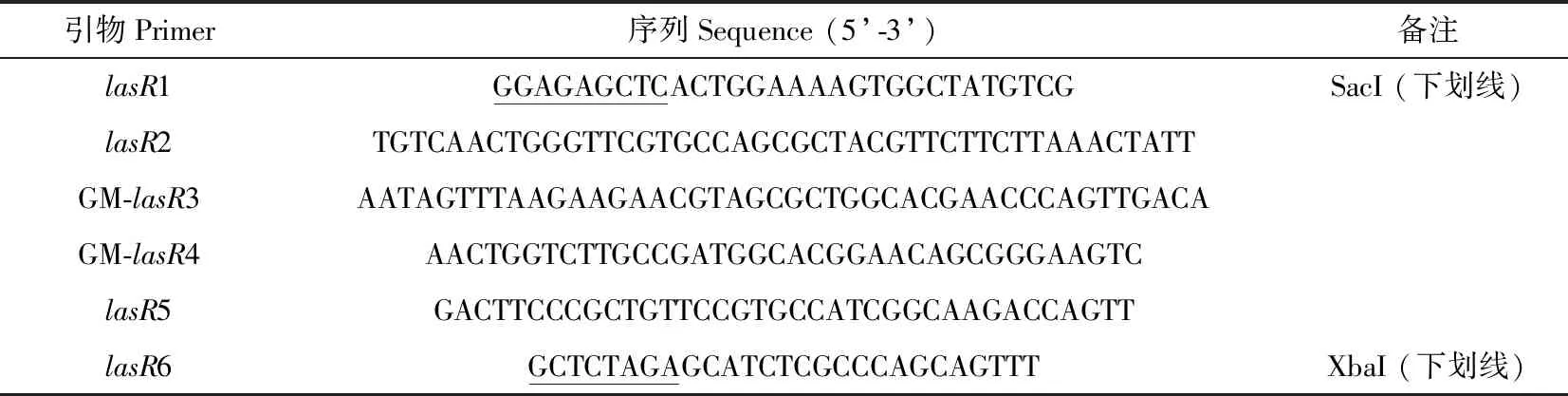
表1 基因敲除所使用的引物Table 1 Primers used for gene knock-out
以PAO1基因組DNA為模板,用引物lasR1/lasR2、lasR5/lasR6分別擴增出前同源臂(496 bp)與后同源臂(577 bp);以實驗室保存的pRU1103質粒為模板,用引物GM-lasR3/GM-lasR4擴增出慶大霉素抗性基因元件(917 bp)。這3個片段通過Overlap PCR連接成一條1 990 bp片段,目的是用慶大霉素抗性基因去替換lasR基因的564 bp片段。利用限制性內切酶SacI-XbaI雙酶切Overlap PCR產物以及質粒pCVD442構建pCVD442-KOlasR重組質粒。將該重組質粒轉入E.coliS17中,隨后將帶有pCVD442-KOlasR的E.coliS17與PAO1、PAO1-ΔrhlR、PAO1-ΔpqsR進行轉化接合,使E.coliS17中的pCVD442-KOlasR重組質粒進入受體菌中。利用含有15 μg·mL-1慶大霉素的金氏B平板篩選陽性克隆(銅綠假單胞菌在金氏B培養基上會顯示出明顯的熒光綠);擴大培養陽性克隆,提取基因組DNA后用引物lasR1/lasR6進行PCR擴增,以PAO1基因組作為陰性對照,擴增結果送成都擎科梓熙生物技術有限公司測序驗證。
2.2 病原菌平板距離培養實驗
挑取化膿隱秘桿菌、PAO1、PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔrhlR、PAO1-ΔpqsR、PAO1-ΔlasRpqsR單克隆于5 mL LB肉湯培養基中,37 ℃,220 r·min-112~16 h,化膿隱秘桿菌由于生長較慢,培養24 h。1 2000 r·min-15 min后收集菌體,并用PBS沖洗菌體3次。然后用PBS調節菌液OD600=1作為母液備用。
參照課題組前期已建立的多病原菌平板互作研究方法(Zhaoetal.,2018),將不同基因型銅綠假單胞菌菌株和化膿隱秘桿菌成對接種于LB平板,同種菌株間距1 cm,不同菌株的間距依次增加(初始間距為0.5 cm,依次增加0.5 cm),每個平板上設置6個梯度,每個點的接菌量均為2 μL母液,將平板置于37 ℃培養1~4 d,每個實驗設置3個獨立重復。每隔1 d,使用無菌竹鏟挖出化膿隱秘桿菌與 PAO1、PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔrhlR、PAO1-ΔpqsR、PAO1-ΔlasRpqsR平板互作的近距離培養和遠距離培養的菌落至1 mL PBS中,用移液器反復吹打菌體進行充分分散、沖洗后,用紫外分光光度計在波長600 nm下測量光密度。
2.3 基于胞外產物作用的平板互作實驗
為進一步確認PAO1、PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔrhlR、PAO1-ΔpqsR、PAO1-ΔlasRpqsR的胞外產物對化膿隱秘桿菌的抑制作用,基于上述平板距離培養實驗方法,先在LB平板的左側分別只接種PAO1、PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔrhlR、PAO1-ΔpqsR或PAO1-ΔlasRpqsR,培養2 d后移除菌落,然后在右側依次接種化膿隱秘桿菌(與左側原接種銅綠假單胞菌菌落標記初始間距為0.5 cm,依次增加0.5 cm)。
3 結果
3.1 基因敲除菌株的獲得
以野生型銅綠假單胞菌PAO1基因組DNA為模板,分別擴增出橫跨lasR基因上游496 bp序列(前同源臂)與下游577 bp序列(后同源臂),并以pRU1103質粒為模板擴增出慶大霉素抗性基因元件(917 bp),膠回收后用Overlap PCR進行片段連接與擴增。瓊脂糖凝膠電泳結果顯示,3條片段連接后的產物大小為1 990 bp,符合預期(圖1:A),并且DNA測序結果無誤。將片段用lasR1/lasR6引物進行富集擴增,膠回收產物經雙酶切后連接穿梭質粒pCVD442,轉化E.coliS17感受態后于慶大霉素抗性平板篩選獲得多個陽性菌株,提取質粒后驗證插入片段測序無誤,獲得E.coliS17 pCVD442-KOlasR重組菌株。以E.coliS17 pCVD442-KOlasR為供體菌,以PAO1、PAO1-ΔrhlR、PAO1-ΔpqsR為受體菌進行轉化接合實驗后,于慶大霉素抗性的金氏B平板篩選獲得多個產熒光綠的陽性克隆;以野生型銅綠假單胞菌PAO1為對照,用lasR1/lasR6引物進行擴增,如未敲除,則電泳條帶大小為1 637 bp,如lasR基因已被慶大霉素抗性基因元件替換,則擴增后電泳條帶大小為1 990 bp(圖1:B)。挑選1 990 bp條帶對應的菌株用lasR1/lasR6引物測序驗證,并對菌株進行16S rDNA擴增測序后鑒定物種,最終獲得PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔlasRpqsR突變菌株。
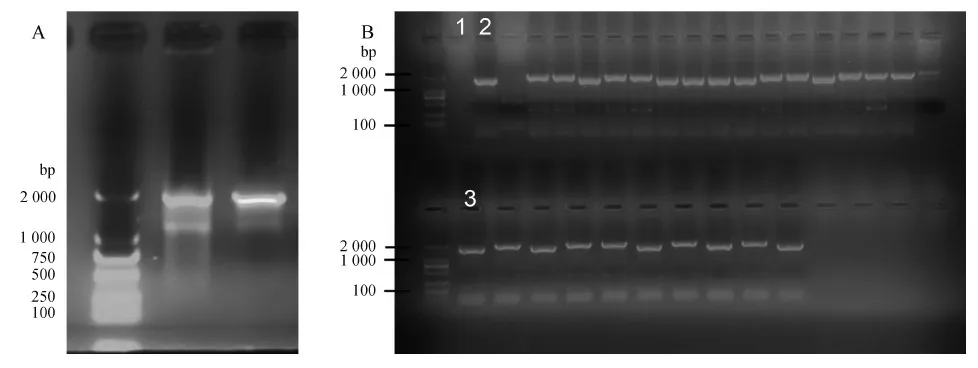
圖1 不同銅綠假單胞菌菌株lasR基因的敲除Fig. 1 Knock-out of lasR gene from different Pseudomonas aeruginosa strains
A. 前、后同源臂和慶大霉素抗性元件經Overlap PCR拼接后的產物; B.lasR基因敲除菌株的篩選; 分子量標記: DL2000, 1. 空白對照,2、3. 野生型對照
A. Ligation of the upstream and downstream fragments and gentamycin resistance cassette by Overlap PCR; B. Selection oflasRmutant strains; Marker: DL2000, Lane 1. blank, Lanes 2 and 3. wild-type control
3.2 銅綠假單胞菌QS突變菌株與化膿隱秘桿菌的種間互作
銅綠假單胞菌菌落近端的化膿隱秘桿菌菌落均不同程度地小于遠端的菌落,而銅綠假單胞菌的生長則沒有顯著變化(圖2)。不同的銅綠假單胞菌QS突變菌株均對化膿隱秘桿菌的生長表現出一定的抑制作用,且抑制效果隨著培養時間的延長而更明顯(圖3)。
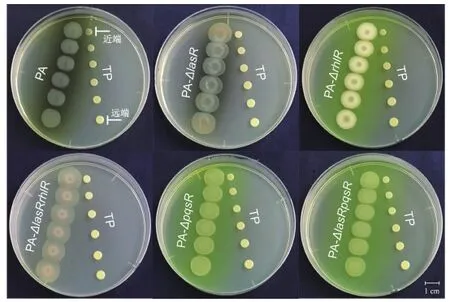
圖2 不同基因型的銅綠假單胞菌與化膿隱秘桿菌平板互作表型實驗Fig.2 Proximity assay of different genotypes of Pseudomonas aeruginosa (PA) with Trueperella pyogenes (TP)
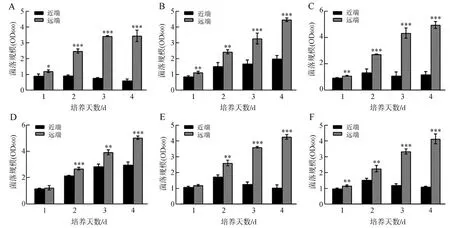
圖3 平板互作表型實驗中化膿隱秘桿菌的菌落規模Fig.3 Colony sizes of Trueperella pyogenes in the proximity assay
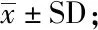
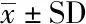
對上述平板互作中近端化膿隱秘桿菌的菌落規模進行橫向比較發現,不同銅綠假單胞菌群體突變菌株對鄰近化膿隱秘桿菌的生長有不同程度的抑制作用,尤其從第2天開始,各突變菌株對化膿隱秘桿菌的抑制效果均弱于野生型銅綠假單胞菌菌株。與野生型菌株相比,只有將銅綠假單胞菌QS調控系統中的lasR和rhlR基因同時敲除后,化膿隱秘桿菌的菌落才有較大程度回升(圖4)。

圖4 不同銅綠假單胞菌群體感應突變菌株對近端化膿隱秘桿菌的抑制作用對比Fig.4 Comparison of the inhibitory effect of different Pseudomonas aeruginosa (PA) strains on the growth of proximal Trueperella pyogenes colonies
3.3 銅綠假單胞菌胞外產物對化膿隱秘桿菌的生長抑制
將銅綠假單胞菌不同突變菌株分別成排接種于平板培養2 d后,將菌落完整挖去,然后將化膿隱秘桿菌按距離接種于銅綠假單胞菌分泌到培養基內的胞外產物上,繼續培養1 d。結果發現,銅綠假單胞菌不同QS系統突變菌株的胞外產物對化膿隱秘桿菌的生長具有不同程度的抑制作用,以野生型菌株PAO1和lasR-pqsR雙突變菌株的抑制效果最明顯,而lasR-rhlR雙突變菌株的胞外產物對化膿隱秘桿菌的抑制效果最弱(圖5)。
4 討論
近年來研究發現較多的慢性感染都是由多種病原微生物共同定殖引起,這些病原菌通過復雜的種間相互作用共同抵御宿主免疫和抗生素的清除作用。因此,探索病原菌之間的相互作用對疾病的診斷和治療具有重要意義(Littleetal.,2008;Petersetal.,2012;Orazi & O’Toole,2019)。化膿隱秘桿菌是林麝化膿病的主要誘發菌,也是初期感染病灶中的優勢菌。隨著感染的持續惡化,林麝膿腫病灶中能夠檢測到大量銅綠假單胞菌(趙克雷等,2011)。銅綠假單胞菌是一種具有較強致病能力的條件病原菌,這很大程度上歸因于其具有一套由3個層級排列的las、rhl和pqs調控系統組成的QS系統。這3個系統共同控制著絕大多數胞外物質的產生,也賦予了銅綠假單胞菌對其他細菌的競爭優勢(Schusteretal.,2003;Choietal.,2011;Balasubramanianetal.,2013;Guoetal.,2014;袁陽等,2019;Zhaoetal.,2019a)。本研究就林麝化膿病發病過程中出現的化膿隱秘桿菌與銅綠假單胞菌的優勢菌替換現象,圍繞銅綠假單胞菌的QS系統在這2種菌之間的種間互作展開研究。
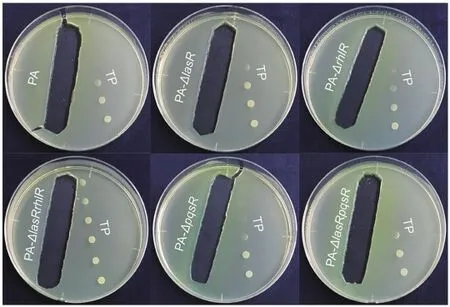
圖5 不同銅綠假單胞菌群體感應突變菌株胞外產物對化膿隱秘桿菌的生長抑制作用Fig.5 Inhibitory effects of the extracellular products of different Pseudomonas aeruginosa (PA) strains on the growth of Trueperella pyogenes (TP) colonies
利用平板距離培養實驗發現,靠近PAO1、PAO1-ΔlasR、PAO1-ΔlasRrhlR、PAO1-ΔrhlR、PAO1-ΔpqsR、PAO1-ΔlasRpqsR生長的化膿隱秘桿菌均被抑制,而lasR-rhlR雙敲除菌株對化膿隱秘桿菌的抑制作用明顯減弱。這些發現與其他研究發現的銅綠假單胞菌las-和rhl-QS系統產生的2種高絲氨酸類酯3-oxo-C12-HSL和C4-HSL信號分子均能抑制化膿隱秘桿菌的生長結果相一致(Zhaoetal.,2013;Huangetal.,2018)。從平板互作表型來看,雖然某些基因缺陷型銅綠假單胞菌脅迫下的近端化膿隱秘桿菌菌落大小只略小于遠端,但肉眼無法確定菌落厚度、密度等信息,尤其是某些革蘭氏陽性菌(如金黃色葡萄球菌Staphylococcusaureus)會通過產生小菌落變異體、提高生物膜產量等來應對銅綠假單胞菌的脅迫(Biswasetal.,2009)。本研究中光密度精確測定結果與表型的差異反映出同為革蘭氏陽性菌的化膿隱秘桿菌可能也存在類似的壓力反應機制。其他研究發現,銅綠假單胞菌QS系統產生的其他毒力因子如彈性蛋白酶、鼠李糖脂、PQS、綠膿菌素等對大腸桿菌、金黃色葡萄球菌的生長代謝均有抑制作用,這些毒力因子的表達激活受las-、rhl-和pqs-QS系統共同調控,可通過抑制附近其他病原菌的有氧呼吸和膜系統合成使銅綠假單胞菌獲得顯著的競爭優勢(Baronetal.,1989;Guoetal.,2014;Khare & Tavazoie,2015;Hotterbeekxetal.,2017;Tognonetal.,2019)。這也為本研究中發現的銅綠假單胞菌不同QS系統缺陷菌株均能對化膿隱秘桿菌表現出不同的抑制作用提供了解釋。這些結果提示針對銅綠假單胞菌QS系統信號分子進行結構類似物篩選,獲得可以同時抑制銅綠假單胞菌QS系統和抑制化膿隱秘桿菌生長的小分子藥物,可能是攻克林麝化膿病的新策略和新方向。

