GnIH通過p38MAPK信號通路對豬卵巢顆粒細胞自噬與凋亡的影響
張鑫,霍孔林,宋星星,張多妮,胡文,胡傳活,李珣
GnIH通過p38MAPK信號通路對豬卵巢顆粒細胞自噬與凋亡的影響
張鑫,霍孔林,宋星星,張多妮,胡文,胡傳活,李珣
(廣西大學動物科學技術(shù)學院,南寧 530004)
【】細胞自噬和凋亡存在著相互制約,p38MAPK信號通路作為細胞凋亡的主要調(diào)控通路之一,也對細胞自噬存在促進和抑制的雙重作用。已有研究表明,促性腺激素抑制激素(gonadotropin-inhibitory hormone , GnIH)對細胞自噬與凋亡均有影響,但作用機制尚不明確。故探究GnIH通過p38MAPK信號通路對豬卵巢顆粒細胞(pGCs)自噬與凋亡的影響及其機理,為解決母豬的產(chǎn)子率以及同期發(fā)情等問題提供參考。從豬卵巢中提取卵巢顆粒細胞,進行體外培養(yǎng)。1、探究GnIH對p38MAPK信號通路的最佳作用時間:按孵育GnIH時間梯度(0 min、10 min、30 min、60 min、90 min)分組,用Western blot檢測豬卵巢顆粒細胞p38與p-p38的蛋白表達量變化;2、驗證GnIH對p38MAPK信號通路的影響:按(空白對照、GnIH、p38激活劑(U-46619)、U-46619+GnIH)分組,用Western blot檢測p38與p-p38的蛋白表達量變化;3、探究不同濃度GnIH對自噬和凋亡的影響:按(空白對照、10-6mol·L-1GnIH、10-8mol·L-1GnIH、10-10mol·L-1GnIH、10-12mol·L-1GnIH)分組,用Western blot檢測自噬與凋亡標志性蛋白的表達量變化;4、驗證不同濃度GnIH通過p38信號通路對自噬和凋亡的影響:將細胞分成6組(空白對照、U-46619、U-46619+10-6mol·L-1GnIH、U-46619+10-8mol·L-1GnIH、U-46619+10-10mol·L-1GnIH、U-46619+10-12mol·L-1GnIH),用Western blot檢測自噬與凋亡標志性蛋白的表達量變化。1. GnIH孵育10 min后,顯著降低p38與p-p38的蛋白表達量(<0.05),提示,GnIH對p38MAPK信號通路的最佳作用時間為10 min;2. U-46619顯著促進pGCs的p38磷酸化水平(<0.05),GnIH顯著抑制pGCs的p38磷酸化水平(<0.05),提示,U-46619使p38MAPK信號通路活化,GnIH對p38MAPK信號通路的活化有抑制作用;3. 當 GnIH的濃度為10-6mol·L-1時,pGCs的自噬和凋亡水平顯著升高(<0.05),隨著GnIH濃度的降低,pGCs的自噬水平逐漸升高(<0.05),pGCs的凋亡水平逐漸降低(<0.05),提示,高濃度GnIH可以促進自噬和凋亡,隨著GnIH濃度的降低,自噬水平逐漸升高,而凋亡水平逐漸下降;4. 加入U-46619后,GnIH使pGCs的自噬顯著上調(diào)(<0.05),并且使pGCs的凋亡顯著下調(diào)(<0.05),提示,不同濃度GnIH通過p38MAPK信號通路影響pGCs的自噬和凋亡。GnIH可能通過抑制p38MAPK信號通路的活化,上調(diào)pGCs的自噬,減少pGCs的凋亡。
自噬;凋亡;GnIH;p38MAPK;豬;卵巢顆粒細胞
0 引言
【研究意義】卵巢閉鎖是哺乳動物卵巢中普遍存在的現(xiàn)象[1]。卵巢閉鎖對母豬的產(chǎn)子率有影響。促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)作為一種由下丘腦釋放的性腺激素,我們猜測,對卵巢細胞活性有著一定的調(diào)控作用。為此,本試驗可以為解決母豬的產(chǎn)子率以及同期發(fā)情[2]等問題提供參考。【前人研究進展】GnIH是Tsutsui等于2000年從鵪鶉的下丘腦中分離的一種C末端具有RF酰胺結(jié)構(gòu)的12肽[3]。后續(xù)研究發(fā)現(xiàn)哺乳動物中存在GnIH類似物-RF酰胺相關(guān)肽(RFRP),RFRP 基因主要編碼兩條有生物活性的短肽,分別為RFRP-1、RFRP-3,然而在大多數(shù)哺乳動物生殖系統(tǒng)中發(fā)揮主要作用的是RFRP-3[4],也是目前研究較為廣泛的[5-7]。人類和其他物種的研究數(shù)據(jù)表明,RFRP-3可能參與病理變化,是影響排卵、卵泡發(fā)育和卵巢分泌類固醇的因素[8-9]。GnIH可以通過對下丘腦GnRH和垂體前葉的作用抑制促性腺激素釋放[10]。GnIH在生殖調(diào)控中具有重要作用,在其他脊椎動物中也具有類似的作用[11]。細胞的活性決定各項生理機能,由此凋亡作為第一個細胞程序性死亡被認知[12],并成為哺乳動物組織細胞死亡的主要機制。但近來研究發(fā)現(xiàn)凋亡并不能單獨對細胞死亡起決定性作用,由此自噬被發(fā)現(xiàn)[13],并探究出自噬與凋亡存在促進與抑制的雙重作用。已有研究證明,腫瘤細胞中自噬可以使凋亡率下降[14]。自噬與凋亡也可以共同導(dǎo)致細胞死亡,當自噬或凋亡受到抑制,另外一種則會轉(zhuǎn)變成細胞的死亡途徑[15-16]。當自噬體積累到一定水平,則會對細胞的凋亡產(chǎn)生影響。卵母細胞質(zhì)量是由卵泡閉鎖這一正常的生理過程決定的,而細胞的自噬與凋亡可能參與調(diào)節(jié)卵泡閉鎖[17]。研究表明,卵泡的發(fā)育和顆粒細胞的凋亡過程中都存在著細胞自噬[18],因此自噬可能參與顆粒細胞的凋亡;大鼠顆粒細胞的自噬可能與卵泡發(fā)育有關(guān)[19],Choi在研究自噬與卵泡閉鎖的關(guān)系中發(fā)現(xiàn),在卵泡的發(fā)育過程中,自噬主要集中在卵巢顆粒細胞,并且與細胞的凋亡存在著相關(guān)性[20]。在卵泡閉鎖的初期,顆粒細胞中有Beclin-1的表達,而Caspase-3則是分布在卵泡中;在中期,卵巢顆粒細胞中Beclin-1和Caspase-3均有表達;而在晚期,顆粒細胞中Caspase-3的表達水平較高[19]。LC3在大鼠卵泡顆粒細胞中表達量最高, 也表明自噬主要發(fā)生在顆粒細胞中, 而自噬導(dǎo)致的顆粒細胞死亡可能參與卵泡閉鎖[21]。p38MAPK信號通路是細胞調(diào)節(jié)的主要信號通路之一[22],MAPK信號通路可能參與調(diào)節(jié)GCs的凋亡[23]。GnIH參與調(diào)節(jié)小鼠卵巢的發(fā)育及功能[24-25]。目前已證實,GnIH對母豬生殖有一定的調(diào)控作用[26]。MADDINENI于2008年發(fā)現(xiàn)GnIH能減少雞卵巢顆粒細胞的活化,但是這種抑制作用能被外源FSH中和[27-28]。在睪丸細胞中,GnIH與GnIH-R均有表達[29],表明GnIH可能參與生殖細胞的分化。給成熟鵪鶉連續(xù)14 d注射GnIH,發(fā)現(xiàn)睪丸中精原細胞活性降低,并誘導(dǎo)細胞凋亡[30],提示GnIH可能通過誘導(dǎo)細胞凋亡從而調(diào)節(jié)性腺的發(fā)育。研究表明,GnIH對小鼠附睪組織細胞的凋亡和自噬有影響[31]。【本研究切入點】雖然目前已有關(guān)于GnIH在卵巢水平的相關(guān)研究。但是GnIH處理的pGCs通過p38MAPK信號通路對細胞凋亡與自噬的調(diào)控還未見報道。因此,我們提出猜測,GnIH可能通過p38MAPK信號通路對細胞凋亡與自噬產(chǎn)生影響。【擬解決的關(guān)鍵問題】首先探究了GnIH是否對p38MAPK信號通路的活化產(chǎn)生影響;進一步探究了GnIH是否對卵巢顆粒細胞的自噬和凋亡有影響;最后探究了GnIH是否是通過p38MAPK信號通路對自噬和凋亡產(chǎn)生的影響。
1 材料與方法
1.1 材料和試劑
本試驗于2018年3—10月在廣西大學解剖組培實驗室完成。
DMEM/F12培養(yǎng)基、澳洲來源胎牛血清購自南京維森特生物技術(shù)有限公司。臺盼藍染液購自Gibco。其他試劑均為國產(chǎn)分析純。Western細胞裂解液、超敏ECL化學發(fā)光試劑盒、BCA蛋白定量試劑盒購于上海碧云天生物技術(shù)有限公司,一抗GAPDH、p38、p-p38、Bcl-2、Caspase3、Bax、Beclin-1、LC3、Atg5和Atg12濃度均為1﹕2 000,二抗羊抗鼠、羊抗兔濃度為1﹕20 000均購自CST公司。GnIH由實驗室于NCBI查找相關(guān)氨基酸序列,送至公司合成。
1.2 豬卵巢的采集
從廣西本地屠宰場當天取回卵巢,將卵巢放置在含有兩性霉素(青霉素/鏈霉素(1%))的生理鹽水中(37℃),2 h內(nèi)運輸回廣西大學解剖組培實驗室。用生理鹽水沖洗備用。
1.3 豬卵巢顆粒細胞的體外培養(yǎng)
pGCs分離培養(yǎng)方法參考相關(guān)研究[32-33]進行。于37℃、5%CO2及飽和濕度的培養(yǎng)箱中進行成熟培養(yǎng),培養(yǎng)48 h后,加入p38MAPK激活劑U-46619和不同濃度的GnIH(購自康肽生物(北京)科技有限公司),培養(yǎng)1 h后,收取細胞,每組試驗平行3次重復(fù)。
1.4 豬卵巢顆粒細胞蛋白的提取
棄去細胞瓶中培養(yǎng)液,加入PBS,洗2—3次,棄洗液;加入混有1%PMSF的細胞裂解液,靜置30 min,每隔10 min輕輕晃動細胞瓶;裂解后,將細胞瓶內(nèi)裂解液移入1.5 mL預(yù)冷的EP管,4℃、12 000 r/min離心5 min;BCA測濃度,分裝,-80℃保存。
1.5 Western blot檢測
12%SDS-PAGE凝膠電泳,半干法轉(zhuǎn)印至PVDF膜上,放入5%脫脂牛奶,室溫封閉1—2 h,一抗p38、p-p38、Bcl-2、Caspase3、Bax、Beclin-1、LC3、Atg5和Atg12以及GAPDH,4℃過夜,二抗孵育1 h,每步完成后,PBST洗滌3次,每次15 min。ECL化學發(fā)光液顯色,暗室曝光,掃描灰度值。試驗重復(fù)3次,用 ImageJ進行灰度值分析,其中GAPDH作為標準化的內(nèi)部對照。
1.6 數(shù)據(jù)分析
所有數(shù)據(jù)均顯示為平均數(shù)±標準誤(Mean±SE)。使用SPSS 21.0統(tǒng)計軟件進行單因素方差分析,LSD檢驗各組之間的統(tǒng)計學顯著性。檢驗結(jié)果以*<0.05為差異顯著,**<0.01為差異極顯著。
2 結(jié)果
2.1 GnIH對豬卵巢顆粒細胞p38MAPK信號通路的最佳作用時間
在GnIH梯度時間(0、10、30、60、90 min)孵育pGCs后,采用Western blot檢測p38及p-p38的表達變化,檢測灰度值。結(jié)果提示10 min與其他試驗組比較,p38及p-p38顯著降低(<0.05)(圖1)。
2.2 GnIH對p38MAPK信號通路的影響
Western blot檢測(空白、GnIH、p38激活劑、p38激活劑+GnIH)p38及p-p38的表達變化,檢測灰度值。GnIH組與空白組比較,p38及p-p38的比值顯著降低(<0.05);p38激活劑組與空白組比較,p38及p-p38的比值顯著升高(<0.05);p38激活劑+GnIH組與p38激活劑比較,p38及p-p38的比值顯著降低(<0.05,圖2)。
2.3 不同濃度GnIH對豬卵巢顆粒細胞自噬和凋亡的影響
GnIH濃度梯度(0、10-6、10-8、10-10、10-12)處理pGCs,Western blot檢測Caspase-3、Bax和Bcl-2,灰度值分析。caspase-3、Bcl-2、Bax和GAPDH的免疫印跡在大約32、26、21和37 kD。試驗組與對照組相比均有顯著性差異(<0.05),結(jié)果提示,低劑量組Bcl-2的表達極顯著升高(<0.01),caspase-3與Bax的表達極顯著降低(<0.01,圖3)。
Western blot測定Beclin-1、Atg12和Atg5,灰度值分析。Beclin-1、Atg5和Atg12的免疫印跡分別位于60、55和53 kD。結(jié)果提示,低劑量組Beclin-1、Atg12和Atg5的表達極顯著升高(<0.01,圖4)。
2.4 不同濃度GnIH通過p38MAPK信號通路對豬卵巢顆粒細胞自噬和凋亡的影響
p38激活劑孵育pGCs后,GnIH濃度梯度(0、10-6、10-8、10-10、10-12)處理pGCs,Western blot檢測Caspase-3、Bax和Bcl-2,灰度值分析。結(jié)果提示,P38激活劑組與空白對照相比,存在顯著性差異(<0.05);經(jīng)不同劑量GnIH處理后的試驗組與p38激活劑組比,低劑量組Bcl-2的表達極顯著升高(<0.01);caspase-3與Bax的表達極顯著降低(<0.01,圖5)。
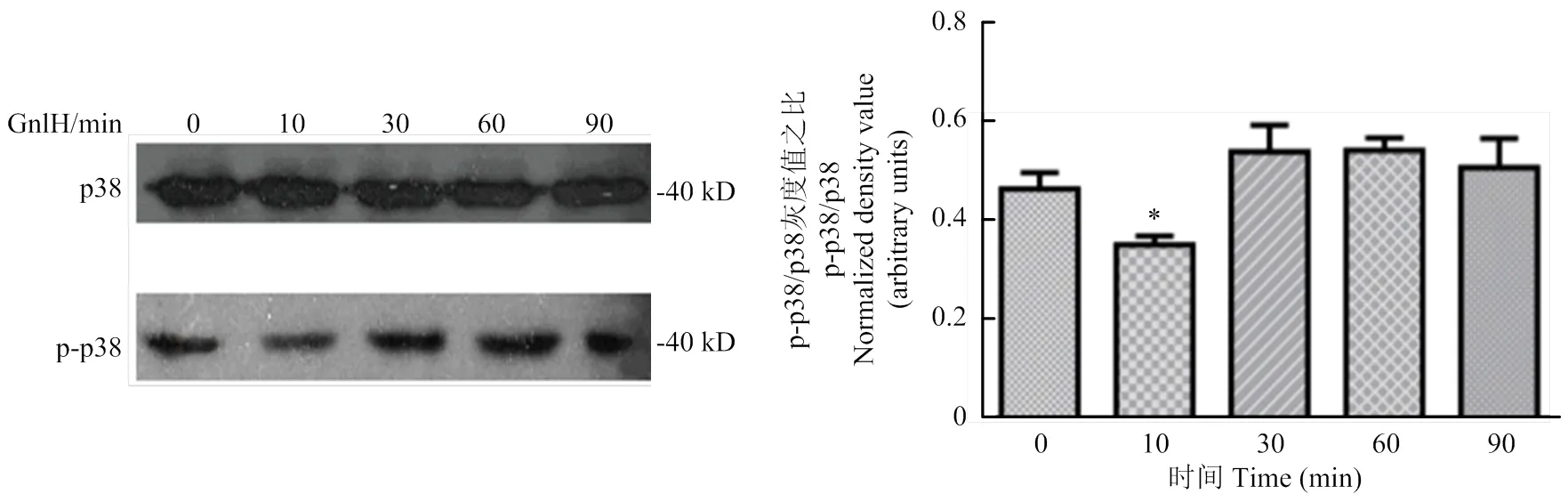
用ImageJ進行灰度值分析。數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
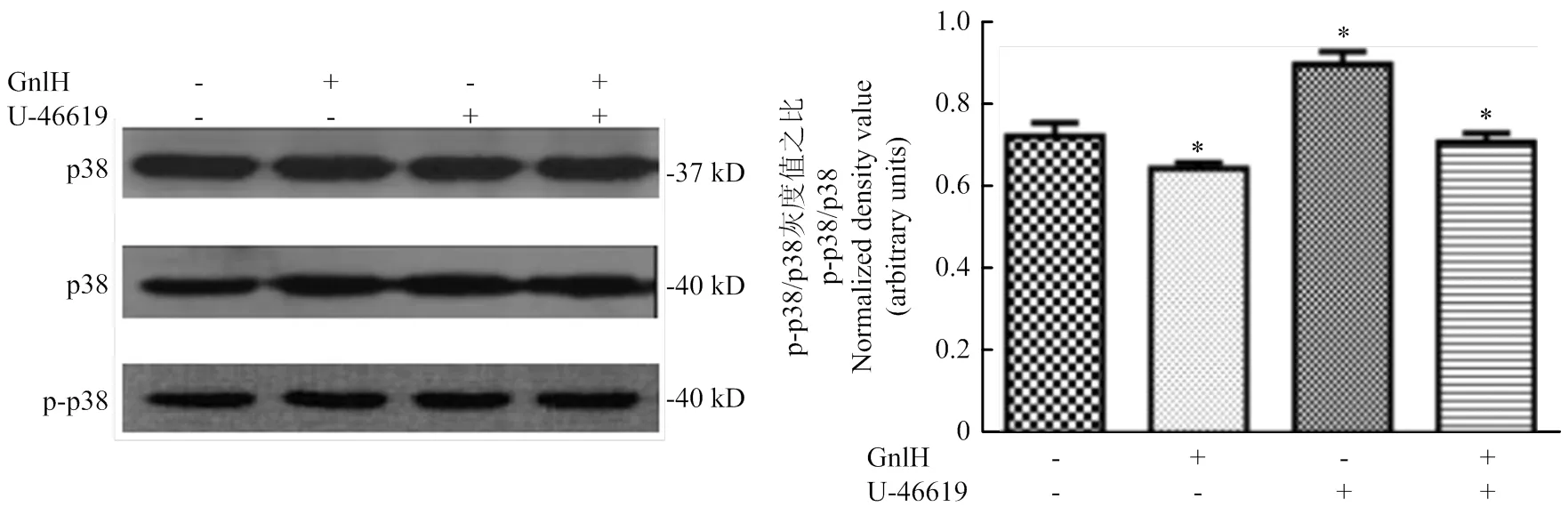
用ImageJ進行灰度值分析。數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
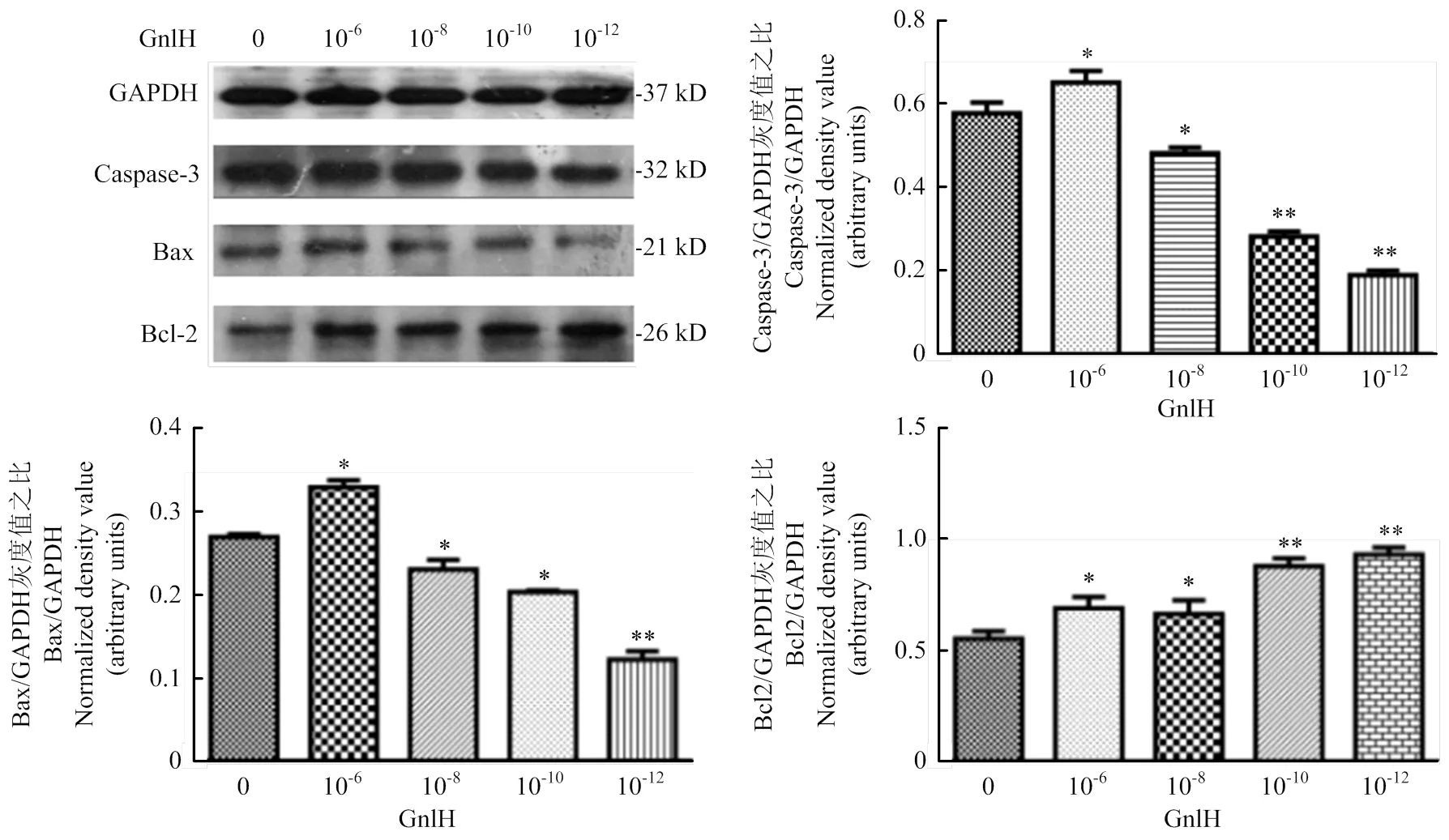
用ImageJ進行灰度值分析。數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
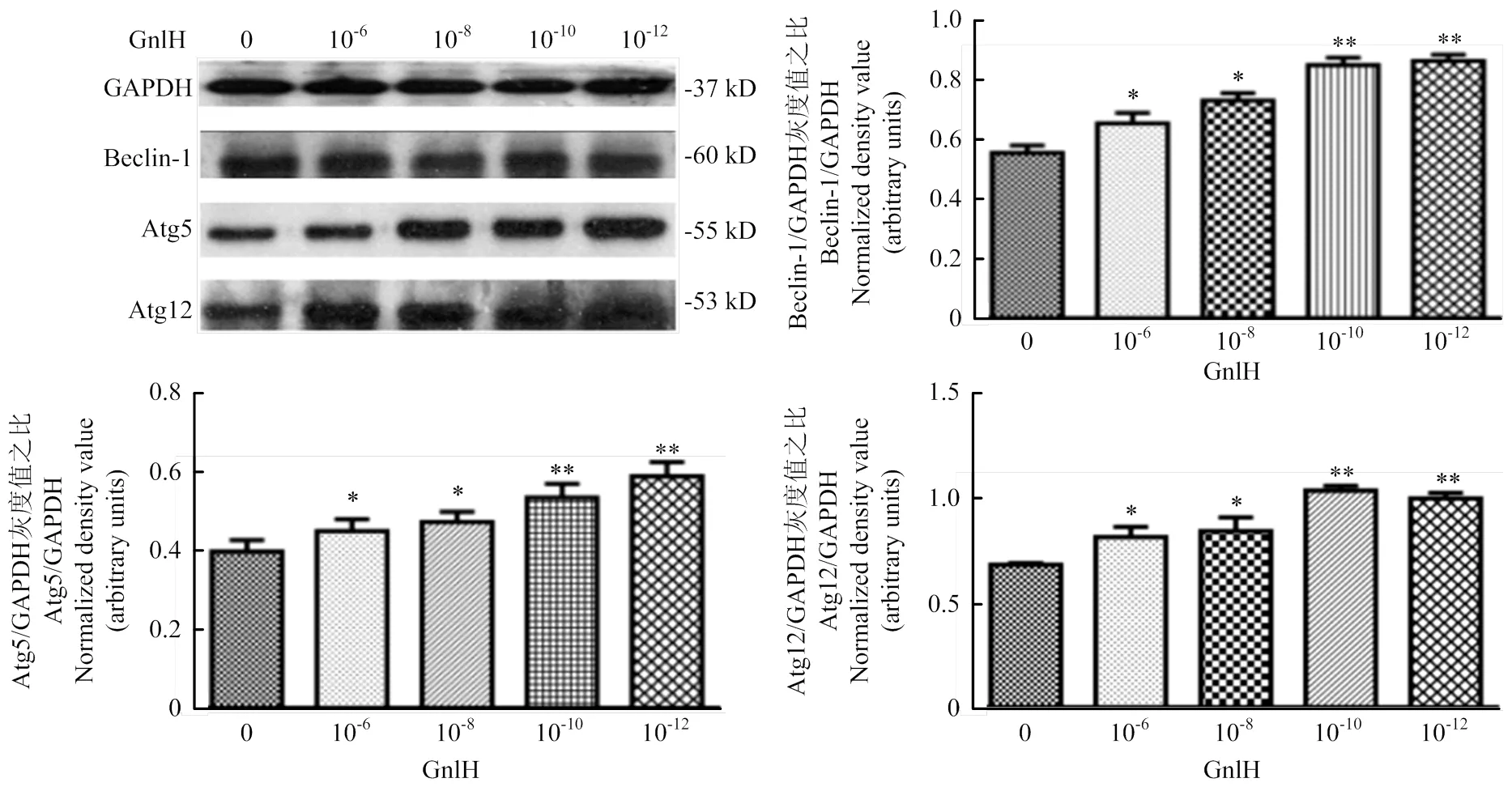
用ImageJ進行灰度值分析。數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
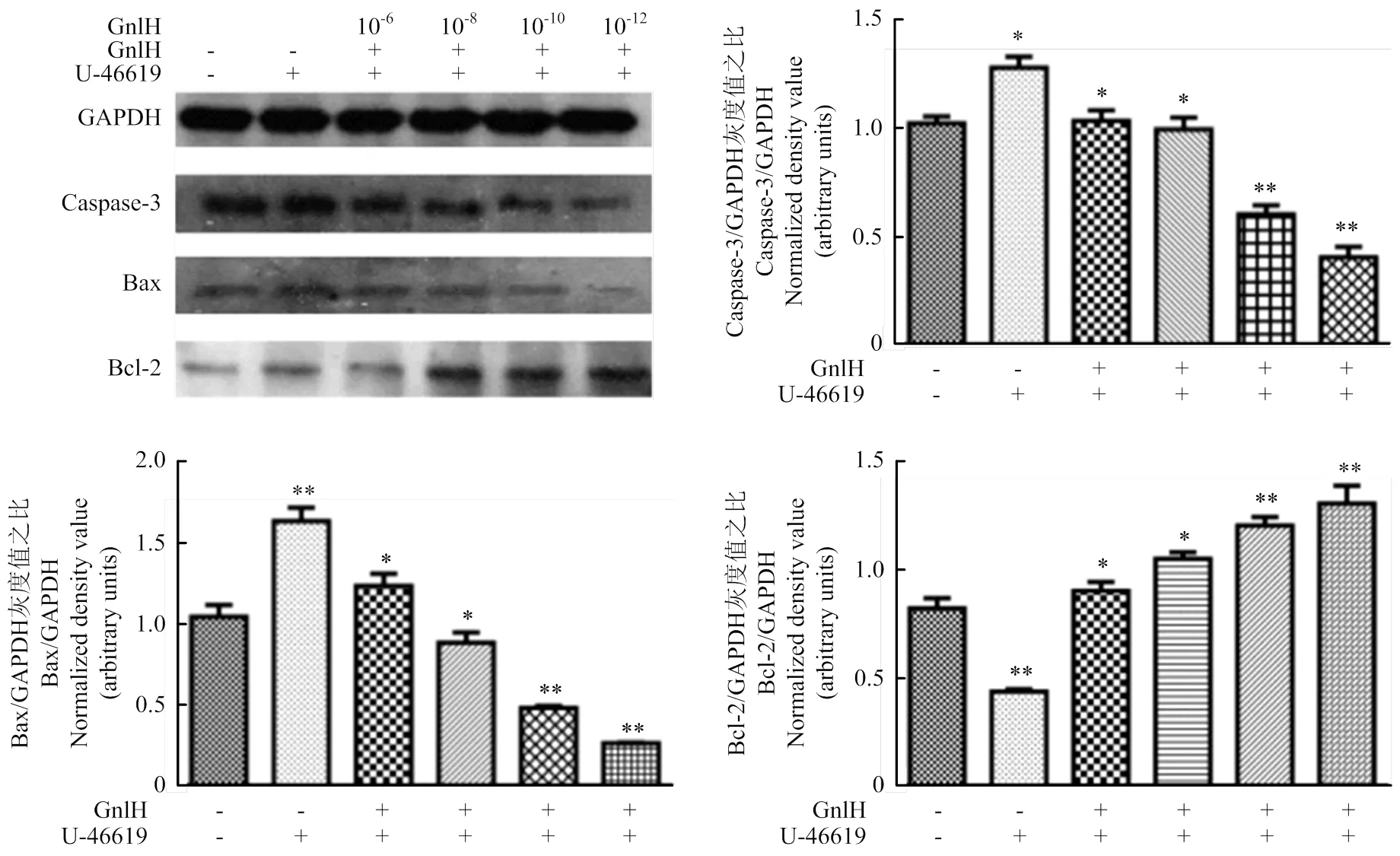
用ImageJ進行灰度值分析。數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
Western blotting測定Beclin-1、LC3和Atg5,灰度值分析。結(jié)果顯示,P38激活劑組與空白比較,存在顯著性差異(<0.05);經(jīng)不同劑量GnIH處理后的試驗組與p38激活劑組比較,均有顯著性差異(<0.05);低劑量組Beclin-1、LC3和Atg5的表達極顯著升高(<0.01,圖6)。
3 討論
相關(guān)研究表明,在GT1-7 細胞系上,mRFRP3預(yù)處理可使vip誘導(dǎo)的p38磷酸化受到抑制,此結(jié)果顯示GnIH具有抑制p38磷酸化的作用[34]。本研究中,體外培養(yǎng)pGCs,加入GnIH孵育,檢測其對p38MAPK信號通路活化的影響。當GnIH作用10 min時,對p38MAPK信號通路活化的影響最顯著(<0.05);加入p38激活劑后,GnIH可以有效抑制p38MAPK信號通路活化。與前人的結(jié)論一致,GnIH可以抑制p38磷酸化。
已有研究表明,在卵巢顆粒細胞中存在著細胞自噬與凋亡。我們猜想GnIH可能與顆粒細胞的自噬和凋亡有關(guān)。結(jié)果提示,高濃度GnIH可以促進細胞的自噬和凋亡,隨著GnIH濃度的降低,凋亡水平逐漸降低,而自噬水平逐漸升高。2017年Dave等對動情前期小鼠卵巢進行了研究,研究發(fā)現(xiàn),RFRP-1使Caspase-3、凋亡標記物明顯減少[35]。與本試驗結(jié)果一致。前期實驗室已證明GnIH可以調(diào)控附睪的自噬與凋亡[33],GnIH對附睪凋亡出現(xiàn)了極顯著的促進作用,而對自噬則出現(xiàn)了雙向調(diào)控。與本試驗結(jié)果不一致。猜測可能原因卵巢顆粒細胞是自噬的主要場所,有研究證明,細胞可以通過促進自噬來抑制凋亡的產(chǎn)生,從而提高細胞活性;附睪為體內(nèi)試驗,猜測動物體內(nèi)對GnIH有神經(jīng)激素調(diào)節(jié)作用,導(dǎo)致結(jié)果不同;通過試驗驗證,激素的濃度與作用時間均會對細胞的自噬與凋亡產(chǎn)生影響。
p38MAPK磷酸化水平升高,發(fā)揮凋亡促進的作用[36-37],研究證實,抑制p38MAPK信號通路可以通過阻止COCs擴散,從而影響GCs的生長,該結(jié)論在大鼠GCs和卵母細胞選擇性敲除p38受體中也得到了證實[38];INAGAKI等發(fā)現(xiàn)大鼠GCs中存在p38受體,用p38抑制劑SB203580抑制大鼠GCs的p38受體,試驗顯示通過降低FSH,從而降低了雌二醇和孕激素的產(chǎn)生,充分證明p38及其受體在GCs中發(fā)揮重要作用,進而促進卵母細胞成熟。當p38MAPK信號通路被激活,能通過調(diào)節(jié)細胞形態(tài)和提高細胞存活率促進細胞分化[39]。本試驗加入p38MAPK激活劑,結(jié)果提示,p38MAPK激活劑可以促進p38MAPK的磷酸化;p38MAPK激活劑可以促進卵巢顆粒細胞的凋亡和自噬,與前人研究一致。加入GnIH后,結(jié)果提示,不同濃度的GnIH對p38MAPK信號通路活化都具有抑制作用。我們進一步探究了p38MAPK信號通路活化后,GnIH對卵巢顆粒細胞自噬和凋亡的影響,從而探究GnIH是否通過p38MAPK信號通路對卵巢顆粒細胞的自噬和凋亡進行調(diào)控。通過檢測自噬和凋亡的標志性蛋白,我們得出,隨著GnIH濃度的降低,Caspase-3和Bax的表達呈下降趨勢,Bcl-2的表達呈上調(diào)趨勢,提示了GnIH通過抑制p38MAPK信號通路活化對pGCs的凋亡存在高濃度促進,低濃度抑制的作用;Beclin-1、Atg12和Atg5的表達呈上調(diào)趨勢,提示了GnIH對通過抑制p38MAPK信號通路活化對自噬有促進作用,GnIH的濃度越低,促進作用越明顯,且濃度低于10-10mol·L-1,有極顯著的促進作用(<0.01)。以往研究表明,自噬的作用不僅通過增強caspase的活化導(dǎo)致細胞凋亡,還可以通過凋亡導(dǎo)致細胞死亡。通過應(yīng)激反應(yīng),延緩caspase的激活,可以清除受損細胞[40],這些數(shù)據(jù)證明了細胞凋亡和自噬之間存在著明顯的復(fù)雜性,有時甚至相互矛盾。
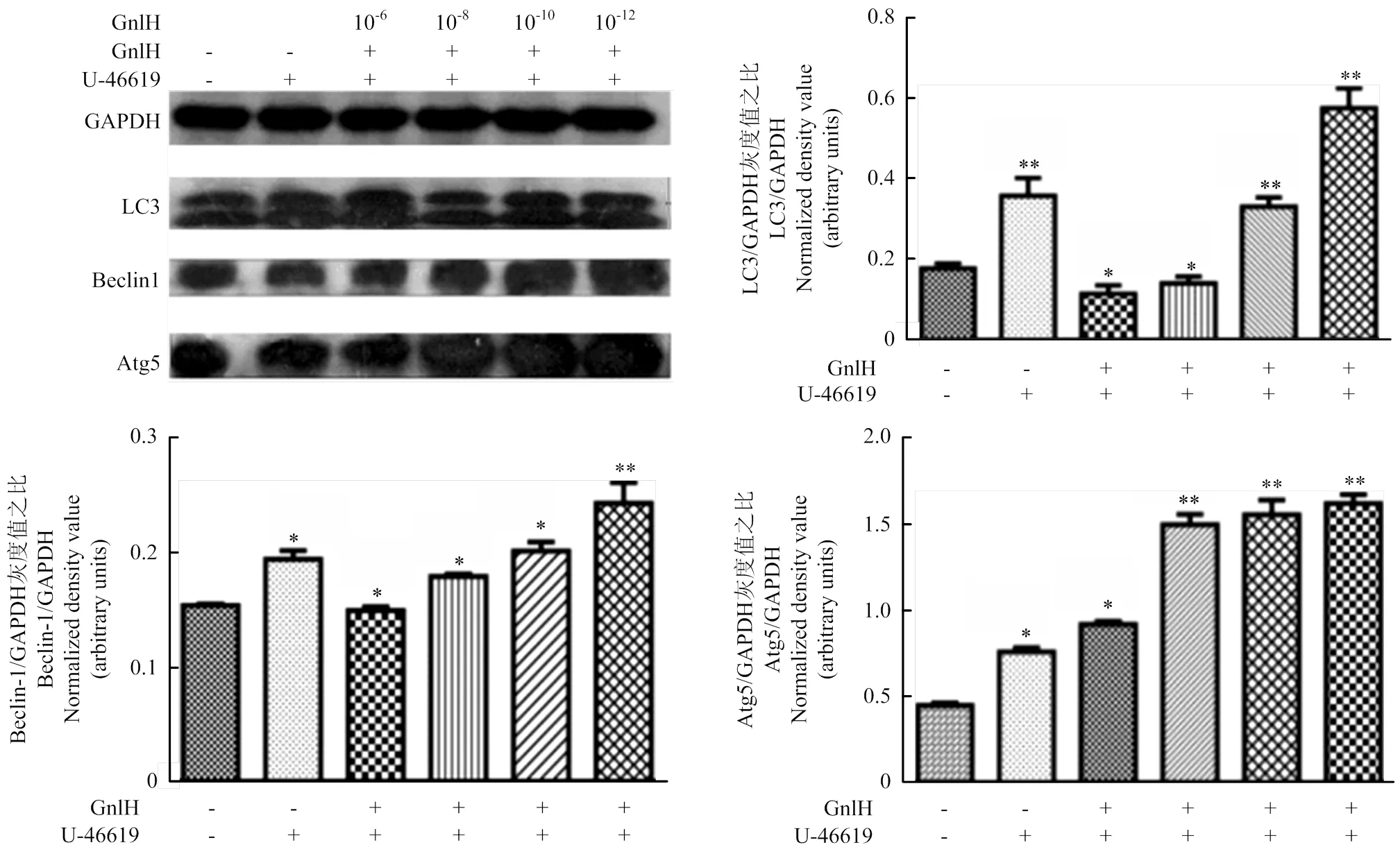
數(shù)值為平均值±S.E,與對照組比較,星號表示顯著差異。*P<0.05;**P<0.01
4 結(jié)論
本研究證明了促性腺激素抑制激素可以通過調(diào)控p38MAPK信號通路影響豬卵巢顆粒細胞的凋亡和自噬。自噬和凋亡的關(guān)系異常復(fù)雜,自噬和凋亡又存在很多交叉的信號通路。因此,本試驗的結(jié)果為后續(xù)研究豬卵巢顆粒細胞自噬與凋亡的分子機制提供了參考,也為研究卵泡閉鎖提供了新的思路。
[1] 謝敏, 姜法貴, 郭燕君. 卵泡發(fā)育和閉鎖過程中顆粒細胞自噬和凋亡關(guān)系的研究. 四川生理科學雜志, 2015, 37(2): 85-88.
XIE M, JIANG F G, GUO Y J. Study on the relationship between autophagy and apoptosis of granulosa cells during follicular development and atresia.2015, 37(2): 85-88. (in Chinese)
[2] 趙紅秋. 淺析提高母豬生產(chǎn)性能的措施. 今日畜牧獸醫(yī), 2019, 35(4):69.
ZHAO H Q. Analysis on the measures to improve the performance of sows., 2019, 35(4): 69. (in Chinese)
[3] Tsutsui K, Saigoh E, Ukena K, Teranishi H, Fujisawa Y, Kikuchi M, Ishii S, Peter J. A novel avian hypoth- alamic peptide inhibiting gonadotropin release., 2000, 275(2): 661-667.
[4] Tsutsui K, Ubuka T, Bentley G E, Kriegsfeld L . Gonadotropin-inhi-bitory hormone(GnIH): discovery, progress and prospect., 2012, 177(3): 305-314.
[5] 龔金秋, 陽美霞, 唐嬌美, 曾杰, 王水蓮. RFRP-3對哺乳動物生殖激素的調(diào)節(jié)作用. 中獸醫(yī)醫(yī)藥雜志, 2017(4):31-33.
GONG J Q, YANG M X, TANG J M, ZENG J, WANG S L. Regulatory effect of RFRP-3 on reproductive hormones in mammals.2017 (4): 31-33. (in Chinese)
[6] 韓興繪, 俞建. RFRP-3/GPR147信號通路在哺乳動物生殖系統(tǒng)中作用的研究進展. 中國中西醫(yī)結(jié)合兒科學, 2016, 8(3): 253-257.
HAN X H, YU J. Progress in the study of the role of RFRP-3/GPR147 signaling pathway in the reproductive system of mammals.2016, 8 (3): 253-257. (in Chinese)
[7] Kim J S, Brownjohn P W, Dyer B S, Beltramo M, Walker C S, Hay D L, Painter G F, Tyndall J D, Anderson G M. Anxiogenic and stressor effects of the hypothalamic neuropeptide rfrp-3 are overcome by the NPFFR antagonist GJ14., 2015, 156(11): 4152-4162.
[8] Bentley G E, Ubuka T, McGuire N L, Calisi R, Perfito N, Kriegsfeld L J, Wingfield J C, Tsutsui K. Gonadotrophin- inhibitory hormone: a multifunctional neuropeptide., 2009, 21 276-281.
[9] Bentley G E, Wilsterman K, Ernst D K, Lynn S E, Dickens M J, Calisi R M, Kriegsfeld L J, Kaufer D, Geraghty A C, McGuire N L, Lopes P C, Tsutsui K. Neural versus gonadal GnIH: are they independent systems A mini-review., 2017, 57 1194-1203.
[10] Rizwan M Z, Harbid A A, Inglis M A, Quennell J H , Anderson G M. Evidence that hypothalamic RFamide related peptide-3 neurones are not leptin-responsive in mice and rats., 2014, 26: 247-257.
[11] Li X, Su J, Lei Z, Zhao Y Y, Jin M M, Fang R, Zheng L C, Jiao Y. Gonadotropin-inhibitory hormone (GnIH) and its receptor in the female pig: cDNA cloning, expression in tissues and expression pattern in the reproductive axis during the estrous cycle., 2012, 36(2): 176-185.
[12] Kerr J F, Wyllie A H, Currie A R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics1972, 26(4): 239-257.
[13] Obeid L M , Linardic C M , Karolak L A , & Hannun Y A . Programmed cell death.1993, 259(5102), 1769-1771.
[14] Zhang H, Kong X X, Kang J S, Su J, Li Y, Zhong J T, Sun L K. Oxidative stress induces parallel autophagy and mitochondria dysfunction in Human Glioma U251 Cells., 2009. 110(2): 376-388.
[15] 汪宇, 周桃, 孫韓艷, 黃蓓, 姜黃素類似物EF24誘導(dǎo)A549細胞自噬及凋亡關(guān)系的研究. 中國細胞生物學學報, 2012, 34(6): 590-596.
WANG Y, ZHOU T, SUN H Y, HUANG P. Study on the relationship between autophagy and apoptosis in A549 cells induced by curcumin analogue EF24.2012, 34(6): 590-596. (in Chinese)
[16] Eisenberg-Lerner A, Bialik S, Simon H U, Kimchi A. Life and death partners: apoptosis, autophagy and the cross-talk between them., 2009, 16(7): 966-975.
[17] Choi J, Jo M, Lee E, Choi D. Induction of apoptotic cell death via accumulation of autophagosomes in rat granulosa cells.2011, 95(4): 1482-1486.
[18] Cardenas H, Pope W F. Control of ovulation rate in swine., 2002, 80: 36-46.
[19] Choi J Y, Jo M W, Lee E Y, Yoon B K, Choi D S. The role of autophagy in follicular development and atresia in rat granulosa cells.2010, 93(8): 2532-2537.
[20] Hu?as-Stasiak M. Gawron A. Follicular atresia in the prepubertal spiny mouse () ovary., 2011, 16(10): 967-975.
[21] Morais R D V S, Thomé R G, Lemos F S, Rizzo N B E. Autophagy and apoptosis interplay during follicular atresia in fish ovary: a morphological and immunocytochemical study., 2012, 347(2): 467-478.
[22] Tamura M, Nakagawa Y, Shimizu H, Yamada N, Miyano T, Miyazaki H. Cellular functions of mitogen-activated protein kinases and protein tyrosine phosphatases in ovarian granulosa cells., 2004 Feb; 50(1): 47-55.
[23] Villadiaz L G, Miyano T. Activation of p38 MAPK during porcine oocyte maturation., 2004, 71(2): 691-696.
[24] Singh P, Krishna A, Tsutsui K. Effects of gonadotropin- inhibitory hormone on folliculogenesis and steroidogenesis of cyclic mice., 2011, 95(4): 1397-1404.
[25] 李卉, 馬云, 馬波, 高揚, 宋輝. 不同周齡小鼠GnIH的血清含量及卵巢表達研究. 農(nóng)業(yè)科學研究, 2017(4): 13-15.
LI H, MA Y, MA B, GAO Y, SONG H. Study on serum content and ovarian expression of GnIH in mice of different weeks of age.2017(4): 13-15. (in Chinese)
[26] 汪瑤, 李珣, 李敏婕, 國夢婕, 雷治海. GnIH對母豬生殖調(diào)控的研究. 中國農(nóng)業(yè)科學, 2014, 47(18): 3716-3724.
WANG Y, LI X, LI M J, GUO M J, LEI Z H. Study on reproductive regulation of sows by GnIH., 2014, 47(18): 3716-3724. (in Chinese)
[27] Maddineni S R, Ocón-Grove O M, Krzysik-Walker S M, Hendricks G L, Ramachandran R. Gonadotropin- inhibitory hormone (GnIH) receptor gene is expressed in the chicken ovary: potential role of GnIH in follicular maturation., 2008, 135(2): 267-274.
[28] 張蕊, 常玲玲, 穆春宇, 付勝勇, 湯青萍, 卜柱. GnIH/GnRH對鳥類排卵的調(diào)控作用. 中國家禽, 2018(1): 42-45.
ZHANG R, CHANG L l, MU C Y, FU S Y, TANG Q P, PU Z. Regulation of GnIH/GnRH on ovulatory activity in birds.2018 (1): 42-45. (in Chinese)
[29] Franois H, Langlois I, Mulsant P, Bonnet A, Benne F, Gasser F. Gonadotropins induce accumulation of insulin-like growth factor I mRNA in pig granulosa cells.1992, 86(3): 205-211.
[30] Caloni F, Ranzenigo G, Cremonesi F, Spicer L J. Effects of a trichothecene, T-2 toxin, on proliferation and steroid production by porcine granulosa cells., 2009, 54(3): 337-344.
[31] Bentley G E, Ubuka T, Mcguire N L, Chowdhury V S, Morita Y, Yano T, Hasunuma I, Binns M, Wingfield J C, Tsutsui K. Gonadotropin-inhibitory hormone and its receptor in the avian reproductive system., 2008, 156(1): 34-43.
[32] Ubuka T, Ukena K, Sharp P J, Bentley G E, Tsutsui K. Gonadotropin-inhibitory hormone inhibits gonadal development and maintenance by decreasing gonadotropin synthesis and release in male quail., 2006, 147(3): 187-194.
[33] Wang X Y, Guo G L, Zhang X, Li M, Xiao K, Hu C H, Li X. Effect of RFRP-3, the mammalian ortholog of GnIH, on the epididymis of male rats., 2018. DOI: 10. 1016/ j. theriogenology. 2018. 05. 029.
[34] Son Y L, Ubuka T, Soga T, Yamamoto K, Bentley G E, Tsutsui K. Inhibitory action of gonadotropin-inhibitory hormone on the signaling pathways induced by kisspeptin and vasoactive intestinal polypeptide in GnRH neuronal cell line, GT1-7., 2016, 30(6): 2198.
[35] Dave A, Krishna A, Tsutsui K. Direct effects of RFRP-1, a mammalian GnIH ortholog, on ovarian activities of the cyclic mouse., 2017, 252: 193-199.
[36] Wang X F, Zhou Q M, Lu Y Y, Zhang T L, Su S B. Glycyrrhetinic acid potently suppresses breast cancer invasion and metastasis by impairing the p38 MAPK-AP1 functional axis., 2015, 19 ( 5) : 577-587.
[37] Tung C L, Jian Y J, Chen J C, Wang T J, Chen W C, Zheng H Y, Chang P Y, Liao K S, Lin Y W. Curcumin downregulates p38MAPK-dependent X-ray repair cross-complement group 1( XRCC1) expression to enhance cisplatin-induced cytotoxicity in human lung cancer cells., 2016, 389 (6): 657-666.
[38] Calder M D, Watson P H, Watson A J. Culture medium, gas atmosphere and MAPK inhibition affect regulation of RNA-binding protein targets during mouse preimplantation development., 2011, 142(5): 689-698.
[39] Inagaki K, Otsuka F, Miyoshi T, Yamashita M, Takahashi M, Goto J, Suzuki J, Makino H. p38- Mitogen- activated protein kinase stimulated steroidogenesis in granulosa cell-oocyte cocultures: role of bone morphogenetic proteins 2 and 4., 2009, 150(4): 1921-1930.
[40] Nikoletopoulou V, Markaki M, Palikaras K, Tavernarakis N. Crosstalk between apoptosis, necrosis and autophagy., 2013, 1833(12): 3448-3459.
Effects of GnIH on Autophagy and Apoptosis of Porcine Ovarian Granulosa Cells via p38MAPK Signaling Pathway
Zhang Xin, Huo KongLin, Song XingXing, Zhang DuoNi, Hu Wen, Hu ChuanHuo , LI Xun
(College of Animal Science and Technology, Guangxi University, Nanning 530004)
【】Studies have shown that autophagy and apoptosis restrict each other. As one of the main regulatory pathways of apoptosis, p38MAPK signaling pathway also has the dual effects of promoting and inhibiting autophagy. It has been proved that gonadotropin inhibitory hormone (gonadotropin-inhibitory hormone, GnIH) has effects on autophagy and apoptosis, but the mechanism of action is not clear. This experiment was conducted to study the effects of GnIH on autophagy and apoptosis of porcine ovarian granulosa cells via p38MAPK signaling pathway and its mechanism. 【】Oval granulosa cells were extracted from pig ovaries and cultured. To explore the best time of GnIH on p38MAPK signaling pathway, according to the time gradient of incubation GnIH (0, 10, 30, 60, and 90 min), Western blot was used to detect the protein expression of p38 and p-p38 in pGCs. To verify the effect of GnIH on p38MAPK signaling pathway, the cells were divided into 4 groups (control, GnIH, p38 activating agent (U-46619), and U-46619 +GnIH), Western blot was used to detect the protein expression of p38 and p-p38. To investigate the effects of different concentrations of GnIH on autophagy and apoptosis: the cells were divided into 5 groups ( control, 10-6mol·L-1GnIH, 10-8mol·L-1GnIH, 10-10mol·L-1GnIH, and 10-12mol·L-1GnIH), Western blot was used to detect the protein expression of autophagy and apoptosis. To verify the effects of different concentrations of GnIH on autophagy and apoptosis through p38 signaling pathway: the cells were divided into 6 groups (control, U-46619, U-46619+10-6mol·L-1GnIH, U-46619+10-8mol·L-1GnIH, U-46619+10-10mol·L-1GnIH, and U-46619+10-12mol·L-1GnIH), Western blot was used to detect the protein expression of autophagy and apoptosis. 【】After incubation with GnIH for 10 min, the protein expression of p38 and p-p38 was significantly decreased (<0.05). The results suggested that the optimum action time of GnIH on p38MAPK signaling pathway was 10 min; U-46619 significantly promoted the phosphorylation of p38 in pGCs (<0.05), while GnIH significantly inhibited p38 phosphorylation of pGCs (<0.05). The results suggested that U-46619 activated the p38MAPK signaling pathway, and GnIH inhibited the activation of p38MAPK signaling pathway; When the concentration of GnIH was 10-6mol·L-1, the autophagy and apoptosis of pGCs increased significantly (<0.05). With the decrease of GnIH concentration, the autophagy level of pGCs increased gradually (<0.05), while the apoptosis level of pGCs decreased gradually (<0.05). The results suggest that high concentration of GnIH promote autophagy and apoptosis. With the decrease of GnIH concentration, the autophagy level increased gradually, while the apoptosis level decreased gradually. After adding U-46619, GnIH significantly upregulated the autophagy of pGCs and down-regulated the apoptosis of pGCs (<0.05), which suggested that different concentrations of GnIH affected the autophagy and apoptosis of pGCs through p38MAPK signaling pathway. 【】GnIH might up-regulate the autophagy of pGCs and reduce the apoptosis of pGCs by inhibiting the activation of p38MAPK signaling pathway.
autophagy; apoptosis; GnIH; p38MAPK; porcine; ovarian granulosa cells

10.3864/j.issn.0578-1752.2020.09.016
2018-11-30;
2020-03-11
國家自然科學基金青年基金項目(31402151)、廣西自然科學基金面上項目(2017GXNSFAA198086)、廣西自然科學基金青年基金項目(2015GXNSFBA139077)
張鑫,Tel:15676119603;E-mail:2507854337@qq.com。通信作者李珣,Tel:15578947781;E-mail:lixun198@163.com。通信作者胡傳活,E-mail:hch64815@gxu.edu.cn
(責任編輯 林鑒非)

