正常宮頸、CIN、宮頸鱗癌中P-gp、MRP1、Survivin的相關(guān)表達(dá)及對(duì)新輔助化療作用的研究
陳 芬 彭瑞宇 孟 佳 張麗萍
1 昆明愛維艾夫醫(yī)院,云南省昆明市 650000; 2 華中科技大學(xué)同濟(jì)醫(yī)學(xué)院附屬武漢兒童醫(yī)院(武漢市婦幼保健院);3 湖北醫(yī)藥學(xué)院附屬太和醫(yī)院
宮頸癌是全球范圍排名第4位的常見惡性腫瘤,也是女性面臨的主要健康問題[1],嚴(yán)重影響患者的生活質(zhì)量。其中,子宮頸癌類型中以鱗狀細(xì)胞癌最為常見,占 75%~80%,其次為腺癌,其他病理類型的宮頸癌較為少見[2]。宮頸癌的傳統(tǒng)治療方法是根治性手術(shù)和放化療,ⅠA期~ⅡA期宮頸癌患者的治療方式以手術(shù)治療為主,其優(yōu)點(diǎn)是年輕患者可以選擇性地保留卵巢和陰道的部分功能;ⅡB期及以上患者以放療為主;晚期和復(fù)發(fā)轉(zhuǎn)移的患者,主要采取化學(xué)療法。宮頸癌新輔助化療(Neoadjuvant chemotherapy,NACT)是近年才興起的宮頸癌治療方案。由Frei[3]在1982年首先提出新輔助化療的概念,即對(duì)于臨床表現(xiàn)為巨塊型或局部晚期的患者,在手術(shù)前或放療前先使用化療,以利于局部治療手段的實(shí)行。化療雖然可以提高治療效果,可是由化療產(chǎn)生的耐藥性是導(dǎo)致化療失敗的關(guān)鍵原因之一。在實(shí)施新輔助化療方案時(shí),需提前考慮化療對(duì)于該患者是否有效。P-gp、MRP1、Survivin是與耐藥相關(guān)的三種基因蛋白,本研究通過聯(lián)合檢測(cè)三者在正常宮頸、CIN以及宮頸鱗癌新輔助化療前后的表達(dá),探討其在新輔助化療中的作用,進(jìn)而為采取有效的治療方案提供相關(guān)的依據(jù),以便更好地指導(dǎo)臨床用藥。
1 材料與方法
1.1 標(biāo)本來源和相關(guān)臨床資料 收集我院2016年2月—2017年3月間相關(guān)標(biāo)本,經(jīng)本院病理科活檢確診為:正常宮頸組織15例,CIN組織15例(無特殊疾病),以及宮頸癌患者的標(biāo)本,其中符合在本院行新輔助化療前均未行任何化療、放療和免疫治療的初治患者,及新輔助化療后行手術(shù)切除的石蠟配對(duì)標(biāo)本共30例。所有患者的病理切片均由資深病理科專家復(fù)閱宮頸癌HE病理切片并再次確診。采用國(guó)際婦產(chǎn)科聯(lián)盟(FIGO,2009)[4]臨床分期標(biāo)準(zhǔn):宮頸癌Ⅰb2期10例,Ⅱa期20例,總共30例。且均符合:初治患者(未接受過化療、放療和免疫治療);患者年齡26~64歲,平均年齡為46.24歲;癌灶直徑≥4cm;血WBC≥4×109/L,PLT≥10×109/L;心肺肝腎及凝血功能均無異常;無其他惡性腫瘤病史。所選病例均行開普拓(CPT-Ⅱ)聯(lián)合順鉑(DDP)靜脈滴注的化療方案,具體用法[5]:CPT-Ⅱ60mg/m2,化療第1、8、15天靜脈滴注;DDP 60mg/m2,僅第1天靜脈滴注,并常規(guī)水化。每個(gè)療程間隔時(shí)間28d。化療1個(gè)療程后觀察患者的近期臨床療效。化療總療程結(jié)束后14d,各項(xiàng)生化指標(biāo)恢復(fù)接近正常水平時(shí),行廣泛全子宮切除及盆腔淋巴結(jié)清掃術(shù),并留取組織石蠟封存。
1.2 NACT臨床療效判定 化療結(jié)束后2周,根據(jù)婦檢、婦科陰道B超來測(cè)量宮頸癌灶的大小變化,以此判斷其行新輔助化療后的近期臨床療效。根據(jù)國(guó)際抗癌協(xié)會(huì)(UICC)療效判定標(biāo)準(zhǔn):完全緩解(Complete remission,CR):可見的腫瘤病變完全消失,維持4周以上;部分緩解(Partial remission,PR):腫瘤病灶的最大直徑及其最大的垂直橫徑的乘積縮小>50%以上,其他病灶無增大,無新病灶出現(xiàn),維持4周以上;穩(wěn)定(Stable disease,SD)或無變化(No change,NC):腫瘤病灶的兩徑乘積縮小不足50%,或增大不超過25%,無新病灶出現(xiàn),維持4周以上;進(jìn)展(Progressive disease,PD):腫瘤病灶的兩徑乘積增大25%以上或出現(xiàn)新病灶。臨床有效=CR+PR;臨床無效=SD+PD。
1.3 實(shí)驗(yàn)方法和主要試劑 采用免疫組化S-P法(采用生物素標(biāo)記的第二抗體,使之與鏈霉菌抗生物素蛋白連接的過氧化物酶及基質(zhì)色素混合,并利用此混合液來測(cè)定細(xì)胞和組織中的抗原成分)及自動(dòng)圖像分析系統(tǒng)來檢測(cè)。經(jīng)載破片、組織切片、微波抗原修復(fù)等步驟獲取石蠟切片。P-gp、MRP1單克隆抗體及Survivin多克隆抗體及SP試劑盒均購(gòu)于福建邁新生物科技有限公司。分別用PBS緩沖液代替3種一抗作為陰性對(duì)照,并用已知的陽性病理切片作為陽性對(duì)照片。運(yùn)用Image Pro Plus 6.0自動(dòng)圖像分析系統(tǒng),于×200倍鏡下,隨機(jī)選取5個(gè)視野,系統(tǒng)自動(dòng)隨機(jī)測(cè)定每個(gè)視野3個(gè)不同的部位,最后提取陽性細(xì)胞,測(cè)定平均光密度值(OD) 。
1.4 免疫組化結(jié)果的相關(guān)判定 P-gp、MRP1陽性染色顆粒位于胞膜和(或)胞漿中,Survivin陽性染色顆粒定位于細(xì)胞漿。陽性結(jié)果為胞膜和(或)胞漿中出現(xiàn)淡黃至棕黃色顆粒為陽性。陽性信號(hào)運(yùn)用Image Pro Plus 6.0自動(dòng)圖像分析系統(tǒng),于×200倍鏡下,隨機(jī)選取5個(gè)視野,系統(tǒng)自動(dòng)隨機(jī)測(cè)定每個(gè)視野3個(gè)不同的部位,最后提取陽性細(xì)胞,測(cè)定平均光密度值(OD) 。
1.5 統(tǒng)計(jì)學(xué)方法 應(yīng)用SPSS17.0統(tǒng)計(jì)學(xué)軟件對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)學(xué)分析,采用t檢驗(yàn)、χ2檢驗(yàn)及單因素方差分析,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 正常宮頸組織、CIN及化療前宮頸鱗癌中P-gp、MRP1、Survivin的表達(dá) P-gp、MRP1、Survivin從正常宮頸組織到CIN再到宮頸鱗癌,三者陽性表達(dá)量是顯著升高的,且在宮頸鱗癌組織中表達(dá)最高,具體見表1。
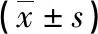
表1 P-gp、MRP1、Survivin在正常宮頸組織、CIN和宮頸鱗癌中的表達(dá)
注:P<0.01,差異有顯著的統(tǒng)計(jì)學(xué)意義。
2.2 P-gp、MRP1、Survivin在宮頸鱗癌新輔助化療前后的表達(dá) 新輔助化療前、后P-gp、Survivin的OD值比較差異有統(tǒng)計(jì)學(xué)意義,MRP1化療前后差異無統(tǒng)計(jì)學(xué)意義,具體見表2及圖1~6。
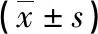
表2 P-gp、MRP1、Survivin在宮頸鱗癌新輔助化療前后的表達(dá)
2.3 P-gp、MRP1、Survivin的表達(dá)與新輔助化療近期臨床療效之間的關(guān)系 P-gp在新輔助化療有效組中的表達(dá)量顯著低于無效組中的表達(dá)量(P<0.01);MRP1在新輔助化療有效組中的表達(dá)量與無效組中的表達(dá)量無差別(P>0.05);Survivin在新輔助化療有效組中的表達(dá)量顯著低于無效組中的表達(dá)量(P<0.01),具體見表3。
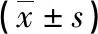
表3 P-gp、MRP1、Survivin 在NACT化療后的表達(dá)與近期臨床療效之間的關(guān)系

圖1 P-gp在宮頸鱗癌化療前的陽性表達(dá)S-P×200

圖2 P-gp在宮頸鱗癌化療后的陽性表達(dá)S-P×200

圖3 MRP1宮頸鱗癌化療前陽性表達(dá)S-P×200

圖4 MRP1宮頸鱗癌化療后陽性表達(dá)S-P×200

圖5 Survivin宮頸鱗癌化療前陽性表達(dá)S-P×200

圖6 Survivin宮頸鱗癌化療后陽性表達(dá)S-P×200
3 討論
目前宮頸癌的主要治療方法是手術(shù)和放療,但其臨床預(yù)后效果并不理想,隨著新輔助化療的廣泛應(yīng)用,其化療療效也越來越明顯[6]。新輔助化療可以縮小腫瘤病灶,降低癌細(xì)胞的宮旁浸潤(rùn)程度,使部分喪失手術(shù)機(jī)會(huì)的患者再次獲得手術(shù)機(jī)會(huì),同時(shí)也可以增強(qiáng)其對(duì)放療的敏感性。化療雖然可以提高治療效果,可是由化療產(chǎn)生的耐藥性是導(dǎo)致化療失敗的關(guān)鍵原因之一。對(duì)于化療不敏感的患者實(shí)施新輔助化療,可能導(dǎo)致病情進(jìn)一步加重,從而延誤最佳治療時(shí)機(jī)。因此,由于耐藥導(dǎo)致的化療失敗在很大程度上限制了新輔助化療藥物的選擇和使用。
P-糖蛋白是一種能量依賴性且具有跨膜外排泵作用的糖蛋白。是多藥耐藥基因 MDR-1的編碼產(chǎn)物,經(jīng)ATP水解供能將藥物主動(dòng)轉(zhuǎn)運(yùn)出胞外,最終導(dǎo)致腫瘤耐藥[7]。應(yīng)瑜等在對(duì)50例Ⅰb2-Ⅱb期宮頸癌患者的研究中表明化療后P-gp在宮頸鱗癌陽性表達(dá)率顯著升高,由化療前56%上升到85%(P<0.05),且在 P-gp陽性表達(dá)的患者中化療有效率為39.29%,陰性表達(dá)的患者中化療有效率高達(dá)100.00%[8]。本研究發(fā)現(xiàn)P-gp在正常宮頸組織、CIN及宮頸鱗癌中均有不同程度的表達(dá),且正常宮頸組織 多藥耐藥相關(guān)蛋白MRP是一種跨膜轉(zhuǎn)運(yùn)糖蛋白,介導(dǎo)腫瘤細(xì)胞的多藥耐藥,目前已發(fā)現(xiàn)9個(gè)成員,其中MRP1與腫瘤細(xì)胞的多藥耐藥關(guān)系最為密切[9]。其機(jī)制可能是隨著化療療程的延長(zhǎng)腫瘤細(xì)胞內(nèi)MRP1基因過度表達(dá)或腫瘤細(xì)胞本身存在過度表達(dá)的MRP1基因,導(dǎo)致化療藥物被泵出細(xì)胞外,從而產(chǎn)生腫瘤耐藥[10]。本研究發(fā)現(xiàn)MRPl在正常宮頸組織、CIN及新輔助化療前宮頸鱗癌組織中均有不同程度的表達(dá),MRPl在新輔助化療前的宮頸鱗癌組織中的表達(dá)>CIN>正常宮頸組織(P<0.01)。MRPl在正常組織中的表達(dá),考慮與機(jī)體的自身保護(hù)機(jī)制有關(guān),為正常生理功能的體現(xiàn)。本研究還發(fā)現(xiàn),MRPl在初治宮頸鱗癌組織中表達(dá)高,說明宮頸鱗癌也是MRPl的高表達(dá)腫瘤,可能存在MRPl介導(dǎo)的原發(fā)性耐藥。本研究中宮頸鱗癌患者新輔助化療后,MRPl的陽性表達(dá)量雖然有升高,但是新輔助化療并沒有明顯促進(jìn)MRPl的表達(dá)(P>0.05)。進(jìn)一步說明,化療后MRPl的高表達(dá),并不是由于新輔助化療藥物誘導(dǎo)所致。因此我們認(rèn)為,多藥耐藥相關(guān)蛋白1(MRPl)可能僅介導(dǎo)宮頸鱗癌的原發(fā)性耐藥,不參與繼發(fā)性耐藥。 Survivin是迄今發(fā)現(xiàn)的最強(qiáng)的凋亡抑制因子,是凋亡抑制蛋白家族的成員之一,在腫瘤細(xì)胞增殖、凋亡以及血管形成過程中發(fā)揮重要作用[11]。且Survivin在組織中的表達(dá)具有很明顯的特點(diǎn),其在正常組織無表達(dá)或低表達(dá),在大多數(shù)終末分化組織中缺失或低表達(dá),而在大多數(shù)人實(shí)質(zhì)性腫瘤和血液惡性腫瘤中強(qiáng)表達(dá),與腫瘤的發(fā)病、浸潤(rùn)及預(yù)后密切相關(guān)[12-13]。Wall等[14]研究證實(shí),Survivin Thr34磷酸化對(duì)維持細(xì)胞分裂、保持細(xì)胞活性是必不可少的,將不能磷酸化的人工突變體T34導(dǎo)入宮頸癌細(xì)胞株內(nèi),可誘導(dǎo)細(xì)胞凋亡,增加對(duì)化療的敏感性。本研究表明,Survivin在正常宮頸組織中呈現(xiàn)低表達(dá)或者不表達(dá)狀態(tài),Survivin正常宮頸組織的表達(dá)量 綜上所述,由P-gp、MRP1、Survivin介導(dǎo)的多藥耐藥,與新輔助化療的臨床療效密切相關(guān),其平均光密度值表達(dá)越高,預(yù)示著化療效果越差。因此聯(lián)合檢測(cè)多個(gè)耐藥相關(guān)蛋白,可以更好地指導(dǎo)臨床化學(xué)用藥,選擇有效的個(gè)體化治療方案。但是由于本研究的研究對(duì)象例數(shù)較少,其臨床指導(dǎo)價(jià)值需要大樣本多中心對(duì)照研究。

