新型冠狀病毒肺炎實驗室診斷技術研究進展
王建軍,趙 平,吳 亮,徐 哲,王福生,程勇前
(解放軍總醫院第五醫學中心 1. 國際肝病診療中心; 2. 感染性疾病診療與研究中心,北京 100039)
2019年12月,湖北省武漢市發生以肺部病變為主的新發傳染病,張永振團隊首次從患者收集的支氣管肺泡灌洗液中分離得到病原體并進行全基因組測序,發現該病毒基因組與蝙蝠體內發現的嚴重急性呼吸綜合征冠狀病毒(SARS-CoV)(GenBank登錄號AY278488.2)有79.5%的核苷酸相似性[1]。2020年1月11日世界衛生組織(World Health Organization,WHO)將這種病毒暫命名為2019-nCOV,2020年2月11日WHO宣布由新型冠狀病毒引發的疾病正式名稱為2019新型冠狀病毒病(coronavirus disease 2019,COVID-19),該病毒稱為嚴重急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)[2]。COVID-19短時間內擴散到全國,3月11日WHO宣布COVID-19已構成全球大流行。實驗室檢測是確診COVID-19的重要依據,對于該病的治療和防疫工作至關重要。本文對COVID-19實驗室臨床診斷技術相關進展進行整理綜述。
1 病原學檢測
1.1 病毒分離 病原體鑒定主要包括病毒分離和病毒核酸檢測,其中病毒分離是實驗室診斷病毒感染的“金標準”。國內有多個團隊報道病毒分離結果,高福院士團隊獲得COVID-19患者的支氣管肺泡灌洗液,將其接種至人氣管上皮細胞中進行分離培養,通過透射電鏡觀察到病毒顆粒,將培養上清液進行全基因組測序,并與基因庫比對確定分離出正確序列的SARS-CoV-2[3]。伍桂珍教授團隊也選擇COVID-19支氣管肺泡灌洗液和咽拭子標本接種至特殊致病性的人氣管上皮細胞(human airway epi-thelium, HAE)進行病毒分離,應用電子顯微鏡觀察病毒的形態,通過科赫法則初步鑒定病毒[4]。病毒分離耗時較長,對實驗室條件要求高,不適合用于臨床患者的早期診斷,但準確性高,對病毒鑒定、致病機制研究、疫苗研發和抗病毒藥物研制具有重要意義。
1.2 病毒核酸檢測
1.2.1 基因測序技術 高通量測序結合生物信息學分析可以快速識別病原體。2020年1月12日,我國學者將從患者體內分離的SARS-CoV-2基因組序列提供給WHO[1]。對患者標本病毒基因進行測序,可以對病原體進行準確鑒定,并可以分析不同SARS-CoV-2病毒株基因組序列的同源性,但基因測序的成本相對較高,耗時較長,無法用于暴發流行期間大量疑似患者的快速診斷。病毒基因測序的重要意義在于病毒溯源、遺傳學進化分析,以及病毒變異的研究,并可以作為確診SARS-CoV-2的病原學診斷依據之一。
由于病毒的高度變異性及病毒與參考基因組的偏差,對病毒數據分析鑒定速度的要求越來越高。Genome Detective是一個基于互聯網的軟件應用程序[5],可以快速、準確地從第二代測序數據集中組裝所有已知的病毒基因組,允許以FASTA格式從組裝的基因組中鑒定系統發生簇和基因型。目前SARS-CoV-2的基因序列已在GeneBank中共享,Cleemput等[6]據此構建了基因組檢測冠狀病毒分型工具,該工具可以準確地識別世界各地分離的SARS-CoV-2序列,每次可接受2 000個序列的提交,對新的完整基因組序列的分析約需1 min。 該工具已對來自十種冠狀病毒的數百個全基因組進行了測試和驗證,并正確分類了所有與SARS相關的冠狀病毒(SARSr-CoV)和所有可用于COVID-19的公共數據。隨著疫情的蔓延,該工具還可以跟蹤新的病毒突變,有助于加速新型診斷試劑、藥物和疫苗的開發。
納米孔分析技術起源于Coulter計數器的發明以及單通道電流的記錄技術,與許多其他測序方法不同,納米孔測序不需要通過常見的化學熒光或酶反應測試所檢測的樣品,而是采用測量分子通過納米孔時的電流中斷直接檢測單鏈DNA/RNA分子序列[7]。對病原體核酸進行擴增后使用納米孔測序儀進行測序,將獲得的核酸序列與已知病原體序列對照以確定病原體類型,克服了傳統高通量測序平臺對樣本制備、場地要求、運行時間長等不利因素,具備實時、運行時間短、文庫構建簡單等優勢。武漢大學組建的聯合團隊創新性開發的納米孔靶向測序檢測方法,于2020年1月20日在臨床開展測序工作,能大幅提升病毒陽性檢出率,首次實現了在4 h內獲得高敏感性、高準確性SARS-CoV-2序列,較實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction, qPCR)的陽性檢測率提升了43.8%;實現了同時檢測SARS-CoV-2和其他10類40種常見呼吸道病毒,以及監測突變病毒[8]。2020年1月30日,中國疾病控制預防中心報道,應用納米孔技術獲得了SARS-CoV-2的基因序列[4]。目前國內也有多家公司宣布完成基于納米孔測序技術的SARS-CoV-2核酸全長檢測試劑盒的開發,已經開始應用于臨床COVID-19的快速診斷。SARS-CoV-2核酸基因測序技術的特征及應用情況見表1。
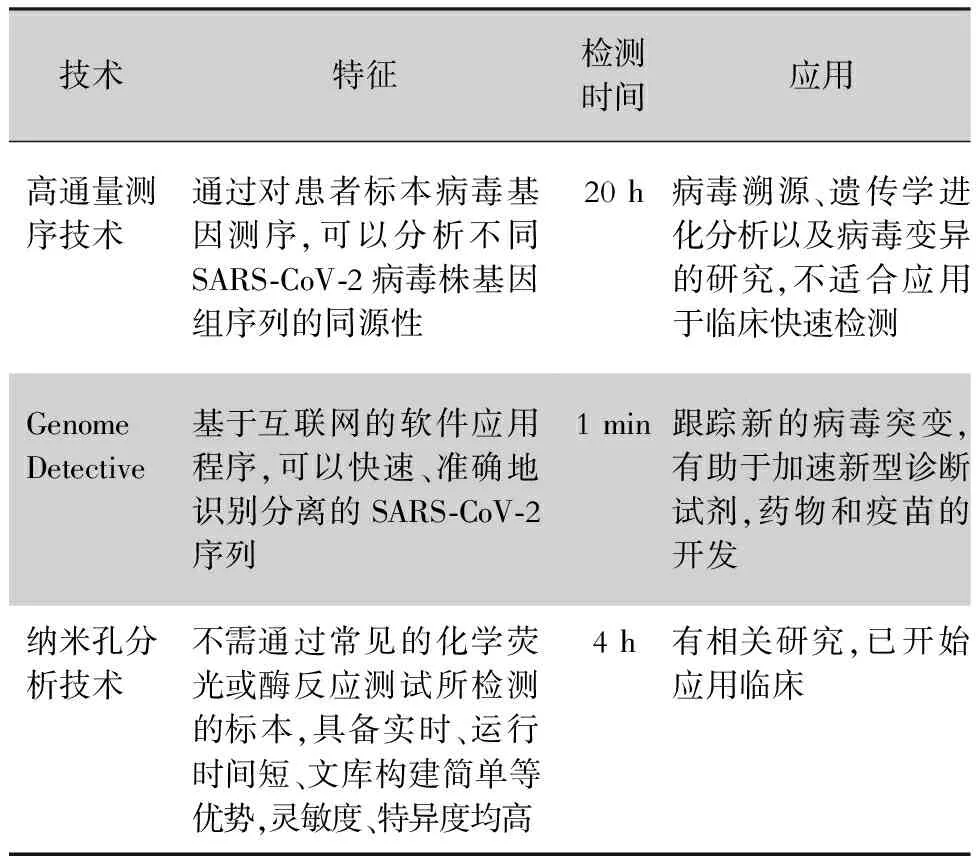
表1 三種SARS-CoV-2基因測序技術的特征及應用情況
1.2.2 PCR技術 逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction, RT-PCR)是RNA逆轉錄(reverse transcription, RT)與cDNA聚合酶鏈反應(polymerase chain reaction, PCR)相結合的技術。2020年1月23日德國Corman等[9]基于我國張永振團隊上傳的SARS-CoV-2基因序列(GenBank MN908947)公布了SARS-CoV-2實時熒光RT-PCR(RT-qPCR)診斷測試方法和流程。此項工作被認為是首個SARS-CoV-2診斷測試方法,并成為WHO SARS-CoV-2分子檢測試劑盒的基礎。PCR檢測方法主要針對SARS-CoV-2基因組中開放讀碼框1ab(open reading frame 1ab,ORF1ab)和核衣殼蛋白(nucleocapsid protein,NP)。SARS-CoV-2感染實驗室確診需滿足以下兩項條件中的一項:(1)同一份標本中SARS-CoV-2兩個靶標(ORF1ab、N)RT-qPCR檢測結果均為陽性,如果出現單個靶標陽性的檢測結果,則需重新采樣,重新檢測;如果仍然為單靶標陽性,判定為陽性。(2)兩種標本RT-qPCR同時出現單靶標陽性,或同種類型標本兩次采樣檢測中均出現單個靶標陽性的檢測結果,可判定為陽性。
RT-PCT技術是目前疫情暴發期間快速確診SARS-CoV-2感染者的主要方法,但核酸檢測結果陰性并不能排除SARS-CoV-2感染,需排除可能產生假陰性的因素。試劑盒的特異度、靈敏度和穩定性有待深入優化與驗證,試劑盒質量也有待進一步提升。2020年1月24日國內首個商用SARS-CoV-2分子檢測試劑盒由上海之江生物科技有限公司完成,其后共有50多家生物科技公司開發出RT-PCR檢測試劑盒。有研究對多種國產SARS-CoV-2核酸檢測試劑盒的檢測性能進行了比較與分析,結果顯示各試劑的檢測結果存在一定的差異[10]。常規RT-PCR SARS-CoV-2核酸檢測下限為50拷貝數/μL。最近,武漢大學藍柯團隊應用微滴式數字PCR(droplet digital, ddPCR)方法進行SARS-CoV-2核酸檢測發現,ddPCR方法對SARS-CoV-2核酸檢測下限值至少為RT-PCR 1/500,且臨床檢測的總體準確性為94.3%,提示ddPCR方法對COVID-19早期診斷及臨床治愈的判斷可能比常規RT-PCR檢測有更高的敏感性[11]。
2020年1月17日WHO臨時指導意見[12]建議,采集患者呼吸系統分泌物和血清標本進行SARS-CoV-2核酸檢測。門診患者可選擇鼻咽或咽拭子,如果有痰可選擇深咳痰,癥狀嚴重的患者可選擇支氣管或肺泡灌洗液。陳煒等[13]研究發現,痰標本中可檢測出的SARS-CoV-2核酸量高于咽拭子標本,表明痰標本較咽拭子標本可更好地診斷COVID-19,究其原因可能與SARS-CoV-2侵襲感染下呼吸道有關。另外,咽拭子檢測由于不易采集到足量、合格的標本,故應用咽拭子作為篩查SARS-CoV-2核酸的手段時,陰性檢測結果不能作為排除SARS-CoV-2感染的依據。因此,采集深咳痰標本或者肺泡灌洗液,并以2個靶標同時顯示陽性作為診斷標準為佳。2020年1月31日Holshue等[14]首次報道在確診病例的上呼吸道和糞便標本中均檢出SARS-CoV-2,近期國內有多項研究[15-16]發現患者糞便標本SARS-CoV-2核酸檢測陽性。也有研究[17]發現感染后期肛門拭子陽性率高于咽拭子陽性率,提示SARS-CoV-2可能通過口-糞途徑傳播。檢測糞便標本SARS-CoV-2核酸在確診COVID-19中也有重要意義。
1.2.3 CRISPR技術 CRISPR技術發現于20世紀90年代初,并在發現7年后首次用于生物化學試驗,迅速成為人類生物學、農業和微生物學等領域最流行的基因編輯工具。CRISPR系統具有靶向RNA的特性,可以鑒定檢測標本中是否存在特定的序列,從而達到檢測病原體的目的。2020年2月14日,麻省理工學院張峰團隊[18]基于CRISPR-Cas13的檢測技術,將檢測方法開發成一種即時診斷產品。此診斷產品無需特定的檢測設備,僅通過類似于pH試紙測試方法,在1 h內即可完成檢測,具有很高的靈敏度,病毒載量10~100個拷貝/μL即可檢測到。2020年3月2日Curti等[19]報道了基于CRISPR-Cas12技術開發的一種靈敏、快速、便攜式的SARS-CoV-2檢測技術。但國外開發的以上兩種方法尚未在臨床應用。國內Hou等[20]于2020年2月25日報道了基于CRISPR技術開發的一種快速檢測SARS-CoV-2的方法,并與宏基因組測序和RT-PCR檢測技術進行比較,發現CRISPR有接近單拷貝的敏感性,未發現假陽性情況,提示其有較高的敏感度和特異度;同時這種檢測方法耗時最短,僅為40 min,而RT-PCR則大約需1.5 h,基因組測序需20 h。CRISPR技術有很好的臨床實用性,可為COVID-19的診斷提供一種快捷、方便的方法。
1.2.4 其他分子診斷技術 (1)環介導等溫擴增(loop-mediated isothermal amplification,LAMP)技術是日本學者Notomi 等[21]于2000年發明的一種新的DNA擴增技術,該方法可在等溫條件下高效、特異、快速地完成。通過一系列的鏈置換擴增反應,能在1 h內將靶基因擴增109倍,當靶基因為RNA時,該方法還可通過在反應體系中添加反轉錄酶而實現對RNA的擴增。2020年2月24日國內尹秀山團隊[22]報道了一種基于逆轉錄環介導等溫擴增(reverse transcriptional loop-mediated isothermal amplification,RT-LAMP)技術的COVID-19檢測方法iLACO,可在15~40 min內快速檢測SARS-CoV-2,其靈敏度與qPCR檢測方法相當,并且iLACO帶有6個引物,能夠特異性地識別ORF1ab靶區的8個不同區域,由于引物設計的高度特異性,故不會產生假陽性結果。RT-PCR技術需2~43 h運行時間,特殊的試驗設備,可控的工作環境和訓練有素的操作人員。與RT-PCR技術相比,iLACO方法快速、靈敏,利于病毒檢測試驗的廣泛應用,特別是在設施有限的發展中國家。(2)核酸即時檢測(point-of-care testing,POCT) 也可以解釋為靠近患者床旁的核酸檢測,醫生、護士,甚至患者本人都可以操作,操作者可在短時間內完成核酸擴增、信號收集與結果分析,快速的現場檢測避免了標本采集、送檢等過多流程,縮短了病毒感染發現時間,可促進藥物早期的合理應用,是目前檢驗醫學中發展最快的領域之一。近年來,臨床對更快速、更廉價、更準確檢測技術的需求,推動這一市場不斷發展,現場PCR等各類分子檢測儀器設備也層出不窮。目前國內已經有企業應用核酸POCT技術研發出可用于快速篩查的核酸POCT產品。中科院蘇州醫工所研發出一套針對SARS-CoV-2的現場快速核酸檢測系統,可定性現場即時檢測SARS-CoV-2核酸,約45 min即可得出結果。這類產品的開發與應用,將大大提高COVID-19的診斷效率。SARS-CoV-2核酸檢測技術的特征及應用情況見表2。
2 血清學檢測
目前COVID-19診斷的金標準為病原學檢查,臨床最常見的為RT-PCR檢測,盡管RT-PCR檢測結果陽性可確診COVID-19,但由于各種原因存在假陰性可能,臨床出現過多次檢測結果為陰性之后復診為陽性的病例[23]。2020年1月17日WHO臨時指導意見建議,選擇血清檢測作為核酸檢測的補充,可選擇感染急性期血清和恢復期血清,結合血清特異抗體免疫球蛋白G(immunoglobulin G,IgG)/免疫球蛋白M(immunoglobulin M,IgM)檢測,可以明確患者近期或既往是否感染過SARS-CoV-2,有助于核酸檢測陰性但臨床癥狀疑似患者的進一步確診[24]。通常在患者感染SARS-CoV-2后第7天血清中出現lgM,18 d后快速消失,其結果受限于抗體產生的時間和SARS-CoV-2載量。IgG特異性抗體在感染后18 d顯著上升,且IgG陽性表明機體有感染,但不能區分是現癥感染還是既往感染。即IgG陽性者可能是現癥感染也可能是既往感染,但體內一旦產生抗體,就是感染過的標志。
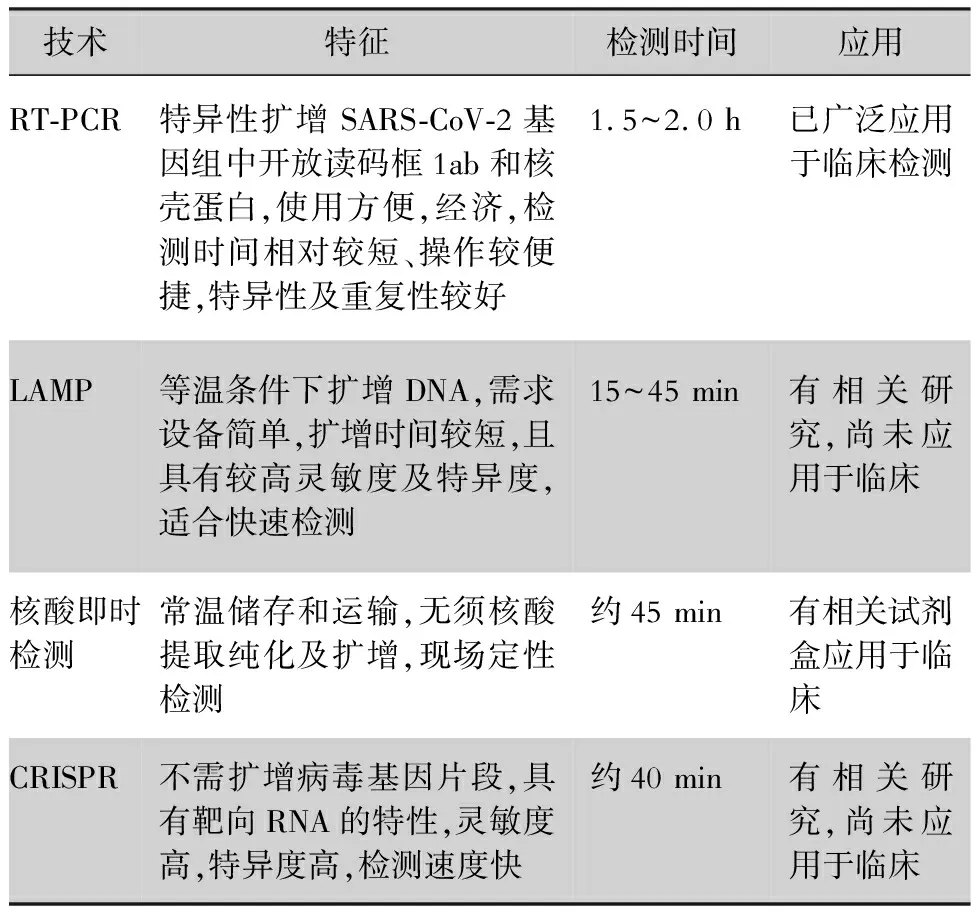
表2 幾種SARS-CoV-2核酸檢測技術特征及應用情況
目前國內上市的血清學檢測試劑盒是根據酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)、化學發光法、膠體金技術等研制。ELISA是利用酶標記抗原或抗體以檢測相應抗原或抗體的一種免疫學標記技術,具有靈敏度高、特異性強、重復性好、檢測速度快的特點,尤其適用于大批量標本檢測,是國際認可的標準化診斷方法。Li等[25]應用相當于SARS-CoV-2的核蛋白(nucleoprotein, N)不同區域合成肽免疫動物獲得多克隆和單克隆抗體,通過針對來自SARS-CoV-2、中東呼吸綜合征冠狀病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)和SARS-CoV核蛋白的蛋白質印跡分析評估SARS-CoV-2抗體的特異性,抗體用于SARS-CoV-2感染患者組織切片的免疫組織化學染色,可作為潛在的診斷工具。結果顯示多克隆抗SARS-CoV-2 NP抗體可以成功用作診斷SARS-CoV-2感染的工具。疫苗開發人員在制造參數優化過程中可用該研究建立的夾心法ELISA試劑盒檢測培養物中的病毒表達水平。
化學發光法是通過標記病毒的重組蛋白,捕獲血標本中的病毒抗體IgM或IgG,再使用偶聯劑堿性磷酸酶特異抗原識別抗體。加入底物后會產生光信號,化學發光儀器通過高靈敏度的光電倍增管(photomultiplier tube,PMT)捕獲光子,從而實現pg(皮克)級別的高靈敏度檢測,具有可檢測全血,標本采集感染風險低,操作簡單,檢測時間短,效率高及靈敏度高的特點。Cai等[26]報道了一種基于肽的磁性化學發光酶免疫法檢測血清中SARS-CoV-2的IgG和IgM抗體,該方法基于從基因組序列推導的20種候選肽中篩選出的S蛋白肽。使用合成肽作為抗原有助于增強測定的穩定性和可重復性,并且理論上比使用SARS-CoV-2作為抗原更具特異性。這種肽在檢測中顯示出非常好的特異性:感染SARS-CoV-2以外其他病原體的患者血清均未與該肽產生反應,這種高特異性可歸因于該區域與其他冠狀病毒相對低的同源性。檢測血清SARS-CoV-2特異性IgM和IgG抗體診斷COVID-19,結果發現,71.4%的患者檢測到特異性的IgG抗體,57.2%的患者檢測到特異性的IgM抗體,綜合兩種抗體,診斷陽性率提高至81.5%,此種檢測方法的特點為:在COVID-19患者血清中可同時檢測到特異性IgM和IgG。3月1日,由重慶醫科大學聯合企業研發的化學發光法SARS-CoV-2 IgM/IgG抗體檢測試劑盒獲得國家藥品監督管理局正式批準,許可上市,正式投入臨床應用。
膠體金技術檢測原理是以膠體金作為示蹤標志物標記鼠抗人IgM,同時硝酸纖維素膜上包被SARS-CoV-2抗原,利用膠體金免疫層析間接法的原理,檢測人血清中SARS-CoV-2 IgM抗體。該方法的特點是10 min內即可出結果,且易于觀察,僅憑肉眼即可判定是否陽性,適合大規模人群快速篩查。目前國內已有多家公司開發出膠體金技術檢測血清中SARS-CoV-2 IgG和IgM抗體的試劑盒,并已經開始應用于臨床。
血清抗體IgM/IgG結果聯合病毒核酸檢測可綜合分析SARS-CoV-2感染狀態,見表3。有助于COVID-19患者的早期發現和隔離,以及進一步快速確定其密切接觸者是否感染,利于更好地了解患者感染SARS-CoV-2的全部病程。2020年3月4日國家衛生健康委發布的《新型冠狀病毒肺炎診療方案(試行第七版)》[27]中,進一步明確了血清特異性IgM/IgG抗體聯合病毒核酸檢測在確診SARS-CoV-2感染的重要意義。
表3 SARS-CoV-2病毒核酸聯合血清特異性IgM/IgG抗體檢測結果的臨床意義
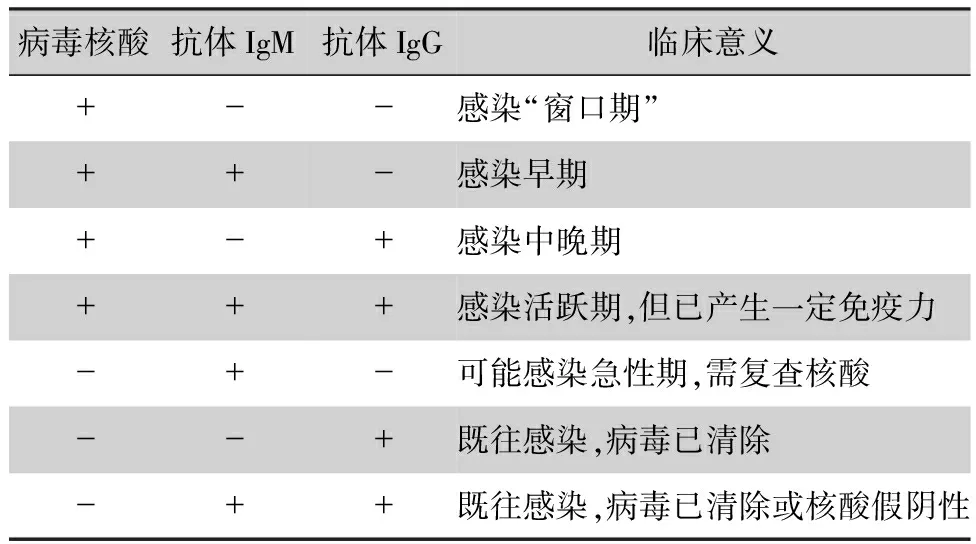
病毒核酸抗體IgM抗體IgG臨床意義+--感染“窗口期”++-感染早期+-+感染中晚期+++感染活躍期,但已產生一定免疫力-+-可能感染急性期,需復查核酸--+既往感染,病毒已清除-++既往感染,病毒已清除或核酸假陰性
注:+為陽性,-為陰性。
COVID-19患者早診斷、早隔離,對控制疫情尤為重要。目前臨床上確診COVID-19的金標準是SARS-CoV-2核酸檢測,但核酸檢測可出現假陰性。迄今為止,許多新開發的技術逐漸應用于SARS-CoV-2的檢測,這些新技術均有不同的優缺點,在實際應用中需根據特定檢測目的,合理選用檢測方法,以獲得最經濟、最優化的效果。如有必要也可將幾種方法相結合,以避免單一方法的弊端。隨著科學技術的飛速發展,相信未來將有更高效、更便捷、更精準的檢測方法應用于SARS-CoV-2的檢測,為臨床醫生和科研工作提供更多選擇。

