1,4-苯并二氧六環類木脂素合成進展
李孟穎,孫澍雨,夏亞穆
(青島科技大學 化工學院,山東 青島 266042)
1,4-苯并二氧六環類木脂素是一種3,7-環氧-8,4-氧新木脂烷類木脂素,是由一個苯丙素單元C3部分的C-7和C-8通過兩個氧原子分別和另一苯丙素單元C6部分的C-3和C-4相連接的一類新木脂素[1]。其中,Hydnocarpin(1)被鑒定為結腸腺癌(SW-480)細胞中Wnt/β-連環蛋白信號傳導途徑最有效的抑制劑之一[2];jatrocin B(2)通過抑制低密度脂蛋白(LDL)氧化能夠降低動脈粥樣硬化的發病幾率[3];雙氧木脂素A(3)可以作用于電壓門控鈉通道使昆蟲肌肉細胞內離子穩態被破壞,導致昆蟲軟癱麻痹死亡[4];Rodgersinine(4)可以通過抑制HCV非結構蛋白NS3和NS5A(HCV生命周期中關鍵蛋白)的表達起到抗HCV活性的作用[5](圖1)。這些1,4-苯并二氧六環類木脂素的生理活性引起了人們巨大的研究興趣。
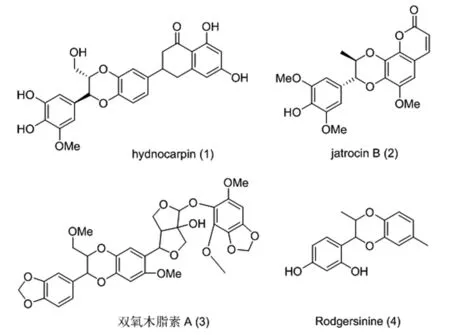
圖1 Hydnocarpin,jatrocin B,雙氧木脂素 A,Rodgersinine結構
Fig.1 The structural formula of Hydnocarpin,jatrocin B,dioxylignan A,Rodgersinine
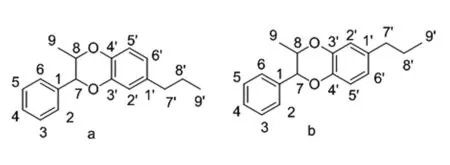
圖2 1,4-苯并二氧六環命名規則Fig.2 Nomenclature rules for 1,4-benzodioxane
根據IUPAC建議,1,4-苯并二氧六環母核的命名是在其中一個C6C3單元的C6部分從丙基取代位置開始依次編號為1~6,C3部分丙基位置從芳環取代位置依次編號7~9;另外一個C6C3單元編號相應的使用1'~6',7'~9'。因此普遍存在以下a,b兩種命名方式(圖2)。
1 1,4-苯丙二氧六環的生物合成
1.1 生物偶聯法
在生物體內,1,4-苯并二氧六環類木脂素的合成過程通常包括以下三個步驟[1]:(1)烯丙基酚經過酶的催化氧化形成酚自由基,(2)酚自由基經O-β偶聯(3)苯醌環合。其中步驟(2)和(3)不受酶催化控制,因此,通常情況下產物為立體和區域選擇性異構體的混合物。
1.2 仿生偶聯法
依據生物體內1,4-苯并二氧六環類木脂素的生物合成機制,Merlini和Zanarotti[6]利用Ag2O作為氧化偶聯劑構建了該類木脂素的第一種合成方法,并依此合成了(±)-eusiderin A(5)(圖3)。該方法利用Ag2O作為氧化劑,將具有α,β-不飽和雙鍵的苯酚衍生物(6)和兒茶酚衍生物(7)進行偶聯。此方法原料簡單易得,實驗步驟簡便易行,為批量制備此類木脂素提供了有利條件。She等人[7]用Ag2O作為偶聯劑,以85%的收率獲得isoamericanol A(8),能夠在MnO2的氧化下獲得(±)-isoamericanin A(9)(圖4)。
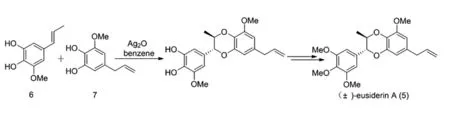
圖3 (±)-eusiderin A合成路線
Fig.3 Synthetic route of (±)-eusiderin A
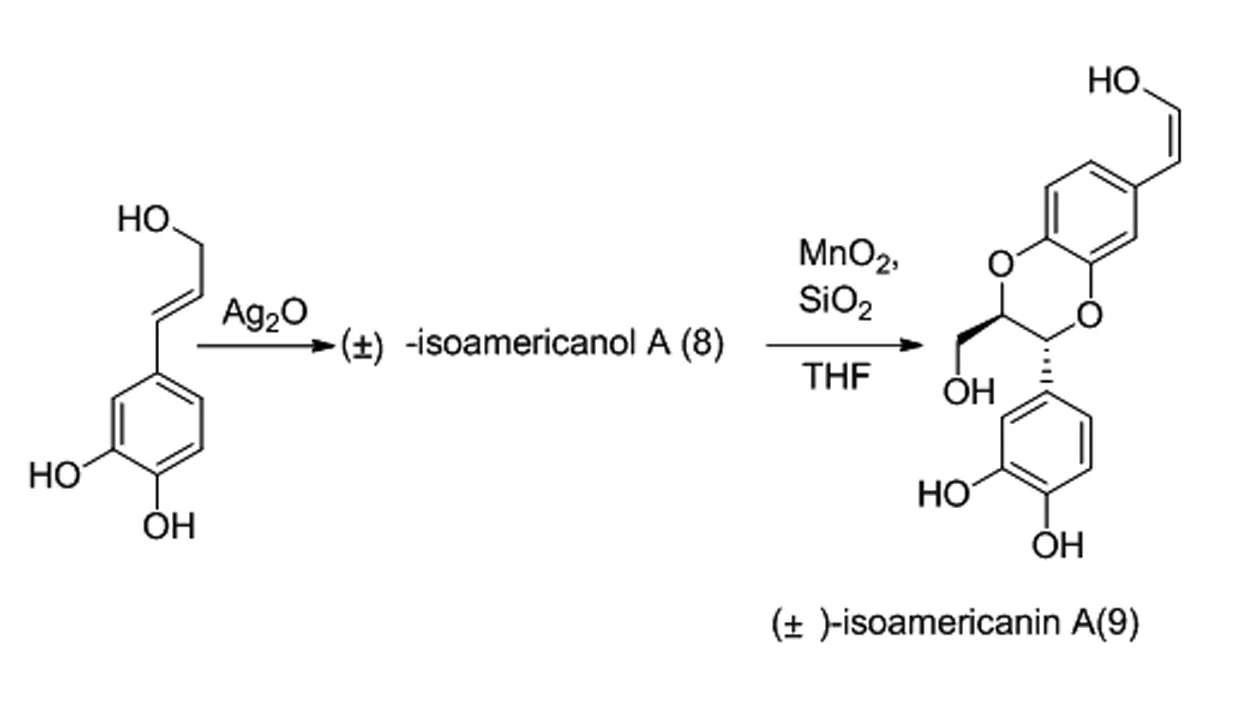
圖4 (±)-isoamericanol A (8),(±)-isoamericanin A (9)合成路線Fig.4 Synthetic route of (±)-isoamericanol A (8),(±)-isoamericanin A (9)
1.3 仿生偶聯法的進一步發展和應用
厙學功等人[8]用對羥基苯甲醛和咖啡酸甲酯作為主要原料,首次以K3[Fe(CN)6]作為氧化偶聯劑合成了天然化合物Sinaiticin。Althagafy HS[9]和M.Sefkow[10]分別就兩種氧化劑的反應機理作出研究(圖5)。
王小兵等人[11]發現在AC2O/Py體系下的鄰苯二酚類化合物和烯烴的偶聯反應,他們以3,4-二羥基-5-甲氧基苯丙烯(10)作為反應物,二氧六環作為溶劑,以33%的產率獲得1,4-苯并二氧六環化合物(11)(圖6)。該方法不需要惰性氣體保護等復雜的實驗操作步驟,反應時間較短,所用原料廉價易得。
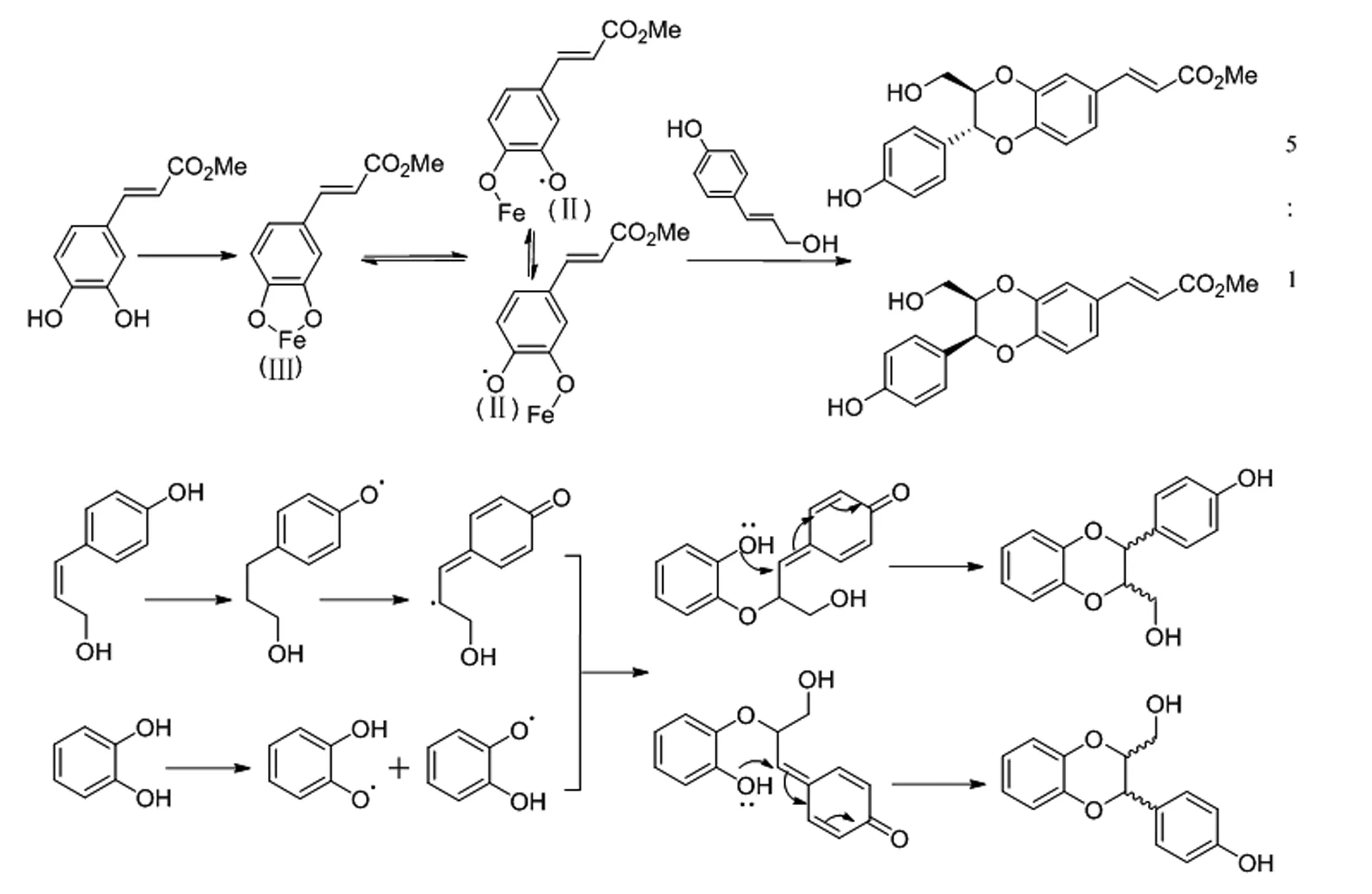
圖5 K3[Fe(CN)6]及Ag2O氧化機理
Fig.5 Oxidation mechanism of Ag2O and K3[Fe(CN)6]
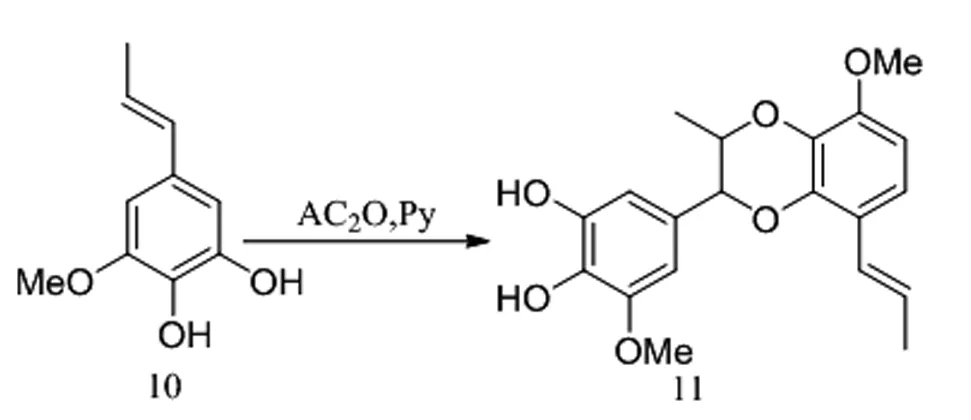
圖6 AC2O/Py體系下鄰苯二酚類化合物和烯烴的偶聯反應Fig.6 Coupling reaction of catechols and olefins in AC2O/Py system
2 1,4-苯丙二氧六環的化學合成
2.1 α-溴苯酮中的溴取代
H.Tanaka等人[12]以α-溴苯酮中的溴取代來合成1,4-苯并二氧六環類木脂素Cleomiscosinde(圖7)。之后,苗強[13]以2,4-二羥基苯丙酮(12)為主要原料,經溴代生成溴代產物13再與兒茶醛(14)在堿性條件下偶聯生成1,4-苯并二氧六環母核,再通過還原、Wittig反應、脫保護等步驟獲得外消旋的反式(15)和順式(16)Rodgersinine A及反式(17)和順式(18)Rodgersinine B(圖8)。
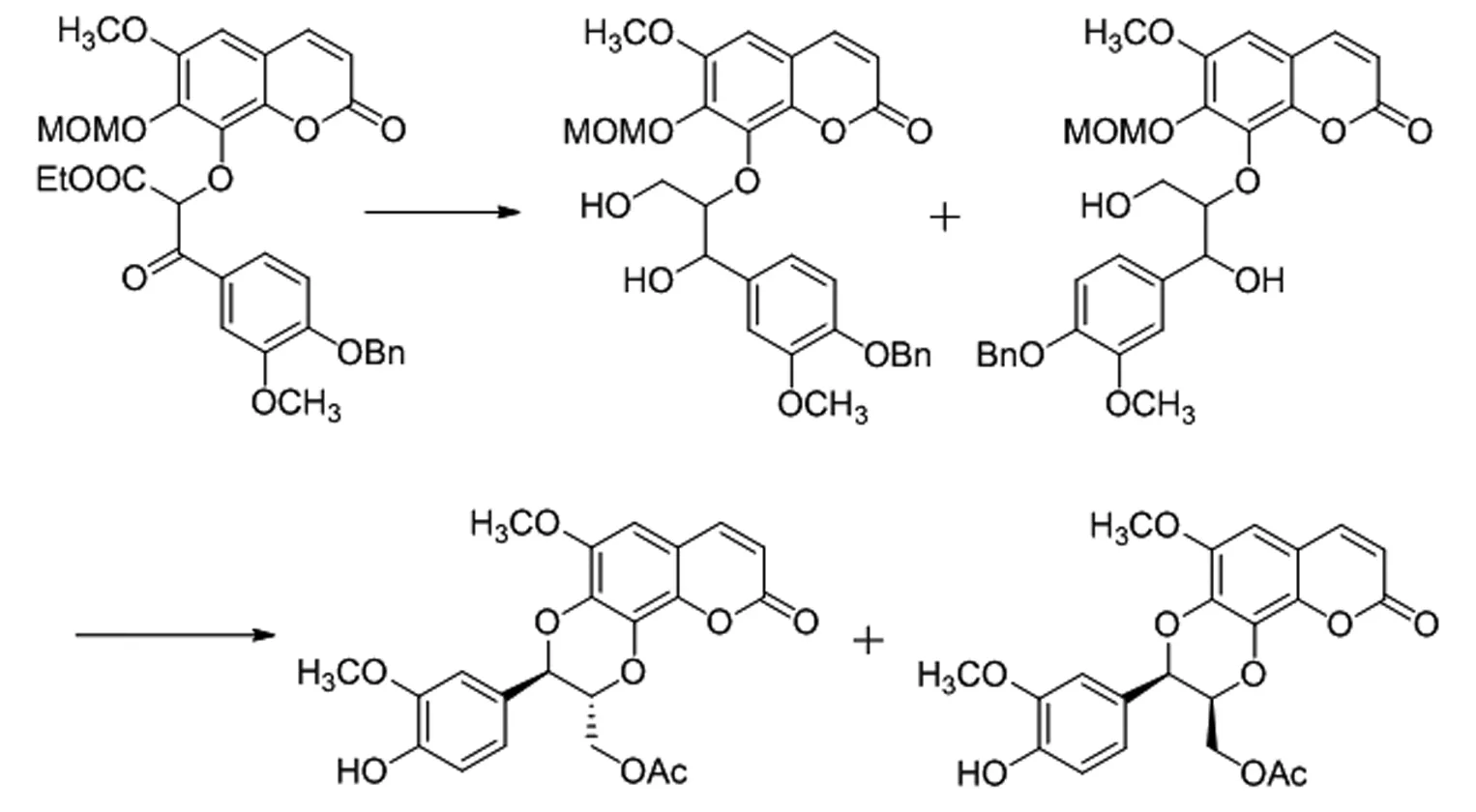
圖7 Clemiscosinde的合成路線
Fig.7 Synthetic route of Clemiscosinde
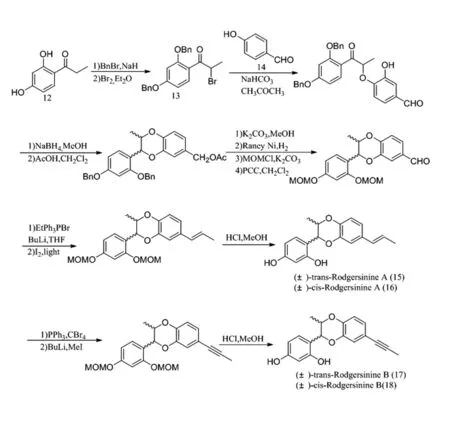
圖8 Rodgersinine A和Rodgersinine B的合成路線Fig.8 Synthetic route of Rodgersinine A and Rodgersinine B
2.2 1,2-環氧苯乙烷偶聯
H Tanaka等人[16-17]在此方法的基礎上改進,以1-苯基-1,2,3-丙三醇作為前體合成了1,4-苯并二氧六環產物。他們以咖啡酸25為原料,經酯化、MOM保護、還原,得到烯丙醇26。然后在乙酰丙酮氧釩存在的條件下,用TBHP進行環氧化,得到環氧化物27。在氫氧化鈉存在下,將27與苯酚28或29進行偶聯,分別得到30和31,用堿處理后得到環氧化物32和33,除去保護基團,然后在堿性條件下環化,得到1,4-苯并二氧六環母核34和35,再與化合物36反應,經酸化得到產物(±)-americanin A(37)及(±)-isoamericanin A(38)(圖10)。
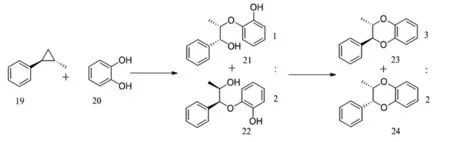
圖9 1,2-環氧苯乙烷偶聯反應
Fig.9 1,2-epoxybenzene oxide coupling
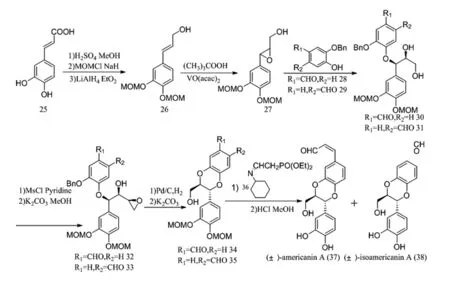
圖10 americanin A(37)及isoamericanin A(38)合成路線Fig.10 Synthetic route of (±)-americanin A(37) and (±)-isoamericanin A(38)
2.3 過渡金屬輔助法
過渡元素外層電子云具有未充滿的價層d軌道,因此在化學反應中能夠提供空軌道充當親電試劑,或是提供孤對電子充當親核試劑,降低反應活化能,促進反應進行[18]。目前,人們對利用過渡金屬輔助合成1,4-苯并二氧六環木脂素的方法開展了深入研究。
2.3.1 鈀催化的芳基鹵化物偶聯
Kuwabe[19]發現依靠鈀催化劑可以催化具有2-(2-溴苯氧基)-乙醇結構的化合物進行分子內偶聯,獲得1,4-苯并二氧六環,具有光學活性的此類結構可以通過鈀催化的方法獲得高對映體純度的產物。他們以甲苯作為溶劑,以(S)-1-(2-溴苯氧基)-2-己醇(39)作為原料,以碳酸銫充作高效無機堿,在醋酸鈀催化下,以80%產率95%ee獲得目標產物40(圖11)。
Shi等人[22]在此基礎上利用手性配體SDP(O)(41)及醋酸鈀催化2-(2-碘芐基)丙烷-1,3-二醇(42)進行分子內的偶聯反應,以96%ee獲得1,4-苯丙二氧六環母核43(圖12)。他們發現以SDP(O)作為手性配體比SDP獲得更高的產率及對映選擇性。目前該方法普遍用于2-羥甲基-1,4-苯并二氧六環的合成。
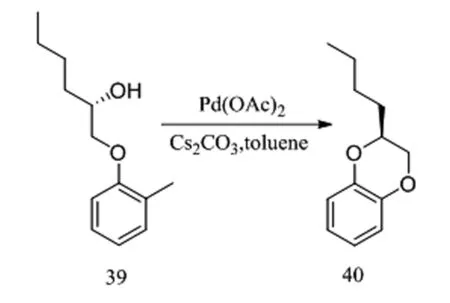
圖11 鈀催化的芳基鹵化物偶聯反應Fig.11 Palladium-catalyzed aryl halide coupling reaction
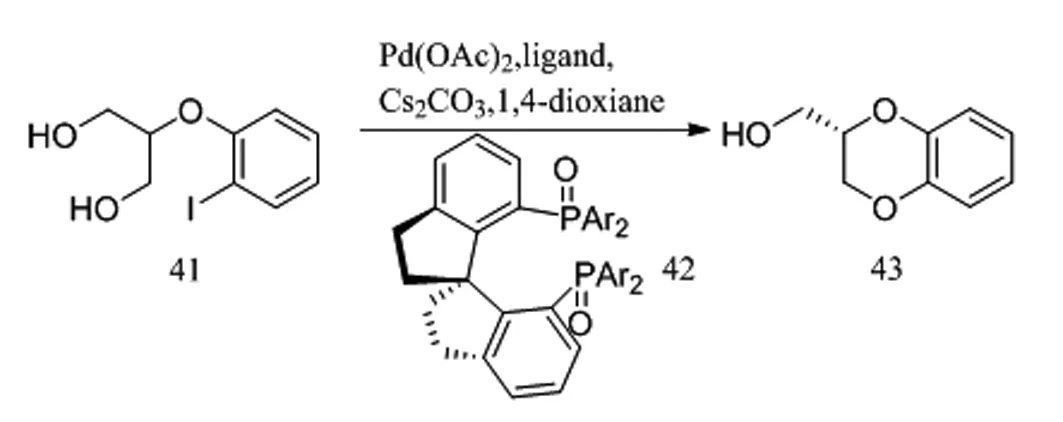
圖12 手性配體及醋酸鈀催化分子內的偶聯反應Fig.12 Chiral ligand and palladium acetate catalyzed intramolecular coupling reaction
2.3.2 鈀催化的烯丙基雙碳酸酯與二醇的偶聯
M.Massacrest等人[21]發現兒茶酚除了可以進行仿生偶聯外,還可以與烯丙基二碳酸酯在鈀催化下進行偶聯。他們利用兒茶酚與44、45、46分別進行反應,在(R)-BINAP配體存在條件下,以Pd2(dba)3作為催化劑,通過共同的反應中間體,最終以60%產率、37%ee獲得1,4-苯丙二氧六環母核47(圖13)。
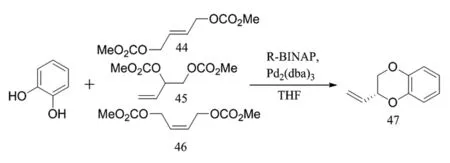
圖13 鈀催化下兒茶酚結構與烯丙基二碳酸酯偶聯反應Fig.13 Palladium-catalyzed coupling reaction of catechol structure with allyl dicarbonate
2.4 Mitsunobu反應在偶聯中應用
Mitsunobu反應是現代有機合成中常用的反應,通常是在三苯基膦和偶氮二甲酸二乙酯或偶氮二甲酸二異丙酯的共同作用下,在醇羥基和pKa<11的酸性化合物之間脫去一分子水形成新化學鍵的反應,是構建分子間和分子內C-O化學鍵的有效方法[22]。
L.I.Pilkington等人[23]首次將Mitsunobu反應應用于eusiderins A(53),B(54),C(55),G(56),L(57)和M(58)的不對稱合成。他們以香草醛(48)作為反應物,經取代、還原、保護、偶聯、水解、還原獲得手性醛49。向49中加入適當的芳基格氏試劑,經芐基醚的脫保護和環化,得到可分離的反式/順式混合的溴化物50,51和52。三者分別通過Suzuki交叉偶聯反應獲得53、55,54。反式/順式混合的溴化物50,51經還原、Wittig反應、還原分別獲得56、57,58(圖14)。他們在此基礎上利用芳基鋰取代芳基格氏試劑與醛進行縮合,在酸性條件下進行氫解、環化、添加側鏈,最終得到1,4-苯并二氧六環化合物trans-Rodgersinine A(15)、cis-Rodgersinine A(16)和trans-Rodgersinine B(17),cis-Rodgersinine B(18)(圖15)。
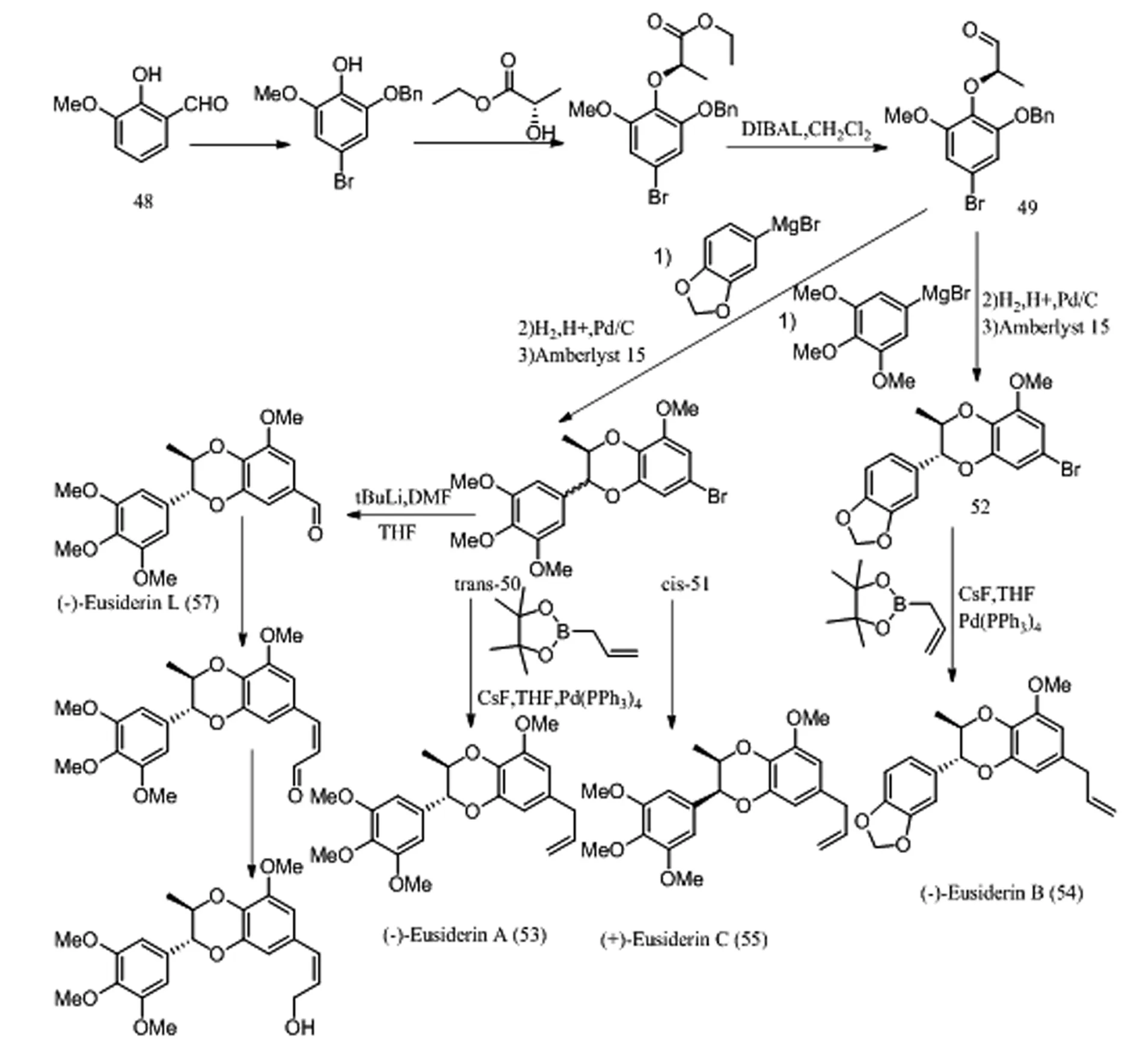
圖14 eusiderins A,B,C,G,L和M合成路線
Fig.14 Synthetic route of eusiderins A,B,C,G,L and M
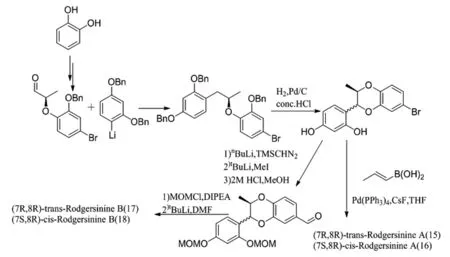
圖15 芳基鋰與醛縮合反應Fig.15 Condensation of aryl lithium with aldehyde
3 結語
近幾年來,隨著對自然界中植物研究的不斷加深,越來越多的天然化合物被提取、分離及鑒定。1,4-苯并二氧六環類木脂素生理活性優異,但是合成過程中存在結構復雜、需要多步保護及脫保護、反應位點較多、區域選擇性立體選擇性難以控制等問題。目前,1,4-苯并二氧六環類木脂素合成的三種方法中生物偶聯及仿生偶聯法主要通過改變氧化偶聯劑來實現閉環反應,化學合成法則主要依靠不同的反應物、反應條件及催化劑以實現高效、高區域選擇性和立體選擇性的合成。本文旨在綜述1,4-苯并二氧六環結構的合成方法,希望對從事類似化合物合成的科研人員有所裨益。

