款冬花飲片標準湯劑制備及其指紋圖譜研究△
許洪波,楊康,高春暉,毛晶晶, 4,蔡興航,張娛,許懷禮,張鷺,唐志書*
1.陜西中醫藥大學/陜西省中藥資源產業化協同創新中心,陜西 咸陽 712083;2.西安市中醫醫院,陜西 西安 710021;3.安康北醫大制藥股份有限公司,陜西 安康 725000;4.楊凌科森生物制藥有限責任公司,陜西 楊凌 712100
款冬花為菊科植物款冬TussliagofarfaraL.的干燥花蕾,始載于《神農本草經》[1-2]。款冬花味辛,性溫,歸肺經,具有潤肺下氣,止咳化痰的功效[1],是臨床常用中藥。2015版《中華人民共和國藥典》(以下簡稱《中國藥典》)收載含款冬花的制劑有13個,如二母安嗽丸、川貝雪梨膏等。現代藥理研究表明,款冬花對呼吸、消化系統有一定作用[3-4],此外,它還有鎮咳祛痰[5]和抗炎[6]等藥理作用。國內外研究表明,款冬花的化學成分主要為倍半萜[7-9]、黃酮[10-12]、生物堿[13-14]、皂苷[7]和揮發油[15-16]等,其中倍半萜類成分款冬酮 (tussilagone) 被認為是款冬花的特征成分,加之該化合物還具有抗炎、升壓等藥理作用[17-18],其作為指標成分被廣泛應用于款冬花的質量評價[18-19]。2015年版《中國藥典》即以款冬酮作為款冬花藥材和飲片的質量控制指標,并規定其量不得少于0.070%。
目前,隨著中藥飲片形式的創新發展,破壁飲片、配方顆粒等多種現代中藥用藥形式不斷出現,一定程度上彌補了傳統中藥飲片攜帶和服用不便的諸多缺陷。其中,中藥配方顆粒以“凈、便、小、恵、精、穩”的優勢正方興未艾,但配方顆粒至今仍無統一的質量標準,各廠家產品質量亦良莠不齊,故加強配方顆粒生產過程管控,統一質量標準顯得尤為重要[20]。2016年,國家藥典委員會發布了《中藥配方顆粒質量控制與標準制定技術要求(征求意見稿)》 (以下簡稱《要求》),提出將標準湯劑作為衡量中藥配方顆粒是否與臨床湯劑基本一致的標準參照物。中藥飲片標準湯劑是以中醫藥理論為指導、參考現代提取方法,經標準化工藝制備而成的單味中藥飲片水煎劑,可作為一種標準物質和標準體系,標化新型中藥制劑,保證其質量穩定、均一,確保臨床用藥的準確性和劑量的一致性[21]。與飲片相比,標準湯劑能夠體現煎煮工藝的影響;與配方顆粒相比,標準湯劑沒有輔料的干擾,更加接近臨床上直接服用的湯劑[22]。因此,《要求》中明確規定,中藥配方顆粒的所有藥學研究均須與標準湯劑進行對比,以保證與標準湯劑質量一致性。
本研究以花類飲片——款冬花為研究對象,進行其標準湯劑研究,以《要求》為指導原則,收集款冬花3個道地產區的15批飲片制備標準湯劑,考察標準湯劑出膏率,并建立其含量測定和指紋圖譜分析方法,計算指標成分的轉移率,以期為款冬花配方顆粒的制備和質量控制提供參考。
1 材料
1.1 儀器
島津LC-20A高效液相色譜儀 (包含CBM-20A控制器、SPD-20A紫外檢測器、LC-20AT雙泵、CTO-20A柱溫箱、LC-solution色譜工作站);SHZ-D型循環水式真空泵、OLSB-5L/10L低溫冷卻液循環泵 (鞏義市予華儀器有限責任公司);HT-2109型電磁爐 (美的生活電器制造有限公司);EYELA N-1100旋轉蒸發儀 (東京理化器械株式會社);KQ-300DE型數控超聲波清洗器 (昆山市超聲儀器有限公司);Zirbus-Vaco5冷凍干燥機 (德國Zirbus);CPA2250型電子天平 (賽多利斯,精度:0.01 mg)。
1.2 試藥
甲醇、乙腈為色譜純 (德國默克公司);實驗用水均為純凈水;款冬酮對照品 (中國食品藥品檢定研究院,批號:111884-201704,純度:99.1%);其余試劑均為分析純。
本研究共收集甘肅、內蒙古、河北3個產地共15批款冬花飲片,每個產地各5批,經陜西中醫藥大學藥學院王薇教授鑒定,同時按照《中國藥典》2015版一部款冬花項下薄層鑒別方法進行鑒別。結果表明,本研究所收集的15批款冬花飲片均為菊科植物款冬T.farfaraL.的干燥花蕾。15批樣品分別編號為:S1~S15,其中S1~S5的產地為甘肅,S6~S10的產地為內蒙古,S11~S15的產地為河北。
2 方法與結果
2.1 款冬花飲片浸出物測定
按照2015年版《中國藥典》中醇溶性浸出物測定法 (通則 2201) 項下的第二法進行測定,測得15批款冬花飲片的浸出物為20.9%~27.4%,平均浸出物為24.5%。結果表明,15批樣品均符合《中國藥典》關于款冬花飲片浸出物不得少于20.0%的規定。
2.2 款冬花飲片中款冬酮的含量測定
按《中國藥典》2015年版一部款冬花飲片項下含量測定方法進行檢測[1],得款冬酮質量分數為0.146%~0.420% (見表1),由結果可知,15批樣品均符合《中國藥典》中款冬花含量測定要求 (含款冬酮不得少于0.070%)。

表1 款冬花飲片測定結果 %
2.3 款冬花飲片標準湯劑的制備
取款冬花飲片50 g,加入12倍量水浸泡30 min,煎煮30 min,趁熱過濾,藥渣再加入10倍量水,煎煮20 min,過濾,合并濾液;減壓濃縮至適量,進行冷凍干燥,即得款冬花標準湯劑干燥粉末。
2.4 標準湯劑中款冬酮的含量測定
2.4.1 色譜條件 色譜柱為Thermo ODS Hypersil(250 mm×4.6 mm,5 μm),以甲醇-水(85∶15)為流動相[1];流速為1.0 mL·min-1;檢測波長為220 nm;柱溫為25 ℃;進樣20 μL。在此條件下,供試品溶液中款冬酮分離較好,其他成分無干擾 (見圖1)。
2.4.2 對照品溶液制備 精密稱定款冬酮對照品11.20 mg,加入流動相制成每1 mL含55.5 μg的溶液,即得。
2.4.3 供試品溶液制備 提取溶劑的篩選:在《中國藥典》方法的基礎上,比較使用甲醇和乙醇進行提取時的差異。1)藥典法[1]:取款冬花標準湯劑干燥粉末1.0 g,精密稱定后置具塞錐形瓶中,精確加入10 mL乙醇;稱質量,超聲處理1.5 h,放冷,再稱定質量,用乙醇補足減失的質量,搖勻,濾過,取續濾液測定。2)甲醇提取法:在上述方法基礎上,僅將溶劑乙醇換為甲醇。采用同批次樣品 (S5) 進行供試品制備,各制備3份供試品分別測定。結果表明,同批次樣品經2種方法制備供試品后,《中國藥典》方法所得樣品中款冬酮平均質量分數為0.011 9%,甲醇提取所得樣品中款冬酮平均質量分數為0.012 0%,含量無明顯差異。本研究以甲醇為提取溶劑 (見表2)。
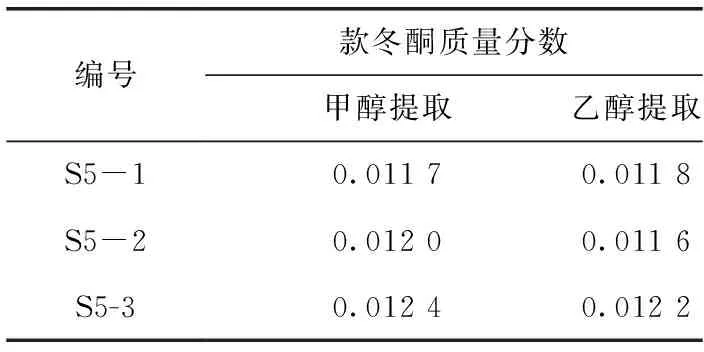
表2 不同提取方法款冬酮含量測定結果 %
2.4.4 線性關系考察 精密移取對照品溶液0.5、1、2、4、8、10 mL,分別置于10 mL容量瓶中,加甲醇定容,搖勻,按2.4.1方法進樣,分別測定款冬酮的峰面積,以進樣濃度 (μg·mL-1) 為橫坐標X,以峰面積為縱坐標Y,繪制標準曲線,得款冬酮回歸方程為Y=26 323.81X+ 48.927,r=0.999 9,線性范圍為2.78~55.50 μg·mL-1。
2.4.5 精密度試驗 取同一份款冬花飲片標準湯劑供試品溶液 (S5),按2.4.1色譜條件重復測定6次,計算款冬酮峰面積的RSD為0.79%。表明儀器精密度良好。
2.4.6 穩定性試驗 取同一份款冬花飲片標準湯劑供試品溶液 (S5),分別在第0、2、4、8、12、24 h測定,計算款冬酮峰面積的RSD為2.42%。表明供試品溶液在24 h內穩定性良好。
2.4.7 重復性試驗 按照2.4.3方法平行制備6份供試品溶液 (S5),按2.4.1色譜條件測定,計算款冬酮峰面積的RSD為2.74%。表明建立的方法重復性良好。
2.4.8 加樣回收試驗 取已知含量的款冬花飲片標準湯劑樣品 (S5) 6份,精密稱定,加入相同量的款冬酮,按照2.4.3項下方法制備供試品溶液,再按照2.4.1方法測定。計算供試品溶液中款冬酮回收率為97.64%~101.10%,平均加樣回收率為99.53%,RSD為1.30%,表明該方法的準確度良好。
2.5 款冬花標準湯劑出膏率及轉移率
2.5.1 出膏率 本研究通過2.3項下方法制備款冬花標準湯劑干浸膏,按公式(1)計算出膏率(見表3)。結果表明,15批款冬花出膏率為25.20%~44.08%,平均值為36.41%,RSD為4.21%。
出膏率=(干膏質量/飲片質量)×100%
(1)
2.5.2 款冬酮轉移率 按照公式(2)計算指標成分款冬酮的轉移率 (見表3),結果表明:15批款冬花標準湯劑中指標成分款冬酮的轉移率為0.60%~3.85%,平均轉移率為2.01%。
轉移率=(標準湯劑中款冬酮含量×出膏率)/飲片中款冬酮含量×100%
(2)
2.5.3 款冬花標準湯劑制備數據 根據以上建立的色譜方法,對15批款冬花標準湯劑進行測定,結果見表3。
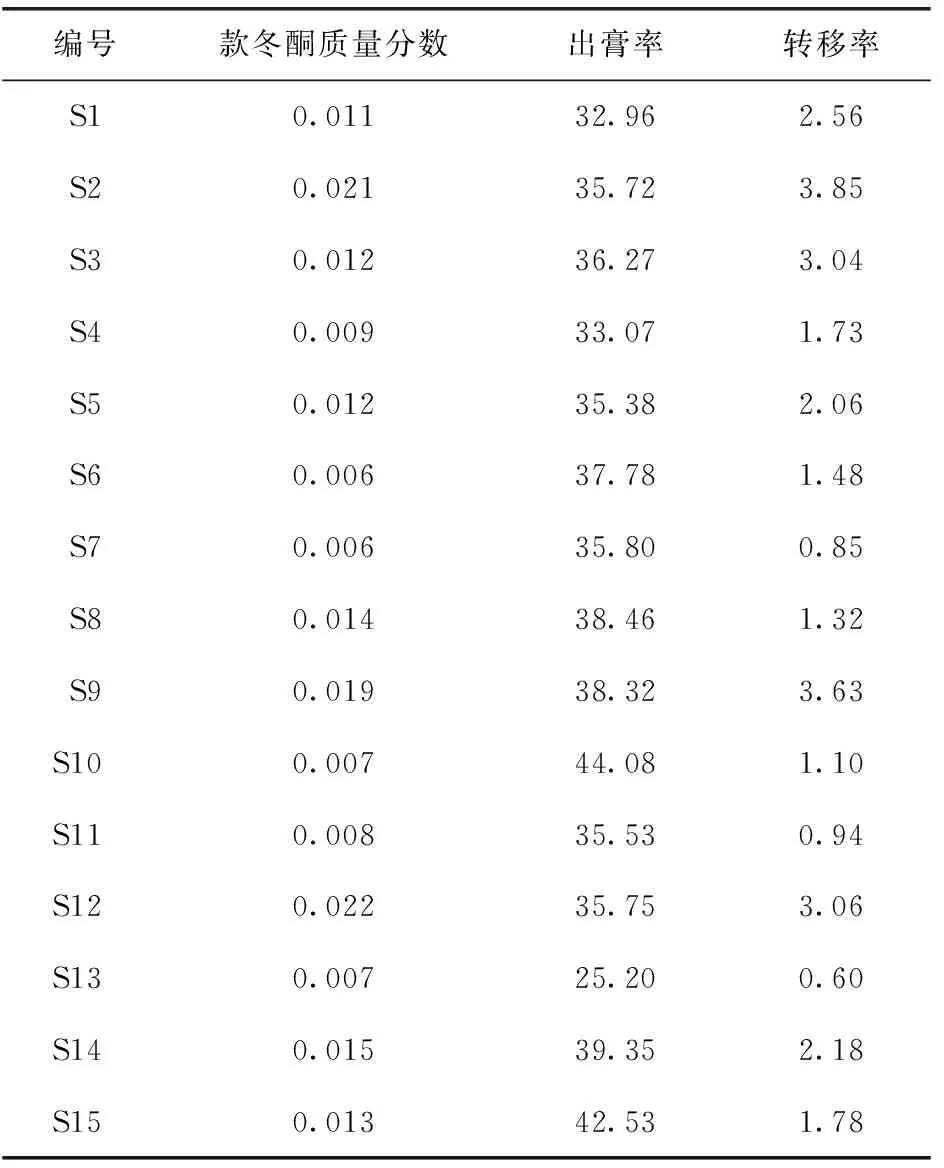
表3 款冬花飲片標準湯劑測定結果 %
2.6 指紋圖譜的建立
2.6.1 色譜條件 色譜柱為Thermo ODS Hypersil(250 mm×4.6 mm,5 μm);流動相為0.03%甲酸溶液 (A) 和乙腈 (B),梯度洗脫 (0~15 min,3%~15%B;15~20 min,15%~25%B;20~21 min,25%~35%B;21~30 min,35%~85%B;35 min,100%B);流速為1 mL·min-1;柱溫為25 ℃;檢測波長為240 nm[18],進樣5 μL,測定,記錄對照品和供試品色譜圖 (見圖2)。
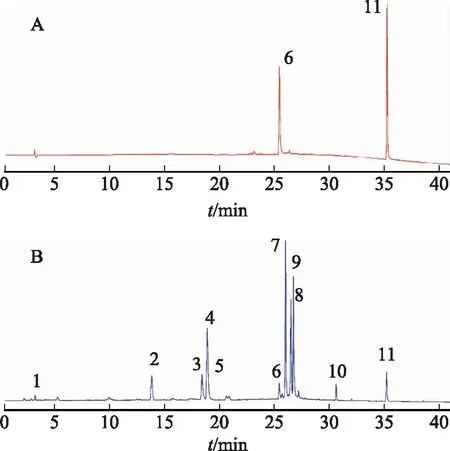
注:A.混合對照品;B.款冬花標準湯劑供試品;6.蘆丁;11.款冬酮。圖2 混合對照品、款冬花標準湯劑供試品HPLC 圖
2.6.2 混合對照品溶液的制備 精密稱取款冬酮和蘆丁對照品適量,置于容量瓶中,用甲醇溶解定容,配置成每1 mL溶液含25 μg款冬酮、20 μg蘆丁的混合對照品溶液。
2.6.3 供試品溶液的制備 按照2.4.3項下方法制備,即得。
2.6.4 方法學考察 精密度試驗:取同一份款冬花飲片標準湯劑樣品 (S5),按照2.6.1項下色譜方法連續進樣6次,記錄色譜圖,并以款冬酮色譜峰為參照峰 (11號峰),結果顯示:各共有峰相對保留時間和相對峰面積的RSD均小于1.35%,表明儀器精密度良好。
穩定性試驗:取同一份款冬花飲片標準湯劑樣品 (S5),分別在0、2、4、8、12、24 h 按2.6.1項下條件進樣測定。以款冬酮色譜峰為參照峰 (11號峰),計算各共有峰相對保留時間和相對峰面積的RSD,結果表明,各共有峰相對保留時間和相對峰面積的RSD均小于3.0%,表明款冬花標準湯劑供試品溶液在24 h內穩定性良好。
重復性試驗:取同一份款冬花飲片標準湯劑樣品 (S5) 6 份,按2.6.3項下方法制備供試品溶液,按照2.6.1項下條件測定,以款冬酮色譜峰為參照峰 (11號峰),結果表明:各共有峰相對保留時間和相對峰面積的RSD 均小于2.7%,表明該方法重復性良好 (RSD<3%)。
2.6.5 樣品檢測及分析 取上述15批款冬花飲片標準湯劑,分別按2.6.3項下方法制備供試品溶液,再按2.6.1項下色譜條件測定,記錄色譜圖。將15 批供試品色譜圖分別導入“中藥色譜指紋圖譜相似度評價軟件”(版本:2012.130723),時間窗設為0.1,采用中位數法生成對照指紋圖譜 (見圖3),其中共有峰11個,通過對照品比對指認2個,分別是6號峰 (蘆丁) 和11號峰 (款冬酮)。S1~S15指紋圖譜與共有模式對照指紋圖譜相似度分別為:0.937、0.990、0.981、0.996、0.990、0.992、0.963、0.981、0.986、0.983、0.992、0.988、0.983、0.981、0.994,均在0.90以上,符合指紋圖譜相似度要求,表明各批次款冬花飲片標準湯劑具有較好的一致性 (見表4)。
3 討論
湯劑是中醫臨床最常用的傳統劑型之一,在治療和預防疾病方面發揮著重要作用。但傳統湯劑煎煮工藝粗放、攜帶服用不便、質量不均和監管困難等問題也日益凸顯,特別是《中國藥典》規定的藥材及飲片質量標準難以直接反映湯劑的質量,因此開展湯劑標準化研究對于中藥的臨床應用具有重要意義[23]。2016 年,陳士林等[24]提出采用中藥飲片標準湯劑來標化不同用藥形式,以提高臨床用藥的準確性和療效的一致性。中藥飲片標準湯劑的制備必須以中醫藥理論為指導,與臨床實際應用保持一致 (傳統用藥習慣、煎煮方法及服用方法等)。同年,國家藥典委員會發布了《中藥配方顆粒質量控制與標準制定技術要求 (征求意見稿)》為中藥飲片標準湯劑的研究提供了重要參考依據。

注:A.款冬花飲片標準湯劑指紋圖譜;B.對照指紋圖譜。圖3 15批款冬花飲片標準湯劑HPLC指紋圖譜及其對照指紋圖譜
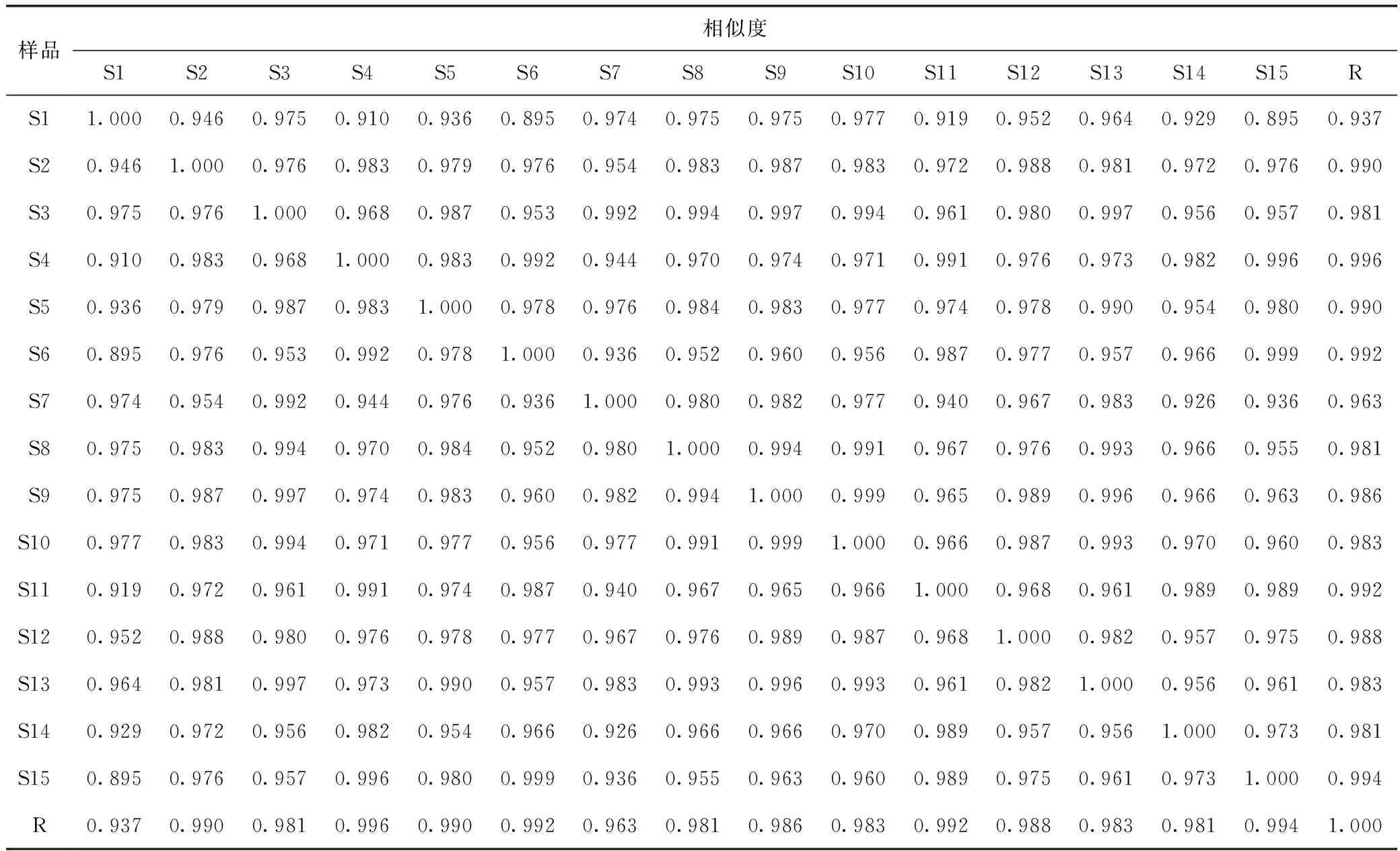
表4 15批款冬花飲片標準湯劑指紋圖譜相似度
本研究所采用的款冬花飲片標準湯劑制備工藝是遵照《要求》中的相關規定,經煎煮、固液分離、低溫減壓濃縮、冷凍干燥后制得。本研究共收集了3個產地15批款冬花飲片樣品,樣品具有一定的代表性。在實驗前對飲片進行了檢測,樣品符合2015年版《中國藥典》款冬花中的規定,同時在標準湯劑的制備過程中遵循統一的標準化操作,以保障所得標準湯劑具備衡量臨床不同用藥形式的能力。
款冬花中含有的特征性成分為倍半萜類化合物,目前,已從款冬花中發現的此類化合物僅有10余個,其中款冬酮為此類型成分中含量較高的化合物[25],2015 年版《中國藥典》將款冬酮作為款冬花藥材和飲片含量測定的指標成分,并規定該成分質量分數不得少于0.070%。考慮到款冬酮的特征性及與《中國藥典》中款冬花飲片含量測定的一致性,本研究選擇款冬酮作為指標成分,用于款冬花飲片標準湯劑質量標準的建立。但實驗結果表明,以款冬酮計算的15批款冬花飲片標準湯劑轉移率為0.60%~3.85%,平均轉移率為2.01%,轉移率較低,這與文獻報道的脂溶性成分在標準湯劑中的轉移率較低相一致[23,26]。該結果進一步提示,在中藥產品如標準湯劑和配方顆粒等的質量控制中,要充分考慮到產品的組成成分與藥材或飲片不同,其質量評價方法不能完全參照《中國藥典》規定的藥材或飲片的質控方法,特別是選擇脂溶性成分為指標時,需要慎重。
此前,關于款冬花多指標成分含量測定及指紋圖譜的研究雖已有報道[18,27],但研究多針對其醇提取部位,未能較好地反映其傳統用藥形式——湯液的質量。本研究構建了款冬花水煎液的HPLC指紋圖譜方法,結果表明該方法簡便準確、重復性好,可用于款冬花標準湯劑的質量控制。通過對15批款冬花飲片標準湯劑指紋圖譜進行比較發現,其共有峰11個,且相似度良好,表明所得款冬花標準湯劑化學輪廓相似度高。
總之,本研究根據《要求》中相關描述,確定了款冬花標準湯劑制備的相應工藝參數,制備了15批不同產地的款冬花飲片標準湯劑,并從指標性成分的測定及其轉移率、出膏率和指紋圖譜建立方面進行了系統研究,研究結果可為款冬花標準湯劑和配方顆粒的制備及質量控制提供參考,同時也為款冬花的不同臨床用藥形式之間的評價提供數據資料。

