圖示法推導標準電極電勢與平衡常數關系初探*
游 丹,王會生
(1 武漢工程大學郵電信息學院,湖北 武漢 430073;2 武漢工程大學化學與環境工程學院,湖北 武漢 430205)
對于大一新生來說,通過能斯特方程計算有關電極的標準電極電勢會存在畏難心理,且學習效果不理想[1-3]。在無機化學教材中,涉及標準電極電勢的計算有很多,如弱電解質、難溶電解質及配離子電解質等。教學中發現,學生往往不能有效的把氧化還原平衡那章有關能斯特方程的理論很好的應用到這些非簡單離子對構成的電極的標準電極電勢計算上,認為這些知識點非常雜亂,從而導致部分學生在這方面計算時出現大量的丟分,教學效果很不理想。一般的無機化學教材在推導這些電對標準電極電勢與其平衡常數關系時[4-5],介紹了兩種方法:(1)直接由相關電對推導;(2)由待求電對與相關電對組成原電池推導。第一種方法估計也是多數高校教師采用的方法,它要把這些弱電解質、難溶電解質和配離子的電對標準態看成由相應簡單離子構成的電對非標準態,然后由能斯特方程推導出弱電解質、難溶電解質和配離子電極的標準電極電勢φ?與其相應的簡單離子的φ的關系。我們認為,學生難以進行這些計算的根源在于他們對弱電解質、難溶電解質和配離子電極的標準電極電勢φ?等于它們所對應的簡單離子的非標準電極電勢φ這一概念不能真正理解,導致很多學生不會使用上述轉換關系,轉而采取機械的記憶方式;然而,這不容易記牢,而在考試時又不會推導,從而導致許多該類型題目丟分。第二種方法,要把待求的電對和相關的標準電對建立成原電池推導,同樣很多學生在考試時不會通過建立原電池推導相應公式,因為對于大多數學生來說,他們又不那么善于建立原電池。總之,關于這幾類電解質標準電極電勢的計算成為無機化學中一個很大的教學難點,需要引起參與無機化學教學的老師關注。在本文中,我們嘗試了使用圖示的方法進行推導弱電解質、難溶電解質及配離子所形成的電對的標準電極電勢與其平衡常數的關系,該方法較為直觀,學生一目了然,容易掌握。
1 問題的提出
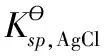
方法是在金屬銀與硝酸銀溶液組成的半電池加入HCl,直到溶液中c(Cl-)為1.0 mol·L-1,
這時半電池中存在兩種反應,一是電極反應,二是AgCl的沉淀反應。達到平衡時:


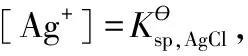

方法是用電對[Cu(NH3)4]2+/Cu與Cu2+/Cu設計如下原電池:
(-)Cu︱Cu2+(1.0 mol·L-1)║[Cu(NH3)4]2+(1.0 mol·L-1),NH3(1.0 mol·L-1)︱Cu(+)
正極反應:

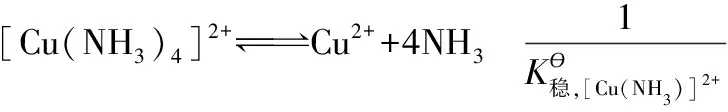
由原電池標準電動勢E?與原電池反應的平衡常數K?的關系:

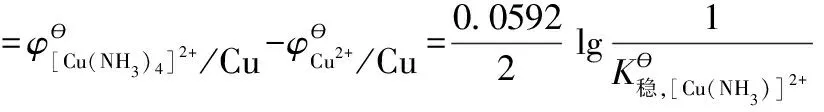
因此有:
弱電解質、難溶電解質及配離子所形成的電對的標準電極電勢與其平衡常數的關系實質是體系生成弱電解質或沉淀或配離子引起相關離子濃度變化,從而引起電極電勢的改變, 即離子濃度對電極電勢的影響,這是氧化還原平衡的重點。由待求電對與相關電對組成原電池推導弱電解質、難溶電解質及配離子所形成的電對的標準電極電勢與其平衡常數的關系的方法涉及氧化還原的多個知識點,但卻忽略了離子濃度對電極電勢的影響這一重點。不利學生掌握這一重要的知識點。
為解決教學中出現的問題,我們探索了用圖示的方法推導弱電解質、難溶電解質及配離子所形成的電對的標準電極電勢與其平衡常數的關系。在教學中采用這一方法,發現方法直觀,學生易懂,突出了濃度對電極電勢的影響,即能斯特方程的應用。
2 圖示推導方法
圖示推導方法需要三個步驟:
(1)設計用于講解的相關示意圖;
(2)由圖列出體系的電極反應并寫出相關的能斯特方程,重點指出同一溶液中僅有一個電極電勢;
(3)推導相關電對標準電極電勢與其平衡常數的關系。
現用實例介紹圖示推導方法的教學。
2.1 沉淀生成對電極電勢的影響
(1)設計示意圖
在盛有Fe(OH)3和Fe(OH)2沉淀的溶液的燒杯中插入鉑絲,溶液中必存在Fe3+、Fe2+和OH-離子,如圖1所示。
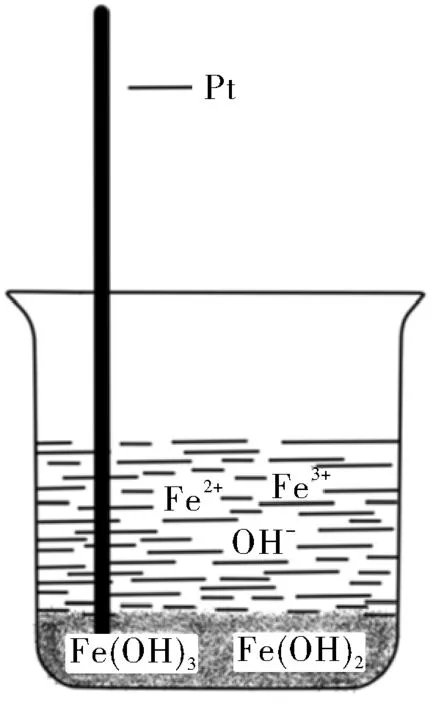
圖1 沉淀生成對電極電勢的影響示意圖
(2)寫出體系有關電對的電極反應和相關的能斯特方程
體系一定存在Fe3+/Fe2+和Fe(OH)3/Fe(OH)2兩個電對。
電對Fe3+/Fe2+:

電對Fe(OH)3/Fe(OH)2:

電對Fe3+/Fe2+和電對Fe(OH)3/Fe(OH)2在同一體系,這一體系只有一個電極電勢值,因此兩個電對的電極電勢值相等,即φFe3+/Fe2+=φFe(OH)3/Fe(OH)2。
因此,當cOH-=1.0 mol·L-,即[OH-]=1.0時,即金屬難溶電極處于標準狀態時,
(3)推導電對Fe(OH)3/Fe(OH)2標準電極電勢與其平衡常數的關系,因為:
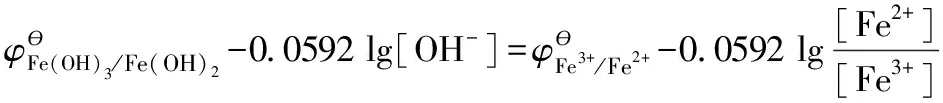
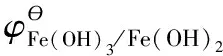
當沉淀溶解反應達到平衡,則有:
可見平衡體系。電對Fe(OH)3/Fe(OH)2標準電極電勢與電對Fe3+/Fe2+的標準電極電勢及有關的溶度積常數有關。因此生成沉淀后溶度積常數是影響電極電勢的主要因素。電對的氧化型物質生成沉淀電極電勢下降,生成沉淀的溶度積常數越小,電極電勢下降得越多。而電對的還原型物質生成沉淀電極電勢上升,生成沉淀的溶度積常數越小,電極電勢上升得越多。
2.2 弱電解質生成對電極電勢的影響
(1)設計示意圖
將氫電極的溶液換成HAc溶液。溶液中必存在H+、Ac-離子和HAc,如圖2所示。
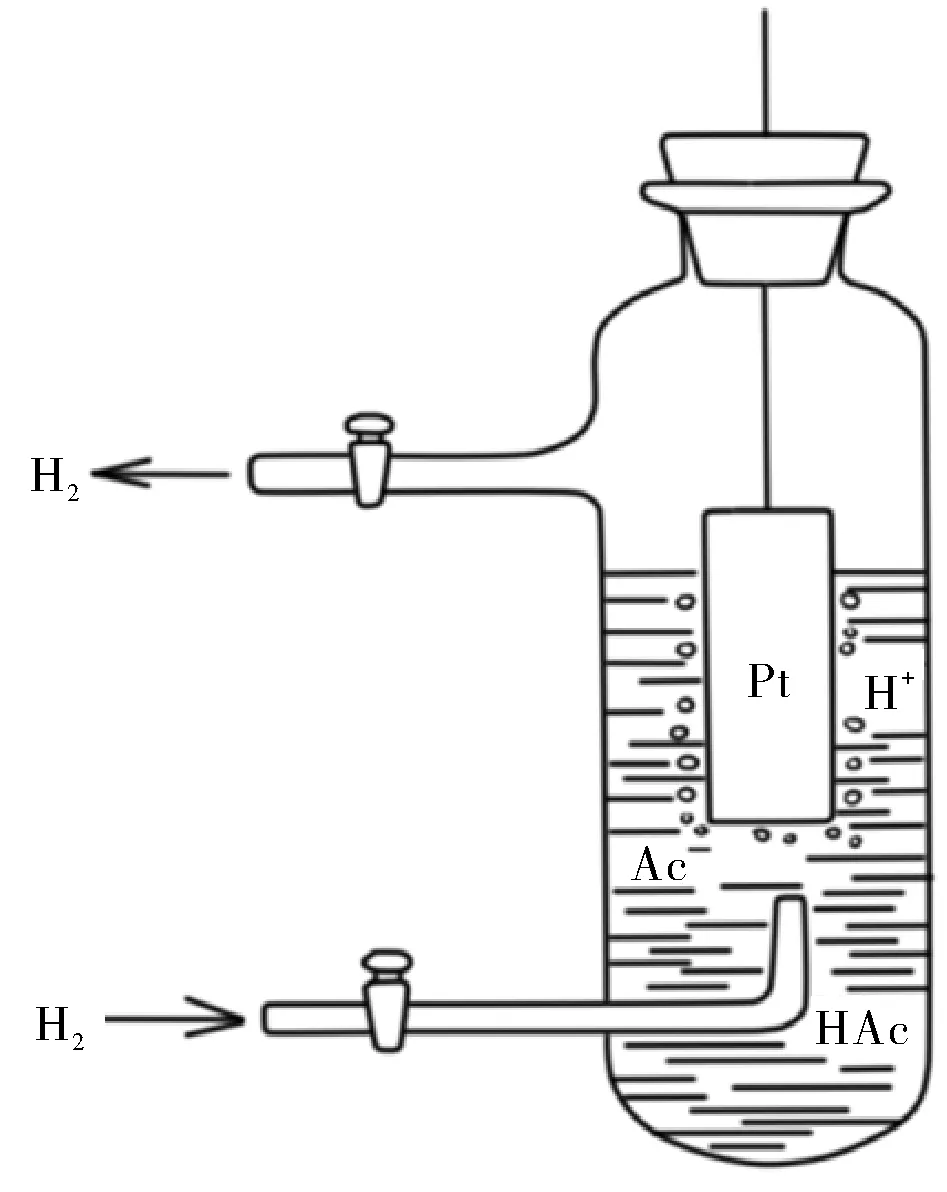
圖2 弱電解質生成對標準電極電勢的影響示意圖
(2)寫出體系有關電對的電極反應和相關的能斯特方程
體系一定存在H+/H2和HAc/H2兩個電對。
電對H+/H2:

電對H+/H2和電對HAc/H2在同一體系,這一體系只有一個電極電勢值,因此兩個電對的電極電勢值相等,φH+/H2=φHAc/H2。

(3)推導電對HAc/H2標準電極電勢與其平衡常數的關系
因為:


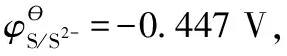

圖3 配離子生成對電極電勢的影響示意圖
2.3 配離子生成對電極電勢的影響
(1)設計示意圖
在有[Co(NH3)6]3+、[Co(NH3)6]2+配離子存在的溶液的燒杯中插入鉑絲,溶液中必存在Co3+、Co2+、[Co(NH3)6]3+和[Co(NH3)6]2+離子及NH3分子,如圖3所示。
(2)寫出體系有關電對的電極反應和相關的能斯特方程
體系一定存在Co3+/Co2+和[Co(NH3)6]3+/[Co(NH3)6]2+兩個電對。
電對Co3+/Co2+:
電對[Co(NH3)6]3+/[Co(NH3)6]2+:
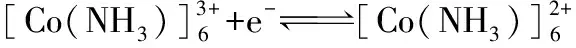
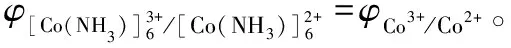
因此,當c[Co(NH3)6]3+=c[Co(NH3)6]+時(此例是電對氧化型和還原型同時生成配離子,且配位體數相同,因此只需要求c[Co(NH3)6]3+=c[Co(NH3)6]+,且與溶液中NH3的濃度無關,否則溶液中所有配離子和配位體的濃度必需為1.0 mol·L-1,即配離子電極處于標準狀態),
(3)推導電對[Co(NH3)6]3+/[Co(NH3)6]2+標準電極電勢與其平衡常數的關系
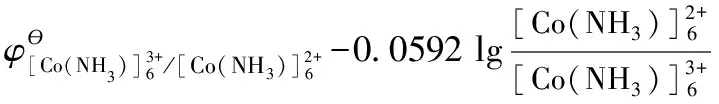
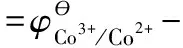
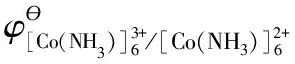
3 特 點
在教學時,用圖示法講解推導弱電解質、難溶電解質及配離子所形成的電對的標準電極電勢與其平衡常數的關系與直接由相關電對推導及由待求電對與相關電對組成原電池推導相比,我們認為圖示推導方法用于教學有如下特點。
(1)直觀,學生一目了然。在示意圖中學生能清楚地看到體系中與推導有關的物質;并清楚地了解體系中只有一個電極,因此體系只有一個電極電勢值,不能體系有多少電對,它們的電極電勢應相同。這就比較容易解釋兩個電對的電極電勢相等的問題。
(2)明確了為何這三種電解質的φ?等于它們相應簡單陽離子的φ。通過圖示法清楚地表明了,在一個體系中僅有一個電極電勢。此外,通過這些圖示法推導的示例可見,整個推導過程都只一個知識點:濃度對電極電勢的影響,即能斯特方程的應用。生成弱電解質、難溶電解質及配離子影響電極電勢只是溶液中物質的濃度,而與參與電極反應的固體、氣體無關,當電對的氧化型和還原型物質都生成配離子,且配體的個數相同,則配體的濃度不影響電極電勢。這樣學生就容易理解生成弱電解質、難溶電解質及配離子影響電極電勢是因為溶液中電對氧化型和還原型離子濃度的改變,并通過推導直接說明了只有當弱電解質電極,難溶電極和配離子電極處于標準狀態,即電對的電極反應中所有物質的濃度為1.0 mol·L-1,氣體分壓為100 kPa,其標準電極電勢與其對應的電對的非標準狀態的電極電勢相等。

4 結 語
我們對2017級和2018級兩屆學生使用該方法教學,并對他們的期末考試成績進行分析。研究發現,使用圖示法推導標準電極電勢與平衡常數關系教學后,學生的學習興趣和學習積極性有明顯提升,對這些電解質標準電極電勢的認識也更加清晰。通過統計相關電極電勢計算題目的分數發現,能拿到該類題目80%以上分數的學生人數占總人數71.2%。在卷面難度相當情況下,這比使用該方法之前,僅60%學生能拿到這個分數的比率約提高11%。此外,該類題目滿分學生約占總人數23%,這比使用該教學方法前大約提高5%。

