腺苷預處理對大鼠腦缺血再灌注損傷后Caspase-3的表達及細胞凋亡的影響
龐艷利,許二妮,尉娜,殷闖,譚軍
1新鄉醫學院第三臨床學院,河南新鄉 453003;2新鄉醫學院第三附屬醫院
腦卒中是神經內科常見病、多發病,是導致患者死亡和殘疾的主要原因,其中缺血性腦卒中占全部腦卒中的80%以上[1,2]。對于缺血性腦卒中的治療,目前臨床除了一般抗血小板、穩定斑塊、腦保護等治療外,還應用靜脈溶栓及機械取栓術以恢復腦組織的血流,達到挽救缺血半暗帶,減少最終梗死面積,并改善臨床預后的目的。然而血流再通后部分患者神經功能缺損嚴重程度沒有任何改善,甚至可能進一步惡化,即缺血再灌注損傷[3]。以往研究表明缺血再灌注損傷可加重腦卒中的嚴重程度,腺苷預處理可減輕缺血再灌注損傷[4~6],細胞凋亡是缺血再灌注損傷的機制之一[7]。為此,本研究就腺苷預處理對大鼠大腦中動脈腦缺血再灌注損傷后Caspase-3的表達及細胞凋亡的影響進行了探討。
1 材料與方法
1.1 材料 75只健康雄性SD大鼠,體質量250~280 g,由新鄉醫學院動物中心提供,飼養于溫濕度適宜、通風良好的動物房內,自由飲食、水。其他材料有:MCAO栓線(型號2636-A4,北京西濃科技有限公司)、腺苷、2,3,5-三苯基氯化四氮唑(TTC)(索萊寶科技有限公司)、抗Caspase-3抗體(英國Cohesion Biosciences公司)、兔SP試劑盒(北京中衫金橋生物技術有限公司)、TUNEL細胞凋亡檢測試劑盒、DAB辣根過氧化物酶顯色試劑盒(碧云天生物技術有限公司)、顯微鏡(尼康儀器有限公司)。
1.2 動物分組及造模前準備 采用隨機數字表法,將75只雄性Sprague-Dawley大鼠分為假手術組(Sham組)、缺血再灌注組(IR組)及腺苷預處理缺血再灌注組(AP組),每組25只。AP組術前3 d腹腔注射腺苷注射液(劑量為1.5 mg/kg 生理鹽水稀釋至2 mL),1次/d;Sham組及IR組術前3 d腹腔注射等量生理鹽水,1次/d。實驗動物術前禁食12 h,禁水2 h。
1.3 大腦中動脈缺血/再灌注模型的制備 參照 Longa 等[8]的方法并加以改良對IR組及AP組制備大腦中動脈缺血/再灌注模型。對即將進行手術的大鼠給予10%水合氯醛(3.0 mL/kg)腹腔麻醉,通過疼痛刺激判斷是否麻醉成功,后將其以仰臥位固定于大鼠專用手術臺上。對大鼠頸部皮膚進行備皮及碘伏消毒后,止血鉗提起頸部皮膚,用手術刀沿大鼠頸部正中偏左0.5 cm處縱向切開3 cm 左右的皮膚,逐層鈍性分離筋膜、肌肉及神經等組織,充分暴露左側頸總動脈( CCA)、頸外動脈ECA)及頸內動脈( ICA)。用無菌線結扎ECA、CCA的近心端,用動脈夾夾閉ICA,在CCA上距ECA、ICA分叉處下方0.5 cm處,用眼科剪剪一“V”型切口,將MCAO栓線輕輕插入切口,當栓線頭端到達ICA后,用無菌線結扎固定栓線并松開夾閉ICA的動脈夾,繼續插入栓線至大腦中動脈( MCA)處阻斷其血流,插入的深度18~20 mm。逐層縫合、消毒,記號筆標記栓線的皮膚外部分并將其縫合固定于胸前皮膚。術中及術后注意保持動物體溫,腹腔注射2 mL生理鹽水防止大鼠術后脫水。術后2 h即大腦中動脈栓塞2 h后,將栓線向外拔1.0 cm左右,使其大腦的Willis環及MCA恢復血液供應。Sham組不插入線栓阻塞大腦中動脈,余步驟同IR組及AP組。待大鼠術后蘇醒,按Zea Longa的五分制評分法對大鼠進行神經功能缺失評分。納入標準為1~3 分,排除標準為0分、4分或死亡的,并隨時補充各組大鼠保證每組大鼠數量一致。
1.4 腦梗死體積量化 缺血2 h再灌注24 h時,三組各隨機抽取5只大鼠,10%水合氯醛過量麻醉后快速斷頭取腦,除去嗅球、低位腦干及小腦,于-20 ℃冰箱快速冰凍20 min,取出后快速連續冠狀位切片,片厚約2 mm,將腦片完全浸入2% TTC染液中,在37 ℃溫箱中避光染色30 min,每隔10 min翻動一次腦片使其均勻接觸染液。TTC染色后正常腦組織呈紅色,梗死區呈蒼白色。拍照后使用Image J圖像分析系統對腦梗死體積進行量化。根據以下公式計算腦梗死體積百分比:腦梗死體積百分比=(梗死面積×切片厚度)/(全腦面積×切片厚度)×100%≈梗死面積/全腦面積×100%。
1.5 灌注取腦組織 三組余20只分別取5只于缺血2 h再灌注6、24、48、72 h時,10%水合氯醛(3.0 mL/kg)腹腔注射麻醉動物,仰臥位固定于大鼠手術臺上并置于解剖盤中,開胸暴露心臟,用50 mL注射器從左心室插入至升主動脈,同時剪開右心耳,灌注生理鹽水至流出液基本澄清,同時可看到眼球、肝臟、四肢變白,即灌注4% 多聚甲醛溶液至頸部、四肢僵直。將灌注成功的大鼠快速斷頭取腦,取視交叉前后各2 mm腦冠狀切片置于4%多聚甲醛溶液中,于4 ℃冰箱固定24 h。將固定好的腦組織進行脫水透明,浸蠟包埋后切片,片厚4 μm。
1.6 腦組織細胞凋亡程度檢測 采用TUNEL法。切片脫蠟水化后,滴加蛋白酶K于37 ℃孵箱避光孵育30 min,內源性過氧化物酶強力封閉液室溫孵育20 min,TUNEL反應液37 ℃避光孵育60 min,Streptavidin-HRP工作液室溫孵育30 min,DAB顯色,蘇木素復染。陰性對照組僅滴加50 μL生物素(Biotin)標記的dUTP液,余步驟與上述一致。光鏡下胞核被染成棕黃色或棕褐色的細胞是凋亡細胞的表現,每張切片隨機選取缺血側皮質5個不重疊高倍視野(×400)采集圖像,采用Image J圖像分析系統測定平均光密度值。
1.7 腦組織Caspase-3蛋白表達檢測 采用免疫組織化學法。將烤好的切片脫蠟水化后,高壓鍋抗原修復5 min;內源性過氧化物酶阻斷劑室溫避光孵育20 min;正常山羊血清室溫封閉30 min;一抗(Caspase-3 1∶100)4 ℃冰箱過夜;PBS浸洗后滴加生物素標記山羊抗兔IgG聚合物,室溫濕盒中孵育20 min;PBS浸洗后滴加辣根酶標記鏈酶卵白素工作液,室溫濕盒中孵育20 min; PBS浸洗后DAB染色,鏡下觀察染色,自來水沖洗終止染色;蘇木素復染1 min,鹽酸乙醇分化數秒,脫水、透明、封片。陰性對照組用PBS代替一抗,余步驟與上述一致。光鏡下可見陽性細胞胞漿呈淡黃色或棕黃色,每張切片隨機選取缺血側皮質5個不重疊高倍視野(×400)采集圖像,采用Image J圖像分析系統測定平均光密度值。
2 結果
2.1 三組大鼠缺血再灌注24 h腦梗死體積變化 Sham組、IR 組、AP組缺血再灌注24 h相對梗死體積分別為(0.00±0.000)%、(0.28±0.023)%、(0.09±0.018) %,組間兩兩比較有統計學差異(P均<0.05)。
2.2 三組缺血再灌注不同時刻腦組織中Caspase-3蛋白表達 Sham組、IR 組、AP組缺血再灌注不同時刻腦組織中Caspase-3蛋白表達差異均有統計學差異(P均<0.05)。見表1。
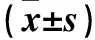
表1 三組不同時刻腦組織Caspase-3蛋白表達比較
注:與Sham組比較,aP<0.05;與IR組比較,bP<0.05。
2.3 三組缺血再灌注不同時刻腦組織細胞凋亡情況 Sham組、IR 組、AP組缺血再灌注不同時刻腦組織細胞凋亡差異均有統計學差異(P均<0.05)。見表2。
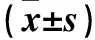
表2 三組大鼠不同時刻腦組織細胞凋亡比較
注:與Sham組比較,aP<0.05;與IR組比較,bP<0.05。
3 討論
既往研究認為,缺血性腦卒中患者早期大腦再灌注對疾病進展及預后起著關鍵作用[9]。發病早期(3~4.5 h)在排除相關禁忌證的情況下,可采用靜脈溶栓治療恢復血流。然而臨床實踐顯示,該治療并非所有溶栓患者均能獲益,甚至有部分患者病情進一步加重,其主要并發癥有溶栓后出血、溶栓后血管再閉塞、再灌注損傷等。因此,越來越多的學者開始關注再灌注損傷。靜脈溶栓可恢復血流,然而血流再通和血流再灌注不同,血流再通即閉塞的動脈再開放,而血流灌注是再通動脈下游的微循環血流的恢復[10]。血流再通而血流再灌注失敗導致腦組織病變進一步加重,即缺血再灌注損傷;其病理過程主要包括血腦屏障的破壞、興奮性氨基酸(主要包括谷氨酸和天冬氨酸)毒性、自由基(主要包括氧自由基和脂質自由基)損傷作用、Ca2+超載、炎癥反應、NO 毒性、線粒體功能障礙及細胞凋亡/壞死等[7,10]。
腦組織持續存在缺血缺氧損傷會誘發細胞凋亡,這是腦梗死程度進一步加重的主要機制之一[11]。程序性細胞死亡途徑分為線粒體介導的內源性凋亡途徑、死亡受體介導的外源性凋亡途徑、穿孔素/顆粒酶介導的細胞凋亡途徑及內質網應激介導的凋亡途徑[12]。雖然途徑各不相同,但它們最終都會導致一系列Caspase家族成員的激活,從而實現細胞凋亡。目前已發現10多種Caspase家族成員,根據其功能將它們分為兩類,一類為啟動者如Caspase-2、8、9、10,受到信號刺激后可啟動死亡程序;一類為執行者如Caspase-3、6、7,它們可直接降解細胞關鍵的細胞組分,促使細胞凋亡[13]。Caspase-3是Caspase家族最關鍵的蛋白酶,各種信號啟動的凋亡程序最終均可激活Caspase-3。Caspase-3是一種凋亡執行蛋白酶[14],激活后可引起與DNA修復、mRNA裂解、類固醇合成及細胞骨架重建等有關的功能蛋白的降解,導致核質濃縮,核膜、核仁碎裂,DNA裂解和mRNA衰變等,引起細胞凋亡。神經元缺血缺氧后可激活Caspase-3 蛋白,從而啟動細胞凋亡[15]。
腺苷即腺嘌呤核苷, 由腺嘌呤和戊糖結合而成,是一種普遍存在于人體細胞內的內源性核苷。腺苷是一種內源性神經保護劑,通過A1R、A2aR、A2bR和A3R四種腺苷受體啟動其生物學效應[16],可介導心血管系統、腫瘤、炎癥、免疫調節和神經系統等相關的多種生理過程[17]。在本課題組之前的研究基礎之上,我們觀察腺苷預處理對大鼠大腦中動脈腦缺血再灌注損傷后Caspase-3的表達及細胞凋亡的影響,探討其通過抗凋亡機制發揮的腦保護作用。本研究發現,Sham組各時間點均可偶見Caspase-3及凋亡細胞表達,而IR組Caspase-3及凋亡細胞表達較同一時刻Sham組明顯增加,AP組Caspase-3及凋亡細胞表達較同一時刻IR組明顯減少;TTC染色檢測缺血再灌注24 h腦梗死體積中也發現,AP組的梗死體積較IR組明顯減少。Caspase-3表達變化趨勢在缺血再灌注損傷后與凋亡細胞變化趨勢一致,均在6 h開始出現,并呈時間依賴性變化,48 h出現表達高峰,72 h開始下降,這與羅銀利等[18]研究結果基本一致。本研究Sham組偶見Caspase-3蛋白表達,也存在細胞凋亡,這與袁瓊蘭等[19]研究結果一致;提示正常生命體要通過程序性死亡清除無用的、衰老的及具有潛在危害的細胞。本研究IR組Caspase-3 蛋白表達增多、細胞凋亡增多,且Caspase-3表達變化趨勢在缺血再灌注損傷后與凋亡細胞變化趨勢一致,這與馮磊等[20]研究結果一致;提示Caspase-3蛋白參與了缺血再灌注損傷病理過程,啟動了細胞凋亡過程,加重了腦梗死程度;而AP組各時間點Caspase-3及凋亡細胞表達變化趨勢與IR組一致,但其表達較同一時刻IR組明顯減少;提示腺苷預處理降低了Caspase-3凋亡執行蛋白的表達,進而抑制細胞凋亡及降低缺血再灌注損傷造成的腦梗死體積,從而發揮腦保護作用。

