早期皮下寄生多房棘球蚴的蛋白組學分析
蘭天艷,張永娥,郭鵬輝,郭小臘,陳軼霞,王明明,鄭亞東
多房棘球絳蟲(Echinococcusmultilocularis)的幼蟲寄生于動物或人的肝臟和肺臟,可引起多房棘球蚴病,又稱泡型棘球蚴病(alveolar echinococcosis, AE)。AE主要流行于北半球高緯度地區及凍土地帶,遍及北美洲[1]、歐洲[2]和亞洲[3]。在我國,AE主要流行于北部、西北部和西南部的農牧區[3-5]。截止2016年8月,全球報道的AE患者有1 076例(占棘球蚴病的5.78%),而我國2012-2016年報道的有1 008例(占棘球蚴病的19.64%)[6-8]。雖然,AE患者數量明顯少于由細粒棘球蚴引起的囊型棘球蚴病(cystic echinococcosis, CE)患者的數量,但由于AE潛伏期長,且常被誤診為肝癌或肝硬化,同時術后一年病死率顯著高于CE(CE病死率為0.70%,AE病死率為2.27%)[6],因此AE對人體危害更為嚴重,故又被稱為“蟲癌”[9]。
在棘球絳蟲生活史中,需要兩種不同的哺乳動物參與其中。臨床上發現,在不同的中間宿主中存在兩種類型的包囊,即一種是具有大量原頭蚴的可育包囊,其原頭蚴附著于生發層或游離于囊液中,另一種則是沒有或僅有少量原頭蚴的不育包囊。目前,對于包囊不育的研究尚處于初步階段,其分子機制仍未知。前期研究發現,在細粒棘球絳蟲的不育囊中,含有一定水平的宿主IgG,生發層和原頭蚴的基因組DNA出現嚴重損傷,大量細胞出現凋亡[10-11],推測基因組損傷或/和細胞凋亡最終引起包囊不育。我們前期研究發現,與寄生在肝臟的包囊相比,多房棘球蚴在皮下寄生時包囊內原頭蚴的數量明顯減少,個別原頭蚴發育異常,腔內富含糖原的不規則的小泡明顯減少,提示皮下寄生不利于蟲體發育,可引起包囊不育[12]。因此,我們以皮下寄生的多房棘球蚴為實驗材料,探究早期不育包囊的蛋白組學特征,為深入研究棘球絳蟲包囊不育的分子機制提供參考。
1 材料與方法
1.1小鼠 BALB/c小鼠購自中國農業科學院蘭州獸醫研究所實驗動物中心,均為雄性,約4周齡。
1.2多房棘球蚴 在實驗室,多房棘球蚴腹腔接種于長爪沙鼠(Meriones unguicutatus),進行連續傳代保種。在無菌條件下,分離多房棘球蚴包囊,之后將包囊置銅網上研磨。利用自然沉降法,將研磨出的原頭蚴在預冷的PBS中自然沉降5次,每次10 min。取少量原頭蚴,用臺盼藍染色,在顯微鏡下計數,并觀察原頭蚴的活力。
1.3主要試劑 過渡性內質網ATP酶(transitional endoplasmic reticulum ATPase, VCP)、烯醇化酶(Enolase)由本實驗室制備的兔源多克隆抗體,14-3-3的抗體由本實驗室制備的鼠源單克隆抗體,β-Actin的抗體購自Abcam 公司,谷胱甘肽S轉移酶(glutathione S-transferase, GST)的抗體購自Sigma公司。HRP標記的山羊抗兔IgG、山羊抗鼠IgG均購自Seracare公司。牛血清白蛋白(BSA)、蛋白酶抑制劑、臺盼藍、Schiff試劑購自Sigma公司。4×蛋白上樣緩沖液(含巰基還原劑)購自索萊寶公司。ECL化學發光顯色液購自Invitrogen公司。蘇木素伊紅(HE)染色試劑盒購自碧云天公司。預染蛋白Marker購自賽默飛公司。
1.4蟲體皮下接種及蛋白質的制備 每只小鼠皮下多點注射約600只原頭蚴,并盡可能去除宿主組織。用PBS洗兩次后,再用濾紙吸干包囊表面殘留的液體并稱重。在液氮中研磨蟲體,之后按每20 mg 25 mL的量加入含有1%蛋白酶抑制劑的PBS,4 ℃輕搖過夜。將混合液于4 ℃ 12 000 g離心10 min,收集上清。利用Bradford的方法測定蛋白質的濃度后,送蛋白質樣品至華大基因進行測序。
1.5測序分析 通過SDS-PAGE對蛋白質樣品進行分離,然后分別獲取膠片上不同位置的蛋白質膠條,酶解后再抽提出肽段,再最后運用LC-MS/MS質譜技術測定對應肽段的質譜圖。利用Mascot2.3.02軟件,結合多房棘球蚴蛋白質數據庫(https://www.genedb.org/),鑒定所有蟲體蛋白質。最后,對所有鑒定的蛋白質進行功能和信號通路注釋,即Gene Ontology (http://www.geneontology.org/)和COG分析。
1.6Western blotting分析 將上述1.4中制備的蟲體粗抗原(約80 μg)與4×蛋白質上樣緩沖液充分混合,煮沸8~10 min,之后利用12%的SDS-PAGE膠進行蛋白質電泳,條件如下:90 V恒壓條件下電泳30 min,之后轉換成120 V恒壓電泳60 min。在轉膜時,先將PVDF膜用無水乙醇浸泡3 min,再用蒸餾水洗滌數次。利用Bio-Rad轉膜儀進行轉膜,30 V恒壓,電轉1 h。將PVDF膜浸泡在2% BSA(用PBST配制)的PBS中,室溫封閉90 min。用PBST洗滌數次后,將膜與一抗(各種抗體均以1∶1000倍稀釋)4℃孵育過夜。次日,用PBST洗滌3次后,將膜與HRP標記的二抗(均以1∶10 000倍稀釋)室溫孵育1 h,之后用PBST洗滌3次,每次10 min。曝光時,先加ECL化學發光顯色液,再與PVDF膜避光孵育2 min,最后利用X光膠片在暗室曝光。
1.7組織切片染色 將新鮮分離的包囊固定在4%的多聚甲醛溶液中,48 h后制備切片。按照如下方法進行HE染色:首先利用二甲苯脫蠟,再將切片從高濃度到低濃度的乙醇中浸泡。用蒸餾水沖洗2 min后,蘇木素染色5~10 min。將染了色的切片浸在自來水中,沖洗去多余的染色液,約10 min。蒸餾水洗滌數次后,置切片于5%的乙酸溶液中分化2 s,自來水沖洗10 min,再用伊紅染色30 s。用低濃度到高濃度的乙醇脫水,二甲苯透明,最后用中性樹膠封片。
1.8糖原染色 首先利用二甲苯脫蠟,再將切片從高濃度到低濃度的乙醇浸泡。用蒸餾水沖洗2 min后,將切片放在高碘酸溶液中浸泡3 min。用自來水沖洗3 min后,Schiff試劑浸泡約15 min。用蒸餾水沖洗2 min后,蘇木素染色3 min。將染了色的切片浸在自來水中,沖洗去多余的染色液,約10 min。用低濃度到高濃度的乙醇中脫水,二甲苯透明,封片。
2 結 果
2.1小鼠感染及皮下寄生包囊的形態結構觀察 剖檢結果發現,在感染的15只小鼠中,8只為陽性,皮下均有一個或兩個明顯包囊,包囊如綠豆大小,呈微透明狀(圖1,箭頭所示)。在光學顯微鏡下,可見包囊中含有子囊,囊中僅有少數原頭蚴,且一些原頭蚴頭節上還帶有小鉤(圖2,箭頭所示);囊壁糖原染色陽性,呈粉紅色(圖2)。

圖1 多房棘球蚴在皮下寄生一個月時形成的包囊Fig.1 A subcutaneous cyst one month post infection of Echinococcus multilocularis

圖2 皮下寄生多房棘球蚴包囊的顯微鏡觀察Fig.2 Microscopic observation of subcutaneous hydatid cyst of Echinococcus multilocularis
2.2測序結果 測序共得到譜圖39 698張,通過鑒定,匹配的譜圖數量為1 019張,共鑒定522個肽段,對應203種蛋白質,其中磷酸烯醇丙酮酸羧激酶的相對豐度最高,其次為檸檬酸合酶(表1)。在豐度較高的前20種蛋白質中,大部分為酶類,有11種,主要參與糖代謝過程(表1)。在這11種蛋白質中,有7種參與糖代謝,其中有3種蛋白質參與糖酵解過程,分別為烯醇化酶、果糖16二磷酸醛縮酶和磷酸葡萄糖異構酶,有2種參與糖原異生,分別為磷酸烯醇丙酮酸羧激酶和磷酸葡萄糖異構酶。而參與細胞過程和應激過程的蛋白質各有一種,分別為細絲蛋白和熱休克70 kDa蛋白4。
表1 豐度較高的前20種蛋白質
Tab.1 Top 20 proteins abundant identified in hydatid cyst ofEchinococcusmultilocularis
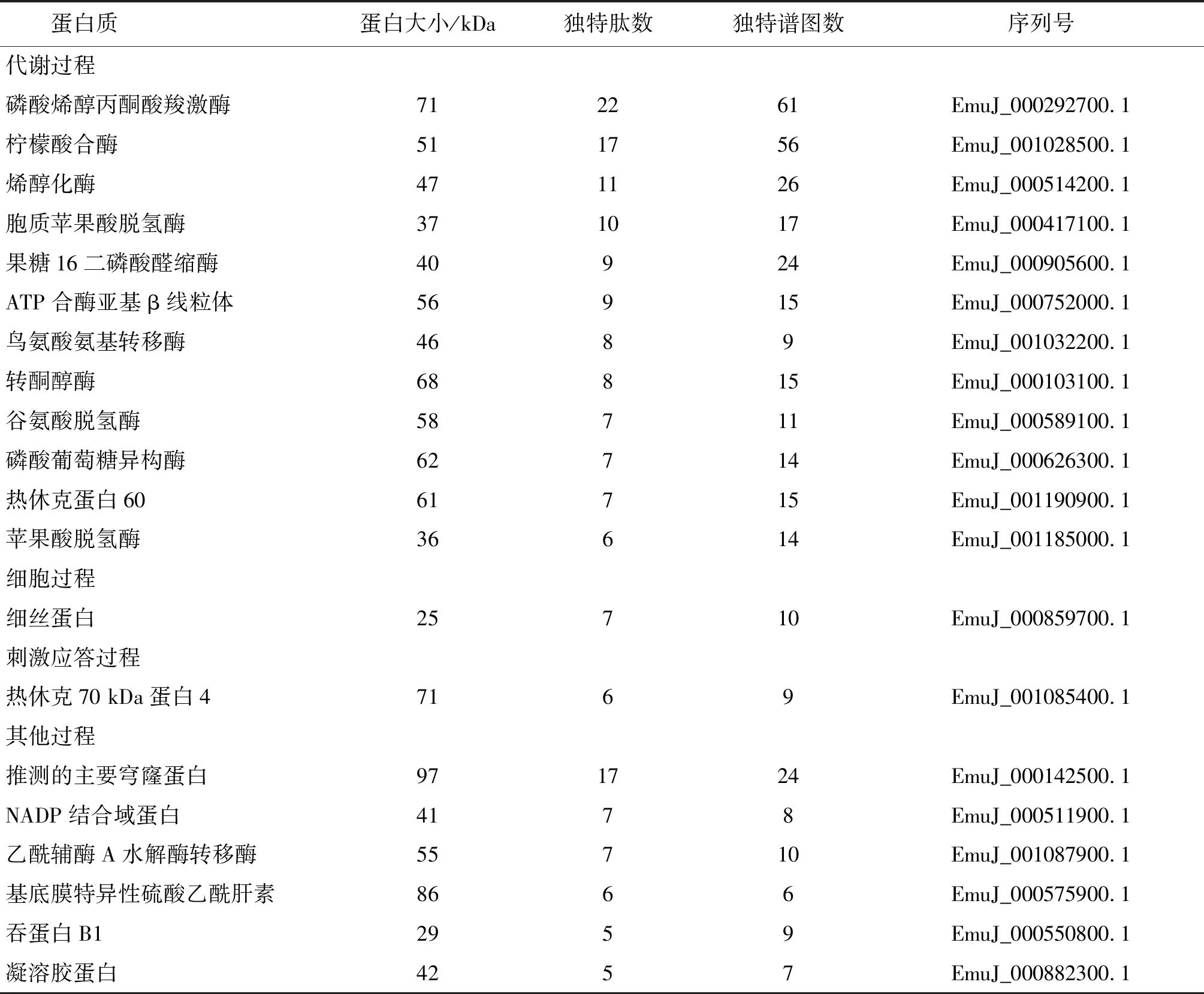
蛋白質蛋白大小/kDa獨特肽數獨特譜圖數序列號代謝過程磷酸烯醇丙酮酸羧激酶71 2261EmuJ_000292700.1檸檬酸合酶 511756EmuJ_001028500.1烯醇化酶 471126EmuJ_000514200.1胞質蘋果酸脫氫酶 371017EmuJ_000417100.1果糖16二磷酸醛縮酶 40924EmuJ_000905600.1ATP合酶亞基β線粒體56 915EmuJ_000752000.1鳥氨酸氨基轉移酶 46 8 9EmuJ_001032200.1轉酮醇酶68 815EmuJ_000103100.1谷氨酸脫氫酶58711EmuJ_000589100.1磷酸葡萄糖異構酶62714EmuJ_000626300.1熱休克蛋白6061715EmuJ_001190900.1蘋果酸脫氫酶36614EmuJ_001185000.1細胞過程細絲蛋白25710EmuJ_000859700.1刺激應答過程熱休克70 kDa蛋白47169EmuJ_001085400.1其他過程推測的主要穹窿蛋白971724EmuJ_000142500.1NADP結合域蛋白4178EmuJ_000511900.1乙酰輔酶A水解酶轉移酶55710EmuJ_001087900.1基底膜特異性硫酸乙酰肝素8666EmuJ_000575900.1吞蛋白B12959EmuJ_000550800.1凝溶膠蛋白4257EmuJ_000882300.1
2.3蛋白質功能注釋 在分子功能方面,所鑒定的203種蛋白質中有107種蛋白質具有催化活性,如轉酮醇酶、烯醇化酶等,有101種蛋白質具有結合活性,而具有蛋白質/核酸結合轉錄因子活性、電子載體活性及分子轉導活性等方面的蛋白質則非常少。在生物學過程方面,包括細胞過程、代謝過程和單組織過程,分別有94、93和84種(圖3),而參與免疫過程的蛋白質則很少,僅有4種,分別為泛素核糖體蛋白L40、組蛋白H4樣(Priapulus caudatus)、細絲蛋白和26S蛋白酶調節亞基7。在細胞組成方面,參與組成細胞器、細胞的蛋白質占絕大多數(260/462),而參與組成膠原蛋白三聚體、突觸的蛋白則非常少。COG分析結果表明,參與翻譯后修飾、蛋白質轉換、伴侶分子信號通路的蛋白質最為富集,有29種之多(圖4),例如蛋白酶體亞基α型7、蛋白質二硫鍵異構酶、熱休克蛋白家族成員3等。參與能量合成與轉換的蛋白質的豐度次之,分別有20種,而參與細胞移動、原噬菌體和轉座子的蛋白質僅1種,即肌聯蛋白(圖4)。
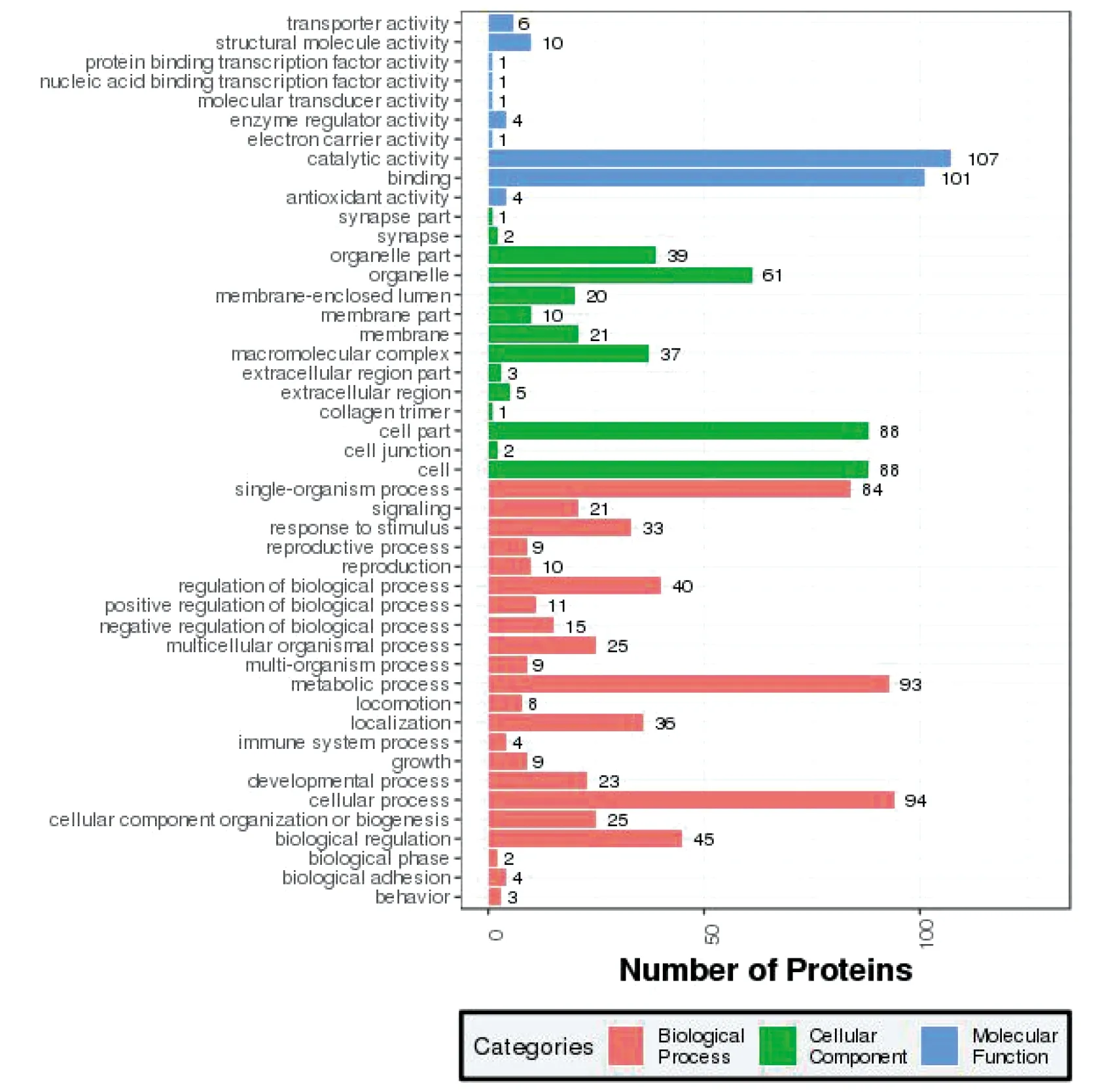
圖3 皮下寄生多房棘球蚴蛋白的GO功能注釋圖Fig.3 GO function annotation of subcutaneous parasitic Echinococcus multilocularis proteins

圖4 皮下寄生多房棘球蚴蛋白的COG注釋柱圖Fig.4 COG annotation of subcutaneous parasitic Echinococcus multilocularis proteins
2.4Western blotting鑒定 為了驗證蛋白質測序結果,選取VCP、Enolase、14-3-3、GST和β-actin等5種蛋白質進行Western blotting。結果顯示,VCP、Enolase、14-3-3、β-actin在皮下包囊中均有不同程度的表達,但GST并不表達或表達水平非常低(圖5)。這與測序結果一致。
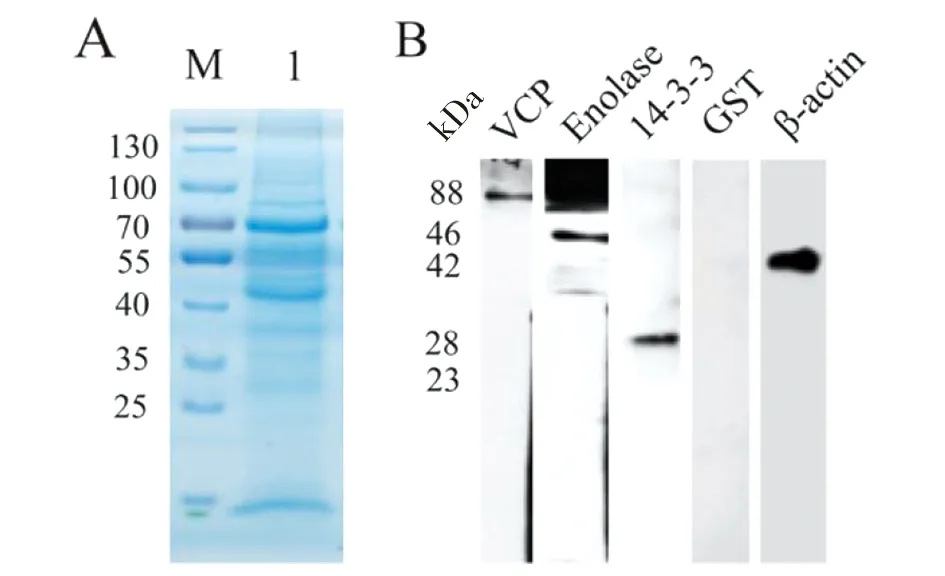
A:皮下寄生多房棘球蚴5種蛋白的Western blotting分析;M:分子量標記圖5 皮下寄生多房棘球蚴總蛋白的SDS-PAGE Fig.5 (A) SDS-PAGE analysis; (B) Western blotting analysis
3 討 論
在臨床上,細粒棘球絳蟲(Echinococcusgranulosus)和多房棘球絳蟲均可形成不育包囊[13-14]。通常情況下,細粒棘球絳蟲感染羊時,會形成可育包囊,而在感染牛時則發育為不育包囊,并且不同地區的包囊發育狀況存在差異。對多房棘球絳蟲來說,通常感染人時會發育為不育包囊。本研究結果表明,在皮下寄生不利于多房棘球蚴發育,幾乎所有的包囊沒有或僅有少數原頭蚴,有向不育囊發育的趨勢。這與以前的研究結果相似[12]。
14-3-3蛋白是一種廣泛存在于真核生物中的多功能蛋白,參與調節信號轉導、凋亡、代謝等重要的生理活動,被認為是細胞分化和增殖過程中的關鍵分子。在多房棘球蚴,14-3-3蛋白的表達量是其成蟲表達量的10倍以上[15]。已經證明,多房棘球絳蟲14-3-3蛋白可誘導產生免疫保護,使小鼠免受原發性肺泡包蟲病[16]。在我們的實驗中,發現14-3-3在皮下寄生包囊中的表達量相對較高,推測它可能在蟲體寄生、發育等過程起著重要作用。GST是一種普遍存在的多功能蛋白超家族,也是一種重要的解毒酶,參與細胞清除外源性和內源性毒性物質[17]。在蠕蟲寄生過程中,宿主免疫反應可產生一些毒性物質以殺滅寄生蟲。值得注意的是,在我們的結果中未檢測到GST表達。這表明皮下寄生的多房棘球蚴的抗氧化能力可能有所下降。有研究表明,Caspase-3和RAD9基因在細粒棘球絳蟲的不育包囊中表達量明顯上升[11,18],誘導的細胞凋亡大于其自身的修復能力,這可能是由于包囊中不表達或低水平表達GST等一些抗氧化分子,最終導致包囊不育。
在本研究中,我們發現與免疫相關的蛋白質的種類很少,豐度也很低,這可能是由于皮下血管分布較少,使得到達感染部位的免疫細胞及相關免疫分子相對有限,引起的宿主抗蟲體的免疫應答較弱所致。同樣,這似乎也可以解釋為什么磷酸烯醇丙酮酸羧激酶、檸檬酸合酶、烯醇化酶等參與糖代謝的關鍵酶種類眾多且豐度也較高,這是因為皮下寄生時蟲體可獲取的營養物質有限,而這些酶可以多種不同的途徑合成糖以滿足蟲體的生長、發育、遷移、繁殖等生命活動[19-21]。
總之,本研究利用LC-MS / MS方法確定了皮下寄生1個月的包囊的蛋白質組成,發現磷酸烯醇丙酮酸羧激酶、胞質蘋果酸脫氫酶、果糖16二磷酸醛縮酶等多種酶的表達水平較高;所鑒定的蛋白質在功能上主要富集在翻譯后修飾、蛋白質轉換和伴侶分子信號通路、能量合成與轉換以及碳水化合物運輸與代謝方面,而參與免疫應答、脂質運輸與代謝等方面的蛋白質則較少。這些研究結果為深入研究棘球蚴包囊不育的機理提供了有價值的線索。
利益沖突:無

