下肢原發性慢性靜脈功能不全與上皮間質轉化之間的關系
周亞東,陳幸生,官云彪,薛 明
(福建醫科大學附屬協和醫院血管外科,福建 福州 350001)
下肢原發性慢性靜脈功能不全(primary chronic venous insufficiency,PCVI)是血管外科常見病與多發病,是以淺靜脈曲張、靜脈性跛行、肢體水腫、脹痛、皮膚濕疹、脂質硬化和潰瘍等為主要表現的一種疾病, 在西方國家約三分之一成人罹患靜脈曲張(其中絕大多數為PCVI),國內報道此病發生率約為8.6%[1-3]。其病因及發病機制至今未明。本研究通過檢測上皮鈣黏附蛋白(E-cadherin)和波形蛋白(Vimentin)在曲張大隱靜脈組織及正常大隱靜脈組織中的表達情況,探討PCVI與上皮間質轉化(epithelial mesenchimal transition,EMT)之間的關系。
1 資料與方法
1.1一般資料 選取2012年2—10月我院收治的67例PCVI患者曲張大隱靜脈小腿段2~3 cm血管壁作為試驗組標本,均采取無損傷原則切取。根據1994年美國靜脈學會(Clinical Etiology Anatomy Pathophysiology,CEAP)臨床分級法[4]:2級28例,3級6例,4級15例,5級8例,6級10例。按照靜脈臨床嚴重程度評分(Venous Clinical Severity Score,VCSS)[5]:輕度PCVI組(1~2級) 28例,男性12例,女性16例,年齡37~74歲,平均(55.59±8.22)歲,毛細血管擴張與淺靜脈曲張;中度PCVI組(3~4級) 21例,男性9例,女性12例,年齡37~75歲,平均(56.60±7.48)歲,患肢有水腫及皮膚改變,片狀色素沉著、靜脈濕疹及脂質硬化等;重度PCVI組(5~6級) 18例,男性7例,女性11例,年齡38~74歲,平均(55.48±8.41)歲,患肢有水腫、皮膚改變、已愈合潰瘍及活動動性潰瘍。另選擇同期行冠狀動脈搭橋及其他搭橋手術中取大隱靜脈作供體移植者16例作為對照組,均無外周血管疾病,男性10例,女性6例,年齡49~68歲,平均(56.30±6.84)歲。每例標本于手術切下后立即存于液氮罐中凍存。4組性別、年齡差異均無統計學意義(P>0.05),具有可比性。
1.2主要試劑 RNA提取試劑Trizol Reagent(美國Invitrogen公司),RevertAid First Strand cDNA Synthesis Kit、聚合酶鏈式反應(Polymerase Chain Reaction, PCR) Master Mix(美國Fermentas公司),E-cadherin,Vimentin和甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物均由上海生工生物公司合成。鼠抗人E-cadherin單克隆抗體、兔抗人Vimentin單克隆抗體(美國Abcam公司),鼠抗人GAPDH單克隆抗體,辣根過氧化物酶標記羊抗兔IgG及羊抗鼠IgG購自北京中杉金橋生物技術有限公司,放射免疫沉淀法(Radioimmunoprecipitation assay,RIPA)蛋白裂解液,彩色預染蛋白質分子量標準, 電化學發光(electrochemiluminescence, ECL)液等購自上海碧云天生物技術有限公司。
1.3方法
1.3.1半定量逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR) 將大隱靜脈用液氮研磨成粉狀后,用Trizol Reagent提取組織總RNA,通過RevertAid First Strand cDNA Synthesis Kit試劑盒逆轉錄大隱靜脈組織總RNA為cDNA,PCR反應擴增基因片段,PCR產物行凝膠電泳,GAPDH作內參照,用與GAPDH灰度值比值對mRNA的表達進行半定量分析。E-cadherin反應條件:95 ℃預變性3 min,95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸30 s,進行40個循環,72 ℃再延伸5 min。Vimentin反應條件:95 ℃預變性3 min,94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸30 s,進行30個循環,72 ℃再延伸5 min。GAPDH反應條件:95 ℃預變性3 min,95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸40 s,進行30個循環,72 ℃再延伸5 min。擴增后取5 μL PCR產物在1.2%瓊脂糖凝膠電泳。凝膠自動成像系統上攝像,通過Quantity one分析各條帶灰度值(基因表達值=E-cadherin或Vimentin/GAPDH)。
1.3.2Western blot 將大隱靜脈用液痰研磨成粉狀后裝入1.5 mL離心管中,按每100 mg組織加1 mL冷RIPA裂解液,于冰上充分裂解30 min,15 000 g,4 ℃離心7 min,取上清以二奎啉甲酸(bicinchoninic acid,BCA)法測定蛋白質含量。取50 μg蛋白經煮沸5 min,加適量上樣緩沖液后,7.2%十二烷基磺酸鈉-聚丙烯酰胺垂直凝膠電泳分離,電轉移蛋白質到聚偏二氟乙烯膜上,5%脫脂奶粉液封閉,37 ℃室溫1 h,洗膜緩沖液洗膜后分別與抗E-cadherin抗體(1∶1 000)、抗Vimentin抗體(1∶1 500)和抗GAPDH抗體(1∶1 000)孵育4 ℃過夜,再用辣根過氧化物酶標記的二抗孵育,37 ℃ 1 h,洗膜緩沖液洗膜后在暗室中加ECL發光試劑,X線膠片下曝光,常規方法顯影、定影。圖像分析通過Quantity one分析各條帶灰度值(蛋白表達值=E-cadherin或Vimentin/GAPDH)。
1.4統計學方法 應用SPSS 17.0統計軟件分析數據。計量資料比較采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1E-cadherin mRNA和Vimentin mRNA在大隱靜脈標本中的表達情況 通過半定量RT-PCR法擴增目的基因E-cadherin基因、Vimentin基因及內參照GAPDH基因,E-cadherin基因擴增產物在瓊脂糖凝膠上表現為大小293 bp條帶,Vimentin基因擴增產物在瓊脂糖凝膠上表現為大小272 bp條帶,GAPDH基因擴增產物表現為大小532 bp條帶,條帶大小符合預期引物設計結果。輕度PCVI組、中度PCVI組、重度PCVI組E-cadherin mRNA擴增平均灰度值低于對照組,中度PCVI組、重度PCVI組E-cadherin mRNA擴增平均灰度值低于輕度PCVI組,重度PCVI組E-cadherin mRNA擴增平均灰度值低于中度PCVI組,差異有統計學意義(P<0.01)。正常對照組、輕度PCVI組、中度PCVI組、重度PCVI組中組織標本表達Vimentin mRNA差異無統計學意義(P>0.05)。見表1。
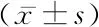

組別例數E-cadherin mRNAVimentin mRNA對照組 160.630±0.1340.244±0.132輕度PCVI組280.500±0.107*0.448±0.607中度PCVI組210.352±0.103*#0.326±0.248重度PCVI組180.188±0.097*#△0.318±0.274F值 54.0390.992P值 <0.0010.401
*P值<0.05與對照組比較 #P值<0.05與輕度PCVI組比較 △P值<0.05與中度PCVI組比較(SNK-q檢驗)
2.2E-cadherin與Vimentin在大隱靜脈標本中的表達情況 通過Western Blot法檢測目的蛋白E-cadherin、Vimentin及內參照GAPDH,E-cadherint和Vimentin及GAPDH分別為110 000,53 000,36 000條帶,符合抗體說明書大小。輕度PCVI組、中度PCVI組、重度PCVI組E-cadherin表達平均灰度值低于對照組,中度PCVI組、重度PCVI組E-cadherin表達平均灰度值均低于輕度PCVI組,重度PCVI組E-cadherin表達平均灰度值均低于中度PCVI組,差異有統計學意義(P<0.01)。Vimentin在正常對照組、輕度PCVI組、中度PCVI組、重度PCVI組中表達差異無統計學意義(P>0.05)。見表2。
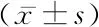

組別例數E-cadherinVimentin對照組160.754±0.1934.185±2.256輕度組280.484±0.110*5.023±3.525中度組210.382±0.120*#4.728±3.363重度組180.220±0.125*#△4.972±4.379F值45.4590.219P值<0.0010.883
*P值<0.05與對照組比較 #P值<0.05與輕度PCVI組比較 △P值<0.05與中度PCVI組比較(SNK-q檢驗)
3 討 論
3.1EMT和PCVI均與基質金屬蛋白酶(matrix metalloproteinase,MMP)關系密切,假想PCVI通過EMT介導血管重塑作用 EMT是指上皮細胞在形態學上發生向成纖維細胞或間質細胞表型的轉化過程,即具有極性的上皮細胞經歷多種生化轉變成具有間質細胞表型的一個過程[6]。上皮細胞在EMT過程中發生表型標志改變,主要包括上皮細胞分子標志的表達降低或喪失和一些間葉細胞標志的新表達或表達升高。EMT時,介導細胞間及細胞基質間連接的E-cadherin和維持細胞極性的細胞角蛋白表達下調,而參與基底膜降解的成纖維細胞特異蛋白1、Vimentin、α-平滑肌肌動蛋白及細胞外基質成分(Ⅰ型膠原蛋白、纖連蛋白等)新表達或表達上調, E-cadherin表達減少甚至丟失是EMT最顯著的特征之一[7]。
關于PCVI的發病原因目前有以下幾種學說:①靜脈瓣膜學說;②靜脈管壁學說;③動靜脈交通學說;④血管重塑學說。其中血管重塑學說是近年來的研究熱點,即血管重塑是細胞增殖、死亡、遷移以及細胞外基質合成和降解所致的血管壁結構動態變化過程。國內外曲張靜脈組織學特點發現,曲張靜脈發生的病理變化表現為內皮細胞排列疏松甚至脫落,中層平滑肌細胞增厚等。正好與EMT過程中上皮細胞間連接減少,容易脫落,逐漸轉變為間質細胞等特點相吻合。另外國內外大量研究證實[8-13],MMP與靜脈曲張的血管重塑過程關系密切,許建輝等[8]研究發現,MMP-1在正常大隱靜脈壁中表達量較少,但在曲張大隱靜脈壁中表達量增多;劉群亮等[9]研究表明,MMP-2、MMP-9和基質金屬蛋白酶組織抑制因子1在曲張靜脈壁中表達增多,證實其在慢性靜脈功能不全中起重要作用,可能參與血管重塑的發生和發展;Schmid-Sch?nbein等[10]在靜脈性潰瘍周圍組織的檢測中發現MMP-9表達增加,且與潰瘍愈合程度呈負相關。上述研究結果均表明MMPs在靜脈曲張血管重塑重構過程中起作用。但具體作用機制,即如何發揮作用仍不清楚。近年來通過對EMT的研究發現,MMP與EMT關系密切,其在多種條件下介導EMT的發生。如Radisky等[14]報道,將小鼠乳腺上皮細胞暴露于MMP-3中,將誘導一種Rac1轉換形式的表達,通過一系列效應刺激轉錄因子Snail的表達而誘導EMT的發生。Moirangthem等[15]報道,MMP-9表達越高,表達 E-cadherin量越少,通過MMP-9調控EMT的表達可降低乳腺癌的發展。Ke等[16]研究顯示,MMP-7有助于腎臟纖維化病變可能正是通過誘導調節EMT來實現的。正是基于PCVI與MMP密切關系,以及MMP在EMT中的重要作用,猜測PCVI可能與EMT有關,即EMT參與PCVI的血管重塑過程。
3.2通過檢測經典EMT標志物驗證PCVI的血管重塑是否經EMT介導 EMT有2個經典標志物,即上皮細胞標志物E-cadherin和間質細胞標志物Vimentin。本研究通過測定E-cadherin和Vimentin轉錄水平及翻譯水平的表達量來檢測EMT的發生,采用Western blot 及 RT-PCR的方法檢測標本中E-cadherin和Vimentin 的轉錄水平與翻譯水平,結果表明,E-cadherin在正常對照組及輕度PCVI組,中度PCVI組,重度PCVI組中表達逐漸降低(P<0.01),但是Vimentin在各組間差異無統計學意義(P>0.05)。不符合EMT過程中E-cadherin下調并且Vimentin上調的情況,表明在PCVI的靜脈重塑過程不是通過EMT實現的。但也同時表明,①作為內皮細胞間主要成分的E-cadherin減少,導致內皮細胞間連接疏松,可能后續的血管內成分滲出而出現的色素沉著及靜脈性潰瘍有關;②PCVI的靜脈重塑過程中,上皮細胞即下肢靜脈內皮受損嚴重,而間質細胞標志物Vimentin表達無明顯變化,提示其在形態學中表現出的中層增厚可能是以結構變化為主,平滑肌細胞數量上并無明顯的增加。
E-cadherin在正常對照組與輕度PCVI組、中度PCVI組、重度PCVI組中表達,隨著臨床嚴重程度加重而呈降低趨勢,提示E-cadherin與PCVI的臨床癥狀相關,可作為臨床評估PCVI嚴重程度的指標。同時,進一步找出內皮細胞受損的機制,可能為PCVI的發病機制提供新的思路。而間質細胞形態學增厚,表達產物卻未進一步增加,需要進一步研究。
總之,PCVI的靜脈重塑可能并不是以EMT實現的,但是E-cadherin作為內皮細胞的表型標志,隨PCVI臨床表現嚴重程度增加而降低,可作為評PCVI臨床嚴重程度的一項指標。

