Bacillus amyloliquefaciens YM6對鹽脅迫條件下玉米幼苗生理及生化的影響
王華笑,劉 環,楊國平,2,張 琇,2,3,李 壯,張 炎
(1.北方民族大學 生物科學與工程學院,銀川 750021;2.寧夏特殊生境微生物資源開發與利用重點試驗室,銀川 750021;3.國家民委發酵釀造工程生物技術重點試驗室,銀川 750021;4. 新疆農業科學院 土壤肥料與農業節水研究所,烏魯木齊 830091)
土壤鹽漬化是土地退化的一種現象[1],嚴重影響畜牧業和農業的發展[2]。土壤鹽分積累會影響植物細胞結構及功能[3],增加活性氧積累[4],抑制植物光合作用[5],影響作物產量[6]。
研究發現,逆境脅迫條件下接種植物根際促生菌(Plant growth promoting rhizobacteria-PGPR)可促進植物生長和干物質累積[7-8],增加植物中具有清除活性氧功能的酶類活性。陳淋[9]研究發現接種解淀粉芽孢桿菌(BacillusamyloliquefaciensSQR9)使鹽脅迫中玉米的過氧化物酶、過氧化氫酶和谷胱甘肽酶活性顯著升高,Kumari等[10]研究發現假單胞菌AK-1 (Pseudomonassp.strain AK-1) 和芽孢桿菌SJ-5 (Bacillussp. strain SJ-5)在鹽脅迫條件下可誘導大豆幼苗脂肪氧合酶(LOX)和過氧化物酶(POD)活性增強,Nautiyal等[11]發現解淀粉芽孢桿菌 (BacillusamyloliquefaciensNBRISN13)可誘導鹽脅迫下水稻植株內過氧化氫酶活性提高1.5倍,王春娟等[12]研究蠟質芽孢桿菌(BacilluscereusAR156)誘導鹽脅迫下番茄幼苗抗氧化酶活性顯著提高,另外木霉菌[13]、假單胞菌屬[14]、VA菌根真菌[15]等對誘導植物抗氧化酶系活性提升均存在顯著作用。
寧夏特殊生境微生物資源開發與利用重點實驗室篩選獲得一株能在中度鹽脅迫(75 mmol/L)條件下促進玉米生長的菌株YM6,經生理生化及16S rRNA序列同源性對比鑒定為解淀粉芽孢桿菌(Bacillusamyloliquefaciens)。解淀粉芽孢桿菌屬于PGPR[16],研究表明解淀粉芽孢桿菌,可改善植物體內氧化及過氧化物濃度[17],調節植物細胞滲透勢減輕逆境脅迫對植物細胞結構損傷;抑制或減輕某些植物病害對植物生長發育產生的不良影響[18],促進植物生長。本研究以玉米為試驗材料,在75 mmol/L NaCl鹽脅迫條件下接種解淀粉芽孢桿菌YM6菌株,探究YM6菌株對鹽脅迫下玉米根尖細胞超顯微形態及玉米植物內超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)、丙二醛(MDA)、過氧化氫(H2O2)、脯氨酸(Pro)等生理生化指標的影響,探究解淀粉芽孢桿菌提高玉米耐鹽能力機理,旨在為研究植物根際促生菌促進植物抗逆性機理提供參考。
1 材料與方法
1.1 生物材料
試驗材料:供試玉米種為‘鄭單958’,選擇顆粒飽滿、無破損、大小一致的玉米種子作為試驗 材料。
供試菌株:解淀粉芽孢桿菌YM6(BacillusamyloliquefaciensYM6),保存于寧夏特殊生境微生物資源開發與利用重點實驗室。
1.2 化學試劑
SOD活性測定試劑盒、CAT活性測定試劑盒、POD活性測定試劑盒、H2O2質量分數測定試劑盒、MDA質量分數測定試劑盒、Pro質量分數測定試劑盒均購自北京索萊寶科技有限公司。
1.3 主要儀器設備
日本日立H-7650 透射電子顯微鏡、美國RMC POWERTOME XL超薄切片機、上海佑科UV-1000紫外可見分光光度計。
1.4 植物營養液母液配制
植物營養液(1 000 ×):母液1:CoCl2·6 H2O 0.002 g、H3BO31.43 g、MnCl2·4 H2O 0.905 g、ZnSO4·7 H2O 0.11 g、CuSO4·5 H2O 0.051 g、Na2MoO4·2 H2O 0.061 g溶于500 mL去離子水;母液2:MgSO4·7 H2O 24.648 g溶于500 mL去離子水;母液3:K2HPO487.09 g、KH2PO468.443 g溶于500 mL去離子水;母液4:CaCl2·2 H2O 55.495 g溶于500 mL去離子水;母液5:FeC6H5O7·3 H2O 2.5 g溶于500 mL去離子水;以上5種母液各取1 mL至800 mL純水中, 添加3.385 g (NH4)2SO4,然后用純水定容至1 000 mL,混合均勻,即得植物營養液,1×105Pa滅菌20 min后作為正常的植物營 養液。
1.5 試驗方法
1.5.1 玉米種子催芽與培養 選取約200粒大小一致、飽滿無損傷的玉米種子,用體積分數為95%酒精浸泡5 s消除種子表面張力,質量分數為0.1% HgCl表面消毒40 s[19],無菌水沖洗4~7次。將消毒的種子置于鋪有濕潤無菌紗布的培養皿內,于25 ℃黑暗條件下培養48~72 h,萌發備用。
1.5.2 試驗處理 CK0:無鹽脅迫、不接種YM6的玉米植株為正常生長的對照。
CK1:將發芽的玉米種植于含有75 mmol/L NaCl的培養瓶中,不接種YM6的玉米植株為鹽脅迫對照。
YM6處理:將發芽的玉米種植于含有75 mmol/L NaCl的培養瓶中,接種濃度為1×108cfu/mL的YM6菌株,接種量為每株20 μL,滴加于玉米幼苗根系。
每瓶4株玉米苗,每個處理設置5個重復,所有處理均放置于光照培養箱(25 ℃,16 h光照與18 ℃,8 h黑暗)中培養,照度10 000 lx。
1.5.3 YM6菌株對鹽脅迫下玉米幼苗根尖細胞形態影響 玉米培養至14 d,待玉米植株生長有明顯區別后,切取試驗組與對照組玉米根尖相同部位0.5~1.0 cm,做透射電鏡預處理:前固定:用磷酸鹽緩沖液(pH 7.2)沖洗后置于4 ℃ 體積分數為2% 多聚甲醛—2.5% 戊二醛固定液固定液中3 h,然后更換磷酸鹽緩沖液沖洗3次,每隔2 h換洗一次。
后固定:用體積分數為1%鋨酸于4 ℃浸泡 1 h后用磷酸緩沖液浸泡2次,每次間隔15 min。
脫水滲透:分別用體積分數為30%、50%、70%、80%、90%、100%酒精4 ℃脫水5 min,體積分數為75%叔丁醇室溫滲透2次,每次5 min,體積分數為100%叔丁醇-20 ℃滲透20 min。
包埋:環氧丙烷滲透2次,每次間隔15 min,后至于35 ℃完全包埋液內6 h,轉移至包埋板內42 ℃包埋過夜制得玉米根尖包埋組織。
包埋塊切超薄切片(40~50 nm)用于透射電鏡觀察。
1.5.4 YM6菌株對鹽脅迫下玉米幼苗生化指標影響 取試驗組、CK1、CK0培養至14 d的玉米幼苗,用蒸餾水沖洗5~6次,磷酸鹽緩沖液(pH 7.2)沖洗2~3次,無菌濾紙吸干水分,剪取玉米幼苗地上(莖葉)、地下部分(根)置于-20 ℃,真空5 Pa脫水保存,備用,干燥后的玉米植株進行生化指標測定。CAT活性、SOD活性、POD活性、H2O2、MDA、Pro質量分數測定均采用微量法 測定。
1.5.5 數據分析 采用Excel 2003軟件對試驗數據進行分析并制圖;利用SPSS 17.0軟件進行差異顯著性分析 (Duncan法,P<0.05)
2 結果與分析
2.1 YM6菌株對鹽脅迫下玉米幼苗根尖細胞形態的影響
細胞壁與細胞膜作為細胞的保護組織,其穩定性在鹽堿脅迫中有關鍵性作用。如圖1所示,鹽脅迫作用下A組發生質壁分離現象,原生質體內縮;B組質壁分離現象不明顯,原生質體無明顯內縮現象,且細胞壁較厚,完整性好。
細胞核是由核被膜、染色質、核仁及核基質構成,是細胞中最明顯的一個細胞器結構體。如圖2,在A處理中在鹽脅迫條件下核仁顏色加深固化,并且部分核仁出現嚴重變形,染色質也發生變化。B組處理中一個細胞內存在兩個細胞核,細胞核處于復制狀態;細胞核無固化,結構較為完整,無變形現象,染色質無明顯變化,整體形態優于A組。
線粒體為細胞的各種生命活動提供能量,在遭受鹽堿脅迫時結構發生明顯的變化。在鹽堿脅迫條件下,線粒體數目增加,形狀變得不規則。如圖3-A組在鹽脅迫條件下部分線粒體結構不清晰,出現擴張現象,形狀與體積明顯變大,內峭腔室也出現增大現象,部分線粒體發生破裂變形。B組的線粒體成卵圓形,結構完整性好,無內質網變形現象,內膜折疊清晰,無空腔產生,數量低于A組。
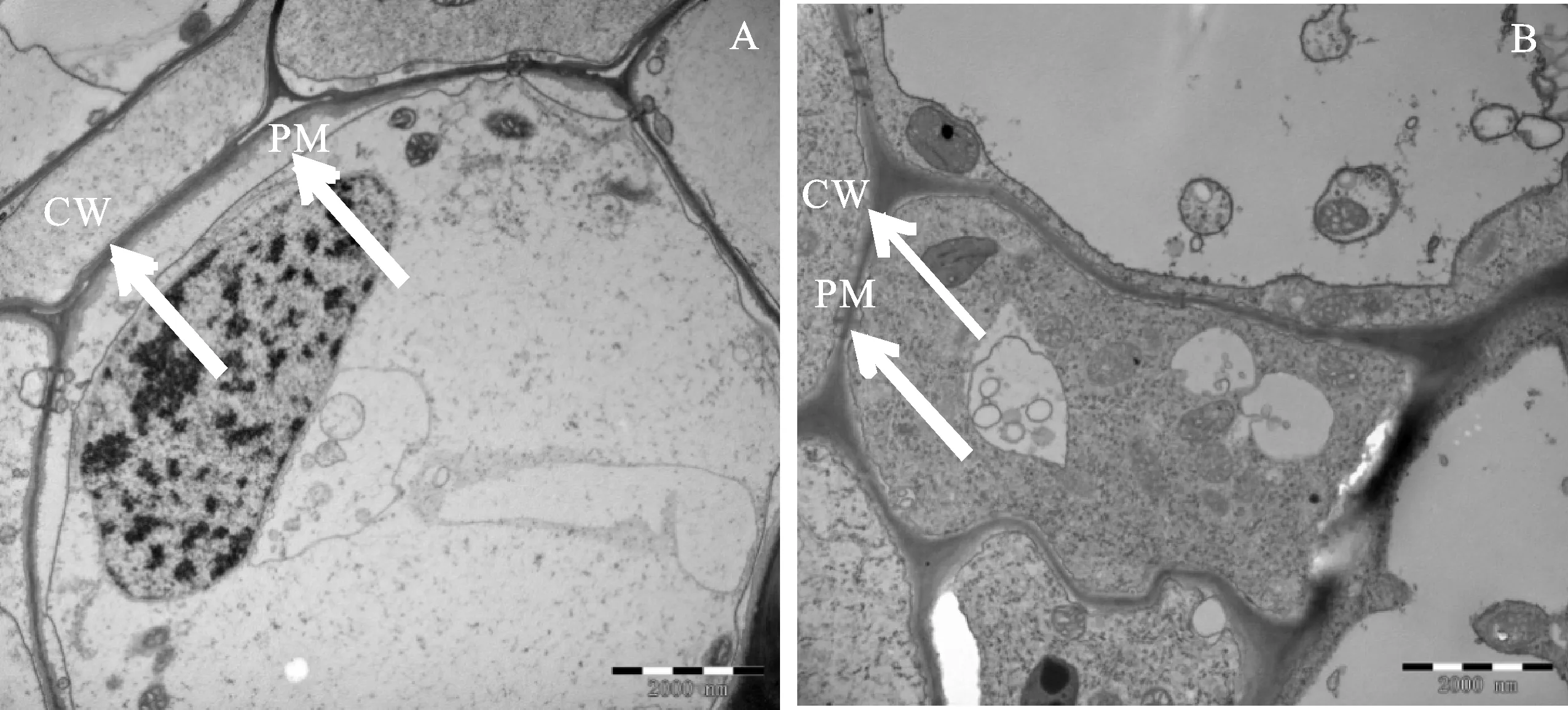
PM.質膜;CW.細胞壁;箭頭表示質壁分離狀況;A.鹽脅迫不接種組玉米根尖顯微形態(×20K),鹽濃度75 mmol/L;B.鹽脅迫接種YM6菌株后玉米根尖顯微形態(×20K),鹽濃度75 mmol/L,下同
PM.Plasma membrane;CW.Cell wall;The arrow indicates the cytoplasmic wall separation;A.Represents salt stress,micro-morphology of the root tip of non-bacterial group (×20K), and the salt concentration of 75 mmol/L;B.Represents the microscopic morphology (×20K) of maize root tip after inoculation with YM6 strain under salt stress, and the salt concentration 75 mmol/L,the same as below
圖1 鹽脅迫與接種YM6菌株后玉米根尖細胞質壁分離現象(×20K)
Fig.1 Cytoplasmic wall separation of maize root tip under salt stress with or without YM6 strain(×20K)
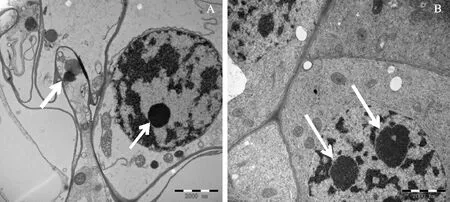
箭頭指示細胞核仁;A.75 mmol/L鹽脅迫不接種對照;B.鹽脅迫接種YM6菌株處理
Arrows indicate thenucleolus;A.75 mmol/L salt stress control without YM6;B.Treatment of salt stress with YM6
圖2 鹽脅迫與接種YM6菌株后玉米根尖細胞核仁形態的結構(×20 K)
Fig.2 Nucleolusr morphology of maize root tip cells after salt stress and inoculation with YM6 strain (×20 K)
胞間連絲成網狀分布于細胞之間,貫穿細胞,是細胞間物質傳遞與信息交換的通道,其結構完整性是反映細胞功能完整性的重要標志。圖4中A組處理細胞的胞間連絲完整性差,結構不規則,與細胞間貼合連接不緊密,B組的胞間連絲通道明顯,與細胞貼合,形態更為完整。
2.2 M6菌株對鹽脅迫下玉米幼苗Pro、MDA、H2O2的影響
由圖5-A可知在75 mmol/L NaCl鹽脅迫條件下玉米植株地上、地下部分均表現為Pro質量分數低于正常無鹽脅迫組,地上部分為32.27 μg/g(DW)(DW代表植株干質量,下同),地下部分為14.19 μg/g(DW)。鹽脅迫接種組與鹽脅迫不接種組相比,玉米幼苗地上、地下部分Pro質量分數均顯著提高(P<0.05),且地上部分Pro質量分數為正常無鹽脅迫組的7.0倍,為鹽脅迫不接種組的4.0倍。
由圖5-B可知,在75 mmol/L NaCl鹽脅迫下接種YM6菌株,地上部分MDA質量摩爾濃度有所降低,最小值為84.7 nmol/g(DW)是鹽脅迫不接種組的0.7倍,但接種組與鹽脅迫不接種組玉米幼苗地下部分差異不顯著。
由圖5-C可知,在75mmol/L NaCl鹽脅迫下,地上、地下部分H2O2質量摩爾濃度顯著高于無鹽脅迫組(P<0.05),接種YM6菌株后地下部分H2O2質量分數是無鹽脅迫組1/3,為0.042 μmol/g(DW),但與無鹽脅迫組相比地上部分差異不顯著。

箭頭指示線粒體;A.75 mmol/L鹽脅迫不接種對照;B.鹽脅迫接種YM6菌株處理
Arrows indicate mitochondria;A.The 75 mmol/L salt stress without YM6;B.The treatment of salt stress maize with YM6
圖3 鹽脅迫與接種YM6菌株后玉米根尖線粒體的結構(×20K)
Fig.3 Mitochondrial structure of maize root tip under salt stress and inoculation with YM6 strain (×20K)

頭指示胞間連絲;A.75 mmol/L鹽脅迫不接種對照;B.鹽脅迫接種YM6菌株處理
Arrows indicate plasmodesmata;A.75 mmol/L salt stress control without YM6;B.Maize under treatment of salt stress with YM6
圖4 鹽脅迫與接種YM6菌株后玉米根尖細胞胞間連絲(×20 K)
Fig.4 Salt stress on intercellular filaments in maize root tip cells after inoculation with YM6 strain (×20 K)
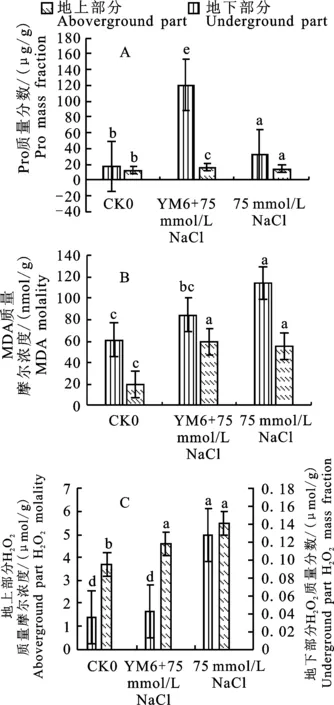
相同的小寫字母表示在0.05水平無顯著差異,不同小寫字母表示在0.05水平差異顯著。下同
Same lowercase letters indicate insignificant difference is at 0.05 level, and the different letters indicate significant difference at 0.05 level.The same below
圖5 鹽脅迫與接種YM6菌株下玉米滲透調節物質質量分數
Fig.5 Changes of osmotic adjustment substance content of maize under salt stressed-maize induced by YM6 strain
2.3 YM6菌株對鹽脅迫下玉米幼苗POD、CAT、SOD活性的影響
由圖6-A可知75 mmol/L NaCl鹽脅迫下,接種組地上、地下部分POD活性與不接種組對比酶活性顯著提高(P<0.05),接種YM6菌株后玉米幼苗地上、地下部分POD活性分別為 461.11 U/g(DW)、281.61 U/g(DW),但酶活性均低于無鹽脅迫組。
由圖6-B可知在可知75 mmol/L NaCl鹽脅迫下,接種YM6菌株后,玉米植株地上、地下部分CAT活性均顯著高于鹽脅迫不接種組,地上部分CAT活性最大值為271.9 U/g(DW),與不接種組相比存在顯著性差異(P<0.05),并且與無鹽脅迫組含量基本一致。
由圖6-C可知在75 mmol/L NaCl鹽脅迫下,接種YM6菌株后,玉米植株地上、地下部分SOD活性均顯著高于鹽脅迫不接種組(P< 0.05),地上部分SOD活性最大值為282.28 U/g(DW)。
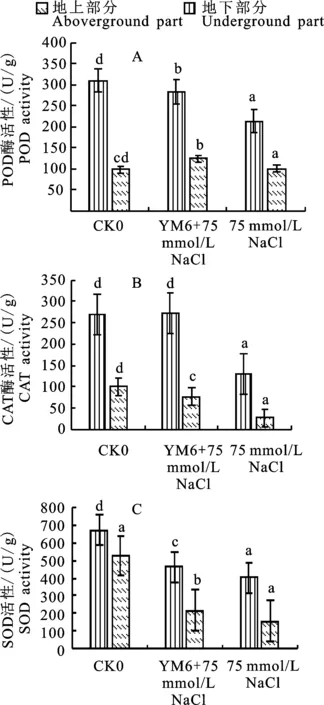
圖6 鹽脅迫與接種YM6菌株后玉米抗氧化酶活性Fig.6 YM6 strain on the activity of antioxidant enzymes in maize under salt stress
3 討 論
3.1 YM6菌株對NaCl鹽脅迫下玉米根際細胞的保護作用
根系作為最先感知外界脅迫的植物器官,其結構與功能完整對提高植物抗逆性具有重大作用[20],細胞壁與細胞膜為細胞最外層的保護組織,可保護植物細胞內部器官免受損害,鹽脅迫可增加細胞滲透壓,造成細胞內離子失衡,細胞內水分外流導致細胞完整性被破壞,從而產生質壁分離現象[21]。玉米作為非鹽生植物,受鹽脅迫影響根尖細胞發生明顯質壁分離現象,原生質體內縮,細胞結構發生改變;細胞核固縮,其完整性遭受破壞,且細胞內線粒體產生空腔,部分發生破損,這與非鹽生植物膜質結構及氣孔導度密切相關[22]。試驗結果發現接種試驗組玉米根尖細胞核發生分裂,細胞核一分為二,細胞核固縮程度較鹽脅迫不接種組明顯減緩,且線粒體結構完整性優于鹽脅迫無菌組,接種組可見完整胞間連絲。其機理可能是菌株YM6可調節植物離子平衡,保護細胞核及其他細胞器完整性[16],從而提高玉米根系應對鹽脅迫的能力。
3.2 YM6菌株對鹽脅迫下玉米幼苗Pro、MDA、H2O2的影響
植物為適應鹽堿環境,細胞大量積累滲透調節物質,包括脯氨酸、甜菜堿、可溶性蛋白質、多元醇與糖類等,合成此類物質可防止細胞水分流失,提高植物對鹽堿環境的適應能力[23]。本試驗中,鹽脅迫條件下,接種YM6菌株后玉米植株內Pro質量分數顯著增加,提高玉米植株應對鹽脅迫的能力;MDA作為檢測植物細胞膜質氧化能力的指標[24],反映植物受逆境脅迫損傷的程度[25],試驗結果表明,當接種YM6菌株后玉米植株地上部分MDA顯著低于鹽脅迫不接種組,說明YM6菌株可有效降低鹽脅迫對玉米植株損傷,陳淋[9]認為這與解淀粉芽孢桿菌參與植物相關耐鹽基因調控密切相關。本試驗結果發現H2O2與MDA變化一致,研究表明H2O2積累會造成細胞損傷[26],YM6菌株通過降低玉米植株內氧化物質積累,提高調節滲透劑含量從而減緩鹽脅迫損傷[17],提高玉米植株抗性。
3.3 YM6菌株對鹽脅迫下玉米幼苗SOD、POD、CAT活性的影響
SOD、POD、CAT等酶活性變化與植物耐受脅迫程度有關[27],鹽脅迫條件下,玉米植株受脅迫影響,為應對不良環境自身抗氧化物質含量會發生改變[28]。在鹽脅迫條件下,接種YM6菌株,玉米植株內SOD、POD、CAT活性上升,從而更有利于清除玉米植株內自由基、降低氧化物積累,緩解鹽脅迫損傷,這與劉洪光[29]對于AM真菌對提高枸杞耐鹽機理研究一致,但對于YM6菌株誘導其他濃度鹽脅迫下玉米植株內抗氧化酶活性變化情況有待進一步研究。
4 結 論
鹽脅迫造成玉米植株內氧化物及MDA濃度積累,導致植物細胞受氧化脅迫損傷,細胞形態結構及細胞器發生改變。75 mmol/L NaCl鹽脅迫條件下,接種YM6菌株,玉米植株內氧化物及氧化物酶活性均發生改變,POD活性最大值為461.11 U/g(DW),Pro質量分數最大值為 120.72 μg/g(DW),YM6菌株增強宿主植物清除自由基的能力,保護植物細胞的超微結構,提高玉米耐鹽能力,這與提高玉米耐鹽機制密切相關。分析解淀粉芽孢桿菌YM6對誘導鹽脅迫下玉米幼苗內氧化酶系及抗氧化物等生理生化指標的影響,為探究PGPR促生機理及鹽堿地菌株資源開發利用提供支持。

