125I粒子植入或3DCRT聯合TACE治療晚期原發性肝癌患者臨床療效對比研究*
胡 鴻,廖運國,魏 欣,唐梓瑜,鄧 丹,蒲嘉騏,鐘立明
原發性肝癌(PLC)是臨床常見的消化系統惡性腫瘤。有數據顯示PLC死亡率居惡性腫瘤的第二位,其發病率居全世界腫瘤發病率的第四或第五位[1]。PLC早期發病隱匿,進展迅速,在確診患者中僅有20%~30%可手術切除[2]。經導管肝動脈化療栓塞(transcatheter arterial chemoembolization,TACE)是晚期PLC首選的治療方法,但近年來研究顯示TACE存在栓塞不徹底和側支循環形成等問題[3],單純TACE治療復發率較高。因此,TACE聯合其他治療方法逐漸被臨床重視。125I粒子植入和三維適形放射治療(three-dimensional suitable radiotherapy,3DCRT)是目前臨床治療晚期PLC患者的重要方法[4,5]。近年來,本院將兩種方法分別聯合TACE用于治療晚期PLC患者,取得了一定的療效,現將結果報道如下。
1 資料與方法
1.1 一般資料 2016年1月~2018年3月我院診治的不能手術切除的肝細胞癌(HCC)患者92例,男57例,女35例;年齡43~62歲,平均年齡為(51.84±9.07)歲。體質指數為17~23 kg/m2,平均為(20.75±2.36)kg/m2。診斷參照《原發性肝癌規范化診治專家共識》,經CT引導下肝穿刺病理學檢查診斷為HCC。肝功能Child-Pugh A級13例,B級60例,C級19例[6]。排除標準:(1) 合并有其他原發性惡性腫瘤者;(2) 既往有精神病史者;(3) 對治療藥物過敏者;(4) 既往有肝臟外科手術史者。采用隨機數字表法將患者分為觀察組和對照組,每組46例,兩組性別、年齡、腫瘤大小、腫瘤分期和肝功能分級等基本資料比較,差異均無統計學意義(P>0.05),具有可比性。患者簽署知情同意書,本研究經我院醫學倫理委員會批準。
1.2 治療方案 觀察組先接受TACE治療:采用改良的Seldinger技術經股動脈穿刺,置入血管鞘,依次插管至主動脈、腹腔動脈干和腸系膜上動脈,造影,明確腫瘤血供。然后,用微導管超選擇插管至靶血管。根據患者年齡、一般情況、腫瘤病灶大小、肝功能狀態和腫瘤血供等確定化療栓塞藥物劑量,應用氟尿嘧啶和吡柔比星,經微導管緩慢灌注,栓塞劑為CallSpheres栓塞微球,在透視監視下經微導管緩慢注入栓塞,以腫瘤血管不見確切的顯影為栓塞終點。拔管,局部壓迫止血。在TACE治療后2~3 w,行125I粒子置入治療:采用放射性粒子植入計劃系統勾畫治療靶區(腫瘤原發灶及其肝內轉移灶),設置125I粒子穿刺針路徑,按照100%處方劑量覆蓋95%計劃靶區的原則[7],確定放置粒子的數量和劑量。根據植入計劃,用離子槍將125I粒子植入病灶內。在植入完成后,行CT掃描復查驗證;對照組接受3DCRT聯合TACE治療,即在TACE治療后2~3 w,再行3DCRT治療,具體方法:采用三維適形治療計劃系統勾畫腫瘤靶區和臨床靶區,計算放射劑量,取4~6個適形照射野等中心聚焦照射靶區,總劑量為30~48 Gy,分10~12次照射,隔日1次照射。
1.3 療效評價 在治療結束后接受隨訪,每周電話聯系1次,詢問患者病情,在隨訪4 w后,參照實體瘤療效評估標準(response evaluation criteria in solid tumors, RECIST)評價療效[8]:完全緩解(complete response,CR):腫瘤病灶消失并持續4 w以上;部分緩解(partial response,PR):腫瘤最大直徑縮小一半以上,并持續4 w以上;疾病穩定(stable disease,SD):腫瘤最大直徑縮小不足50%,但增大不超過25%,且持續4 w以上;疾病惡化(progression disease,PD):腫瘤最大直徑增大超過25%。以(CR+PR+SD)/總例數×100%為疾病控制率。
1.4 不良反應評價 根據美國國立癌癥研究所不良事件通用3.0版記錄不良反應[9],Ⅰ級:不良反應輕微,無需特殊干預;Ⅱ級:有臨床癥狀,不影響正常生活和活動;Ⅲ級:不良反應嚴重,需積極干預;Ⅳ級:不良反應嚴重,危及生命。不良反應包括白細胞降低、貧血、血小板降低、胃腸道反應和放射性肝損傷。放射性肝損傷標準[10]:在放療結束后4個月內出現:(1)肝臟腫大,不伴黃疸;(2)血清堿性磷酸酶超過正常值上限2倍;(3)總膽紅素超過正常值上限3倍;(4)丙氨酸氨基轉移酶或天冬氨酸氨基轉移酶超過正常值上限5倍。滿足1~4項中任一項者,即作出診斷。
1.5 血清指標檢測 采用電化學發光法檢測血清AFP(采用克曼庫爾特UniCel Dxl 800全自動化學發光免疫分析儀);采用ELISA法檢測血清甲胎蛋白異質體(AFP-L3)和高爾基體蛋白73(GP73,上海研謹生物科技有限公司)。
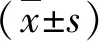
2 結果
2.1 兩組療效比較 兩組近期疾病控制率無顯著性差異(P>0.05,表1)。在治療結束后隨訪1年,無失訪病例,觀察組生存24例(52.2%),對照組生存20例(43.5%),差異無統計學意義(x2=0.697,P=0.404)。
表1 兩組療效[n(%)] 比較

例數CRPRSDPD疾病控制觀察組460(0.0)15(32.6)13(28.3)18(39.1)28(60.9)對照組460(0.0)12(26.1)14(30.4)20(43.5)26(56.5)
2.2 兩組血清指標變化的比較 治療前和治療后1月,兩組血清AFP、AFP-L3和GP73水平比較,差異均無統計學意義(P>0.05,表2)。

表2 兩組血清指標 比較
2.3 兩組放化療不良反應比較 在治療期間,兩組白細胞降低、貧血、血小板降低和胃腸道反應發生率比較,差異均無統計學意義(P>0.05),觀察組放射性肝損傷嚴重程度較對照組顯著減輕,差異有統計學意義(P<0.05,表3)。

表3 兩組放化療不良反應比較
3 討論
PLC惡性程度高、愈后差。TACE是治療晚期肝癌患者最主要的一種手段。TACE將高濃度的化療藥物注入腫瘤病灶內,再通過栓塞劑對腫瘤供血血管進行栓塞,使腫瘤在缺血缺氧的雙重作用下失活,同時達到毒性滅活腫瘤細胞的作用,發揮抗腫瘤效果。該方法可明顯提高患者的生活質量,延長患者的生存期,已得到業界的認可[11]。但隨著TACE臨床應用的推廣,有報道顯示部分患者在TACE術后腫瘤復發率高,且對栓塞化療藥物可逐漸發生耐藥現象,影響治療效果[12]。因此,臨床逐漸將TACE與其它治療手段聯合,以提高療效,而聯合治療也成為晚期肝癌患者的主要治療原則。
3DCRT采用立體定向等關鍵技術,利用共面和非共面多弧照射,使放射高劑量區的空間分布和腫瘤形態保持一致,從而有效控制病灶[13],提高治療效果。但近年來已有關于3DCRT治療導致放射性損傷的多項報道。放射治療使受照射部位癌細胞壞死,但副作用的出現可能影響了患者預后[14,15]。125I粒子植入則是通過植入微型放射源125I粒子,持續發射γ射線,進而破壞腫瘤組織,使DNA雙鏈發生斷裂,從而使腫瘤細胞失去增殖能力。γ射線對腫瘤DNA分子鏈不僅有直接的損傷作用,還可通過電離機體內水分子,產生自由基,與生物大分子相互作用,使得腫瘤組織細胞發生損傷[16,17]。既往也有相關報道顯示125I粒子植入用于治療PLC患者的報道。在一項植入125I粒子聯合TACE治療晚期PLC患者76例的研究中,腫瘤控制率為63.2%,與本研究結果相近[18]。本研究還顯示觀察組疾病控制率和1 a生存率與對照組比較差異無統計學意義,提示兩種方案近期療效相近,但125I粒子植入后粒子放射活度較小,腫瘤周圍正常組織受到的照射劑量較小,從而減輕了對周圍正常組織的傷害[19]。本研究結果也顯示觀察組患者放射性損傷嚴重程度較對照組減輕,可能與此有關。
AFP和AFP-L3是目前臨床常用的PLC腫瘤標記物。本研究結果顯示治療后兩組血清
AFP和AFP-L3較治療前均顯著降低,而治療后兩組間無顯著性差異,提示AFP和AFP-L3有助于評估抗腫瘤的治療效果,但血清AFP和AFP-L3水平不能反映兩種治療方案療效的差異。GP73是高爾基體內的跨膜蛋白,GP73主要由膽管上皮細胞分泌,健康機體肝細胞不表達或低表達。當肝細胞發生癌變后,血清GP73水平異常升高,是近年來新發現的PLC腫瘤標記物。GP73異常升高多提示肝臟儲備功能降低,肝細胞損傷和肝纖維化程度加重,GP73水平與肝臟功能和抗腫瘤效果具有良好的一致性[20]。本研究結果顯示治療后觀察組血清GP73水平顯著低于對照組,提示TACE聯合125I粒子植入較對照組對肝臟的損傷小,監測血清GP73水平將有助于評估晚期PLC患者的治療效果,而降低血清GP73水平也可能是125I粒子植入發揮抗腫瘤作用,降低腫瘤復發率的原因之一,但其具體機制仍有待研究。
綜上所述,125I粒子植入聯合TACE治療HCC患者的近期療效與3DCRT聯合TACE治療方案效果相近,但瘤體內125I粒子植入的放射性損傷可能更小,更有利于保護肝功能。

