術前NLR水平對TACE聯合MWA治療的巨塊型原發性肝癌患者生存時間的影響*
王 瑋,杜曉菲,路運健
流行病學研究顯示,世界范圍內原發性肝癌(PLC)發病率居于惡性腫瘤的第5位,目前我國每年因PLC死亡患者人數約占全球總死亡人數的50%~55%[1]。PLC患者早期癥狀多較為隱匿,約60%~80%患者初次診斷時已喪失手術治療的機會[2]。經動脈化療栓塞術(TACE)手術以其操作簡便、微創、總體療效好、可重復治療和術后并發癥少等優勢越來越受到醫學界的認可,目前已成為外科手術無法切除的PLC患者的首選治療手段之一,但單獨行TACE 治療PLC患者仍然存在腫瘤壞死率低、復發率高和遠期生存時間短等問題,無法滿足臨床治療的需要[3,4]。多項臨床報道提示[5,6],對于腫瘤直徑<5 cm的PLC患者采用消融術治療的療效與外科手術相當。國內外學者探索了采用TACE 聯合微波消融(MWA)方案治療巨塊型PLC患者,取得了令人滿意的效果。近年來,相關研究發現中性粒細胞數與淋巴細胞數比率(NLR)在癌癥患者治療過程中的動態變化可反映機體炎癥活動和免疫系統功能狀態,可能是預測臨床預后的潛在指標[7]。本文回顧性分析了我院采用TACE聯合MWA治療的巨塊型PLC患者的臨床資料,根據術前NLR水平分為NLR≥2.37組47例和NLR<2.37組40例,比較了兩組術后的預后情況,現報道如下。
1 資料與方法
1.1 臨床資料 2007年1月~2013年10月我科收治的巨塊型PLC患者87例,經血清學、影像學和組織病理學檢查證實為肝細胞癌(HCC),肝功能Child-Pugh A 級或B 級,腫瘤數量≤3個,腫瘤直徑>5 cm,入組前均未接受過其他治療。排除標準:①預計生存期<3個月;②肝外轉移或腫瘤累及門靜脈主干;③合并其他系統惡性腫瘤;④嚴重的內分泌系統疾病;⑤血液系統疾病;⑥心腦腎功能障礙;⑦嚴重的感染。本研究經我院醫學倫理委員會批準,患者及其家屬簽署知情同意書。
1.2 治療方法 對入選患者,術前均行血常規、血生化、AFP、凝血功能指標、超聲、CT和MRI等檢查,確認無黃疸、腹水、肝性腦病或肝外轉移。術前1周,根據血常規指標計算NLR。TACE 聯合MWA治療方法:常規消毒鋪巾,局部麻醉,采用Seldinger法由右側股動脈穿刺置管(4FRH),超選擇性插入肝動脈。再行DSA 造影,確認腫瘤供血動脈。將微導管(2.7 F)置入腫瘤供血動脈,將碘化油15~20 ml和表柔比星40 mg等制備成乳化劑,注入栓塞。同時,參考腫瘤血供情況,確定是否采用明膠海綿行血管栓塞,栓塞至腫瘤血管基本消失或接近基本消失。拔除導管后,對穿刺點壓迫止血,用壓力繃帶包扎,術后返回病房,給予抗生素預防感染、止血、護肝等常規對癥支持治療,心電監護>6 h;在TACE術后2周內,完成MWA治療,術前禁飲禁食>8 h。根據肝內病灶位置,在CT引導下行經皮微波消融術,使用南京福中醫療公司生產的METI-IVB 微波治療儀,微波頻率為(2450±50) MHz,輸出功率 為0~100 w,微波消融針長度為15 cm,直徑為14 G,內置水冷循環套管。治療時,注意避開肝內主要動脈和膽管,將電極插入腫瘤部位,待消融針沿腫瘤長徑插入至底部后進行消融。在消融腫瘤結束后,行肝臟 CT檢查,確認消融范圍、有無出血、壞死等。術后隨訪。
1.3 觀察指標 一般資料指標包括性別、年齡、腫瘤直徑、Child-Pugh分級、白蛋白和AFP水平,使用羅氏Cobas C3000型全自動生化分析儀檢測血生化指標;常規行血常規檢查,獲得中性粒細胞和淋巴細胞計數,計算NLR;療效評價:前三個月每月復查增強CT,觀察腫瘤病灶有無強化、壞死及碘油沉積情況,術后1個月復查AFP 水平;每3個月隨訪一次,記錄患者死亡時間和死亡原因,計算1 a、2 a、3 a生存率;記錄并發癥和不良反應發生情況,包括肝功能損傷、腹痛、發熱和嘔吐等。
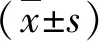
2 結果
2.1 兩組一般資料比較 見表1。
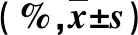
表1 兩組一般資料比較
2.2 兩組生存率比較 在治療后,低NLR組1 a、2 a和3 a生存率分別為92.5%(37/40)、62.5%(25/40)和20.0%(8/40),均顯著高于高NLR組的55.3%(26/47)、31.9%(15/47)和8.5%(4/47,P<0.05);高NLR組和低NLR組患者中位生存時間分別為13(11~17)個月和28(23~33)個月(P<0.05,圖1)。

圖1 兩組生存曲線比較
2.3 并發癥和不良反應發生情況 在全部患者中,僅2例(2.3%)在TACE 術后出現嚴重的肝功能損害,出現黃疸、腹腔積液,經護肝、支持治療后緩解。術后不良反應包括腹痛10例,發熱18例,嘔吐10例,經對癥處理后均在1~7 d內消退。
3 討論
對于早期PLC患者行根治性手術切除是目前臨床治療的首選方案,但大量臨床報道顯示,僅有不足40%的原發性肝癌患者確診后可獲得手術切除機會。同時,全身化療對于PLC患者總體效果欠佳,難以有效延長生存時間[8-9]。近年來,多個臨床診療指南推薦TACE術作為無法行手術根治切除的PLC患者的一線選擇[10]。已有研究提示[11],PLC腫瘤組織血供中90%來自肝動脈,因血供豐富,故TACE術超選擇將藥物注入腫瘤供血血管,可獲得令人滿意的療效,且對于正常肝臟組織損傷較小。但PLC腫瘤組織差異性和復雜性較大,TACE術后殘留腫瘤組織因局部缺氧引起血管內皮生長因子過度表達,誘發腫瘤復發,并可激活HBV復制,嚴重影響總體療效的改善[12]。故TACE聯合其他治療方案的重要性逐漸受到人們的關注。已有研究顯示[13],單純TACE術后腫瘤壞死率往往不足35%,且隨腫瘤組織增大壞死率顯著降低。MWA已被證實可有效提高腫瘤局部和外周血免疫細胞抗腫瘤活性,清除腫瘤微病灶,從而降低腫瘤轉移的風險[14]。MWA還能夠殺傷TACE術后殘留的腫瘤組織,壞死后的腫瘤組織進一步刺激機體產生多種抗體,提高機體免疫力,抑制腫瘤生長增殖,故TACE 聯合MWA可獲得更佳的臨床治療效果[15]。
NLR升高反映機體中性粒細胞計數增多或淋巴細胞計數減少,這一指標與炎性水平和機體免疫應答狀態具有相關性[16]。對于NLR的作用,臨床仍未完全闡明,部分學者報道提示[17],在腫瘤壞死組織和腫瘤周圍區域增生相對活躍組織中觀察到中性粒細胞浸潤增多,間接表明中性粒細胞具有促進和抑制腫瘤生長雙重作用。NLR水平升高患者中性粒細胞反應增強,且外周中性粒細胞數量顯著提高, 可刺激IL-8、 血管內皮生長因子、基質金屬蛋白酶等細胞因子合成和分泌,加快腫瘤血管新生和腫瘤組織生長[18]。淋巴細胞亦參與到機體免疫應答反應,通過釋放多種細胞因子和介導細胞毒反應,能夠對腫瘤細胞增殖產生抑制作用,而腫瘤分泌相關介質能夠導致淋巴細胞水平降低,拮抗淋巴細胞抗腫瘤反應,最終引起腫瘤復發[19,20]。
術前NLR>2.81可作為PLC患者手術切除后生存時間的預測因子,即術前NLR<2.81患者遠期生存率更高、臨床預后更好[21]。但本研究PLC患者大部分無法行手術切除,且身體機能下降更為明顯,故參考相關報道將NLR降為2.37。本研究高和低NLR患者一般資料比較,無顯著性差異(P>0.05),提示兩組具有可比性。治療后,低NLR組1 a、2 a和3 a生存率分別為92.5%(37/40)、62.5%(25/40)和20.0%(8/40),均顯著高于高NLR組的55.3%(26/47)、31.9%(15/47)和8.5%(4/47,P<0.05);高NLR組和低NLR組患者中位生存時間分別為13(11~17)個月和28(23~33)個月,差異顯著(P<0.05),證實術前NLR值≥2.37的巨塊型PLC患者生存時間更短,臨床預后更差。以往觀點認為AFP 水平可用于HCC患者治療效果的評估,同時其檢測方法簡單、方便和成熟,目前已在臨床獲得廣泛的應用[22],但對于早期預測PLC患者術后復發轉移風險方面AFP準確性較低,存在較高假陽性和假陰性,同時部分AFP不升高患者無法用于預后的預測[23,24]。采用NLR水平評估可有效解決這個不足,NLR水平能夠準確反映機體炎性反應程度喝機體免疫應答狀態,同時其檢測和計算亦較為方便,能夠隨時進行重復監測,進而指導臨床醫生調整治療方案,以改善患者的臨床預后[25]。

