應用超聲心動圖評估肝硬化患者心臟結構和功能臨床價值研究*
胡 星,孟繁坤,韓 晶,張旭輝
肝硬化是一種由多種病因引起的慢性進行性肝臟疾病。患者長期處于高動力循環狀態,典型特征為心肌收縮力下降、心輸出量增高和全身血管阻力指數減低,這種異常狀態被界定為“肝硬化性心肌病”(cirrhotic cardiomyopathy, CCM),是肝硬化患者的重要并發癥之一[1]。CCM 癥狀不典型,但在一些應激狀態下可能會引發心力衰竭,甚至出現猝死等嚴重后果,近年來引起了學者的廣泛關注[2,3]。終末期肝病模型(model for end-stage liver disease,MELD)評分公式中包含了肝腎功能指標等,是目前臨床常用的較為客觀的評價模型。我們應用超聲心動圖檢測了肝硬化患者和健康體檢者的心臟結構和功能狀況,并估算了肝硬化患者肺動脈收縮壓(pulmonary artery systolic pressure, PASP)的變化,以探討不同終末期肝病模型評分肝硬化患者心臟各項指標的變化。
1 資料與方法
1.1 一般資料 2018年4月~2019年4月在北京佑安醫院行超聲心動圖檢查的肝硬化患者124例,男性 75 例,女性 49 例;平均年齡為 53.8±10.7 歲。入選患者均符合肝硬化臨床診斷標準[4],近 3 個月無消化道出血史,既往無高血壓、糖尿病、心臟病、腎臟疾病,無惡性腫瘤病史。病因包括乙型肝炎 69 例、丙型肝炎 24 例、酒精性肝病 13 例、自身免疫性肝炎 11例和混合性(乙型肝炎合并丙型肝炎)7 例。另選擇同期在我院健康體檢者 60 例作為對照組,男性 38 例,女性 22 例;平均年齡為 52.3±11.9 歲。
1.2 彩色多普勒超聲檢查 使用 Siemens SC3000 型彩色多普勒超聲診斷儀,取左側臥位,行心臟超聲檢查。記錄受檢者心臟結構和功能指標,包括左房收縮末期內徑(left-atrial end-systolic diameter, LAs)、左室舒張末期內徑(left-ventricular end-diastolic diameter, LVd)、右房收縮末期內徑(right-atrial end-systolic diameter, RAs)和右室舒張末期內徑(right-ventricular end-diastolic diameter, RVd),計算左室射血分數(left-ventricular ejection fraction, LVEF)。應用組織多普勒成像(tissue Doppler imaging,TDI)模式檢測二尖瓣環頻譜,記錄舒張早期 Ea 峰和舒張晚期 Aa 峰,計算Ea/Aa 比值。另外,針對肝硬化患者,用連續多普勒模式獲取三尖瓣反流頻譜,記錄峰值速度(V),根據簡化的 Burnulli 方程估算 PASP,計算公式如下:PASP=4V2+RAP,RAP(right-atrial pressure)代表右心房壓力。對每例受檢者連續測量三個心動周期,對所有心臟結構和功能指標取平均值。
1.3 血生化檢測 根據結果計算肝硬化患者 MELD 評分。計算公式如下:3.8×ln 總膽紅素(mg/dl)+11.2×ln INR+9.6×ln 血清肌酐(mg/dl)+6.4×病因(膽汁性或酒精性為 0 分,其他為 1 分)[5]。根據 MELD 評分,將患者分為三組:即輕度組 49 例(MELD≤9 分)、中度組44 例(10≤MELD 評分≤19 分)和重度組 31 例(MELD≥20 分)。
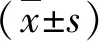
2 結果
2.1 兩組超聲檢查心臟結構和功能指標比較 肝硬化患者 LAs 和 LVd 增大,Ea/Aa 比值降低,與正常人比,差異均具有顯著性(P<0.05),而兩組 RAs、RVd 和 LVEF 比較,無顯著性差異(P>0.05,表 1)。
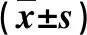
表1 兩組超聲檢查心臟結構和功能指標比較
與對照組比,①P<0.05
2.2 不同 MELD 評分患者心臟超聲參數比較 隨著終末期肝病模型評分的增加,肝硬化患者 LAs、LVd、PASP 逐漸增大(P<0.05);3 組患者LAs 和 PASP有顯著性差異,而RAs、RVd、LVEF和 Ea/Aa 比值無顯著性差異(P>0.05,表 2),其中Ea/Aa 比值<1 的患者共有 45 例,分別為輕度組 14 例(34.1%),中度組 15 例(42.9%),重度組 16 例(72.7%)。
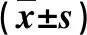
表2 不同 MELD 評分患者超聲檢查心臟相關參數的比較
與輕度組比,①P<0.05;與中度組比,②P<0.05
2.3 PASP變化情況 根據簡化的 Burnulli 方程,用三尖瓣反流速度估算 PASP,結果在納入的 124 例肝硬化患者中有 9 例(7.3%)PASP>40 mmHg【肺動脈高壓(pulmonary arterial hypertension, PAH)】,其中 2 例為中度,7 例為重度肝硬化。
3 討論
CCM 臨床表現隱匿,早期心臟形態沒有異常,屬于肝硬化的一種潛在的并發癥,但隨著病程的進展,心臟結構和功能都逐漸發生改變。其具體發病機制仍不明確,有研究認為 β腎上腺素能刺激反應的減低、電生理復極異常、GLP-1 受體激動劑等參與了疾病的發生發展[6,7]。失代償期肝硬化患者肝臟結構被破壞、肝功能減退,引起肝內功能性動靜脈短路、神經體液調節異常、外周血管廣泛性擴張、心排血量持續性增加,從而導致患者的心血管系統始終處于高動力循環狀態。這種循環系統的高動力狀態進一步導致心功能變化及心肌重構,包括心肌厚度、心臟容量和心臟質量的改變。在早期肝硬化患者,CCM的發病率較低,且基礎心輸出量的增加和外周血管的舒張會掩蓋心力衰竭的表現,心功能的異常往往被忽視。而當患者處于生理應激或手術狀態時,就可能出現心臟功能障礙甚至心力衰竭或猝死。早期發現肝硬化患者的心臟異常并給予準確的評估,可以盡早采取有效措施預防病情進一步發展,同時避免不恰當的治療。
MELD 評分系統是 2001 年 Kamath et al提出的評價系統,該評分系統充分考慮了不同病因及腎功能變化對預后的影響,并將模型中不同參數賦予了不同的權重,其連續型分值能更好地反映肝病的嚴重程度,是迄今為止較為理想的評價模型。MELD評分能夠很好地反映肝功能儲備功能,低評分的肝硬化患者生存期較長,該評分被認為是肝移植病例選擇的良好指標[8]。
肝硬化患者心臟組織形態學和潛在的病理生理學改變為心臟容量或壓力超負荷,與心肌炎和心肌梗死等情況引起的心臟重構相似。其表現特點為心臟幾何形狀、質量和心室壁應力發生變化[9]。早期肝硬化心臟形態多無異常,隨著病程的進展,患者心臟的電生理活動逐漸減退,心臟結構出現不同程度的退行性改變,多發生于左側心臟。組織學改變包括心肌肥大、細胞間質和細胞內水腫、細胞損傷等。本研究顯示,與健康對照組比,肝硬化患者 LAs 和 LVd 增大,而RAs和RVd 無顯著性差異,說明肝硬化患者以左心結構改變為主,包括左心房增大,左心室肥大、擴張等,而右心房和右心室的形態改變不顯著。不同肝功能狀態的肝硬化患者隨著 MELD 評分的增加,LAs 和 LVd 逐漸增大,且兩者均與肝硬化疾病的嚴重程度呈正相關,與文獻報道基本一致[10,11],表明肝硬化患者左心結構的改變與肝病嚴重程度相關,隨著疾病的進展,心臟結構異常逐步加劇。
肝硬化患者心臟功能改變主要以舒張功能減退和電生理異常為主[12,13]。心臟電生理異常主要表現為QT間期延長,還包括ST-T改變、房性早搏或室性早搏、竇性心動過速等。傳統超聲使用脈沖多普勒計算二尖瓣舒張早期峰值流速 E 與舒張晚期峰值流速 A 的比值(E/A),用 E/A 比值評判左心室的舒張功能[14],但該方法在舒張功能Ⅱ級時容易出現假性正常化,從而影響對心功能的正確判斷。本研究采用 TDI 模式檢測 Ea/Aa 比值,該模式用于評價心肌組織的運動,由于減少了容量負荷的影響,Ea/Aa 在評價左心室舒張功能方面比 E/A 比值更敏感和更特異。在正常情況下 Ea/Aa比值>1,而 Ea/Aa 比值小于 1 ,提示心室舒張功能減低。本研究發現,與對照組相比,肝硬化患者 Ea/Aa 比值降低,且 Ea/Aa比值>1 在肝功能很差的肝硬化患者所占的比例明顯高于肝功能尚好的患者,說明相對于早期肝硬化,終末期肝病患者左室舒張功能障礙更為多見。另外,當心室舒張功能減低時,心房向心室血流充盈受限,從而導致心房淤血、容積增大,最終導致左房腔擴大[15]。左房的大小代表了左室充盈壓的高低,可以反映左心室舒張功能的變化,也是發生心力衰竭的有效預測因子。本研究肝硬化患者左房大小隨著肝病嚴重程度的加重而逐漸增大,說明患者的舒張功能減低的程度隨著病情嚴重程度而進行性加重。
肝硬化患者門靜脈高壓(portal hypertension,PH)和高動力循環有可能會導致門靜脈性肺動脈高壓(portopulmonary hypertension,POPH)。POPH 是在無其他 PAH 成因的情況下形成的與 PH 相關的前毛細血管PAH。有報道稱,在等待肝移植的患者中,肺動脈高壓的發病率為 6.5%~8.5%[16]。本研究發現,隨著肝病嚴重程度的增加,患者的PASP 逐漸增加,且壓力與 MELD 評分分值呈正相關。測量肺動脈壓的金標準是右心導管術,但該方法具有侵入性且價格昂貴,在臨床無法成為篩選和監測患者肺動脈壓力的常規方法。有研究稱用超聲心動圖測量的 PASP 預測 PAH 的靈敏度和特異度分別為 73.6%和 75.6%[17]。我們通過超聲心動圖進行肺動脈壓的估算,由于根據三尖瓣反流頻譜峰值速度常高估PASP,根據國內外專家共識,當估測的壓力大于 40 mmHg 才認為存在 PAH[18]。本研究 124 例肝硬化患者中有 9 例患者 PASP>40mmHg,其中 2 例分布在中度組,7 例分布在重度組,在本研究納入的肝硬化患者中 PAH 患病率為 7.3%。肝移植、經頸靜脈肝內門體分流、治療性穿刺術等外科干預都可能會促成不良的心臟預后[19]。肺動脈壓力的評估和監測在肝移植及其他肝臟外科手術的圍手術期都非常重要[20]。POPH發病率低但預后較差,目前尚無特別有效的治療方法。2013年美國肝病學會和肝移植學會發布實踐指南指出:肝移植候選人群應進行常規超聲心動圖檢查以排除POPH。

