特利加壓素聯合前列地爾輔助腹水超濾濃縮回輸治療肝硬化并發難治性腹水患者療效分析*
張惠勇,吳秀欣,徐成潤
失代償期肝硬化易并發難治性腹水,后者往往伴有氮質血癥[1,2]。由于肝硬化患者肝臟結構改變、肝臟功能受損,容易引發門脈高壓和低蛋白血癥,對內毒素的清除能力降低,在內毒素和細胞因子的刺激下產生大量的一氧化氮(nitricoxide,NO),導致頑固性腹水,引發肝腎綜合征等多種并發癥[3,4]。腹水超濾濃縮回輸治療具有操作簡單、創傷小等優勢,但該療法需要大量放腹水,容易引起相關并發癥[5]。因此,在腹水超濾濃縮回輸治療過程中輔助用藥是提高治療效果的關鍵。特利加壓素和前列地爾均可有效地改善腎臟微循環,增加腎臟血流灌注,提高腎小球濾過率,進而減少腹水的生成。本研究在采取腹水超濾濃縮回輸治療的基礎上,聯合使用特利加壓素和前列地爾輔助治療取得了較好的效果,現報道如下。
1 資料與方法
1.1 一般資料 2017年3月~2018年6月在我院感染病科住院治療的肝硬化并發難治性腹水患者104例,男性64例,女性40例;年齡36~75歲,平均年齡為(51.6±9.4)歲。所有患者均符合美國肝病學會發布的《肝硬化腹水治療指南》的相關診斷標準[7],其中乙型肝炎肝硬化73例,酒精性肝硬化31例;肝硬化病程1~4年,平均(1.9±0.7)年;Child-Pugh A級31例,B級39例,C級34例[6]。腹水持續>3月或常規治療后腹水難以消退;腎小球濾過率低于正常值,24小時尿鈉低于10 mmoL,血鈉低于130 mmoL/L。排除標準:①伴有消化道活動性出血、肝膿腫或肝性腦病;②存在惡性腫瘤等其他原因導致的腹水;③不能耐受腹水超濾濃縮回輸或對本研究所用藥物過敏者;④存在自身免疫性、毒物和藥物性、代謝性肝損傷導致的肝硬化。隨機將患者分為腹水回輸組和綜合治療組,兩組性別、年齡、肝硬化病因和肝功能分級等一般資料比較具有良好的可比性(P>0.05)。所有患者簽署知情同意書,本研究經我院醫學倫理委員會審核通過。
1.2 治療方法 所有患者入組后完善各項檢查,給予抗生素控制感染、限鈉限水、常規給予小劑量利尿劑。在行腹水超濾濃縮回輸治療時,患者取仰臥位或半臥位,局部皮膚消毒,注射利多卡因局部麻醉,設備管道肝素化,使用套管針(16#)穿刺,選擇左下腹為穿刺點,穿刺成功后,取出硬針,留置兩根引流軟管,分別連接腹水輸出端和回輸端,形成腹腔閉合回路。開啟正壓泵經腹水輸出端軟管抽吸出腹水(100~150 mL/min,1.0~1.5 h),經濃縮過濾器行超濾濃縮處理后,再將腹水經回輸端軟管輸入腹腔。然后,經回輸軟管注入多巴胺40 mg,拔除引流管,加壓包扎腹部72 h。每周1次,共2次。一次性濾出液體3000~5000 mL,全程心電監護;綜合治療組則在此基礎上加用前列地爾注射液(北京泰德制藥股份有限公司,國藥準字:H10980023)10 μg加入0.9%氯化鈉溶液100 mL和注射用特利加壓素(德國輝凌Ferring GmbH,注冊證號:H20091056)2 mg加入0.9%氯化鈉注射液100 ml中靜脈滴注,1次/d,持續給藥1周。
1.3 指標檢測 使用超聲診斷儀(XW80A,三星麥迪遜有限公司)測量門靜脈內徑(diameter of main portal vein,Dpv)、脾靜脈內徑(diameter of splenic vein,Dsv)、門靜脈血流速度(velocity of main portal vein,Vpv)和脾靜脈血流速度(velocity of splenic vein,Vsv);采用ELISA法檢測血清NO水平(上海心語生物科技有限公司);采用比色法檢測血清內皮素-1(endothelin-1,ET-1)水平(美國R&D公司);采用鱟試劑定量檢驗血清內毒素水平(上海生化研究所)。
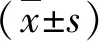
2 結果
2.1 兩組門脈系統靜脈內徑和血流速度變化比較 治療前,兩組Dpv、Dsv、Vpv和Vsv比較無顯著性統計學差異(P>0.05);在治療后1周,綜合治療組Vpv和Vsv顯著快于腹水回輸組(P<0.05,表1)。
2.2 兩組血清指標比較 治療前,兩組患者血清NO、ET-1和內毒素水平無顯著性統計學差異(P>0.05);治療后,綜合治療組血清NO、ET-1和內毒素水平顯著低于腹水回輸組(P<0.05,表2)。
2.3 兩組腹圍、腹水量和尿量比較 治療前,兩組腹圍、腹水量和24 h尿量無顯著統計學差異(P>0.05);治療后1周,綜合治療組腹圍和腹水量顯著低于,而24 h尿量顯著大于腹水回輸組(P<0.05,表3)。
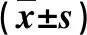
表1 兩組門靜脈系統指標比較
與腹水回輸組比,①P<0.05
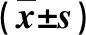
表2 兩組血清指標比較
與腹水回輸組比,①P<0.05
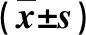
表3 兩組腹圍、腹水量和尿量比較
與腹水回輸組比,①P<0.05
2.4 兩組腹水消退情況 治療后6個月,綜合治療組腹水消退35例(67.3%),顯著高于腹水濃縮回輸組的14例(26.9%,P<0.05)。
3 討論
難治性腹水是失代償期肝硬化的常見并發癥。若不能良好的控制易發展為肝腎綜合征,其發病機制主要是肝硬化引起的淋巴回流增加、低蛋白血癥、門脈高壓,導致血漿容量和細胞外液減少,腹腔積液無法參與血循環,激活了體內腎素-血管緊張素-醛固酮系統(renin-angiotensin-aldosterone system, RAAS)和交感神經系統,導致腎血管收縮,腎小球濾過率降低,出現水鈉潴留,產生頑固性腹水[8,9]。肝移植是最佳的治療方案,但受限于供體匱乏、臨床技術要求高等因素,目前多采用中西醫保守治療。特利加壓素聯合前列地爾是常用的治療藥物,但其臨床療效不夠顯著。本研究將其與近年來發展較好的腹水超濾濃縮回輸療法聯合使用,發現腹水消退率為67.3%,顯著高于單獨采用腹水超濾濃縮回輸治療的26.9%,臨床療效更加顯著。通過對各指標的觀察,推測聯合藥物的應用具有更好的改善內環境紊亂,促進血液循環的作用[10,11]。
肝硬化患者多伴有肝小葉結構破壞,可壓迫肝臟,扭曲內臟血管床,進而導致門脈壓力增高,肝竇和腸系膜毛細血管靜水壓升高,外周血管擴張,脾臟的靜脈回流受阻,容易出現瘀血而腫大,患者Dpv和Dsv均升高[12]。本研究結果顯示,治療后,Vpv和Vsv顯著快于腹水回輸組,說明腹水超濾濃縮回輸聯合特利加壓素和前列地爾的綜合療法可顯著改善血循環,提高血流速度。因血管保護劑前列地爾可通過激活血小板膜上的腺苷酸環化酶,抑制鈣離子游離和去甲腎上腺素活性,抑制RAAS激活,從而抑制血小板聚集,并逆轉已經活化的血小板功能,降低外周血管阻力,顯著改善微循環,提高門靜脈和脾靜脈血流速度[13]。特利加壓素屬于人工合成的多肽,是一種血管加壓素類似物,不僅可通過酶切作用緩慢釋放加壓素,還可抑制RAAS,從而改善腎臟血流灌注,降低門靜脈血流壓力和腎動脈阻力,收縮內臟血管,減輕竇后梗阻,拮抗異常的血流動力學現象,有利于改善機體代謝和水鈉潴留狀態[14,15]。
NO、ET-1和內毒素均為重要的血管損傷性標志物,且可相互作用,促進其含量升高,協同加重肝硬化的高動力循環狀態[16]。本研究結果顯示,治療后,綜合治療組血清NO、ET-1和內毒素水平均顯著低于腹水回輸組,說明腹水超濾濃縮回輸聯合特利加壓素和前列地爾的綜合療法可有效降低NO、ET-1和內毒素水平,改善肝硬化的高動力循環。因腹水超濾濃縮回輸可將部分電解質,如尿素氮、肌酐、鉀離子等小分子無機物、多余水分、內霉素等進行過濾,間接地發揮了腎臟替代功能,可減輕腎臟的做功負荷,有利于腎功能的恢復,還能保留絕大多數的蛋白質、巨噬細胞和補體C3等有益物質,通過回輸腹腔,并改善循環系統,能夠有效提高血漿膠體滲透壓力、增加血容量,發揮較好的降低腎血管壓力、改善排尿情況等作用[17]。此外,血液中的血管活性肽、內毒素等物質被濾除后,激活的RAAS可再次得到活性拮抗,且不會引起致熱源反應,有利于改善腎功能,促進腎小球濾過率恢復正常,進而減輕水鈉潴留,減少腹水量,促進尿液的正常排泄[18]。在此基礎上,加用特利加壓素聯合前列地爾后,可進一步增加血容量,緩解微循環障礙,增加患者腎臟血流灌注和腎小球濾過率,促進腎臟排水功能,減少腹水的形成。故而,治療后,綜合治療組腹圍和腹水深度顯著低于對照組,而24 h尿量顯著大于單純腹水回輸組。
綜上所述,特利加壓素聯合前列地爾輔助腹水超濾濃縮回輸治療肝硬化并發難治性腹水患者具有較好的臨床治療效果,可顯著改善患者血液微循環和肝腎功能,有助于提高腹水消退率,但其遠期療效還有待于觀察。

