熱量限制飲食對非酒精性脂肪性肝病患者胰島素抵抗、血脂和氧化應激指標的影響*
任國亮,李連生,劉 剛,豐 帆,劉 婧
作為肝臟疾病和相關死亡的主要原因,非酒精性脂肪性肝病(NAFLD)是全世界最常見的慢性肝病類型。NAFLD的病理學變化可以從肝臟脂肪變性到非酒精性脂肪性肝炎(NASH),最終導致肝硬化的發生[1,2]。研究表明,胰島素抵抗(IR)在NAFLD形成的肝臟脂肪變性和NASH兩個階段均起到了關鍵性作用,而這兩個階段被證明與肝臟脂肪含量直接相關。NAFLD患者肝臟和血清氧化代謝產物增多,提示氧化應激在NAFLD的發生發展過程中起著關鍵作用[3,4]。到目前為止,還沒有針對NAFLD的特異性治療藥物。通過飲食和運動調節改變生活方式被認為是治療NAFLD最有效的策略。合適的營養限制熱量飲食可顯著改善超重和肥胖的NAFLD患者的肝功能指標[5,6]。本研究的目的是評估限制熱量飲食對NAFLD患者胰島素抵抗、血脂譜和氧化應激指標的影響。
1 資料與方法
1.1 一般資料 2018年1月~2019年1月我院診治的NAFLD患者124例,男性74例,女性50例;年齡為(38.8±7.2)歲。NAFLD診斷依據中華醫學會肝病學分會脂肪肝和酒精性肝病學組制定的《非酒精性脂肪性肝病診療指南(2018年修訂版)》標準[7]。排除標準:(1)過去3個月內進行過減肥飲食;(2)服用降血糖、降血脂和降血壓藥物;(3)伴有消化道出血、泌尿系結石、腦血管意外、缺血性心臟病、進展性視網膜病變。將患者隨機分為A組和B組,兩組一般資料比較,無統計學差異(P>0.05)。受試者簽署相關知情同意書,本研究通過我院醫學倫理委員會批準。
1.2 飲食控制措施 在A組,采用限制熱量飲食模式,參考Finer N et al發表的文獻[8],給予每日熱量攝入為1200~1500 kcal,同時在研究期間限制動物脂肪和含較高飽和脂肪酸的脂肪攝入,多進食蔬菜類、水果類和豆制品;B組患者自行設計飲食模式。整個研究周期為12周。
1.3 檢測方法 使用ADVIA型全自動生化分析儀(西門子醫學診斷產品有限公司,上海)測定空腹血糖(FPG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)、甘油三酯(TG)和總膽固醇(TC);使用Tecan Freedom Evolyzer-2000型全自動酶聯免疫分析儀(TECAN公司,瑞士)測定血清胰島素水平(全自動酶聯免疫法);使用UV1800PC型紫外可見分光光度計(江蘇盛藍儀器制造有限公司)測定血清丙二醛(MDA)。根據公式計算胰島素抵抗指數(HOMA-IR):HOMA-IR=FPG(mg/dL)×空腹胰島素(μIU/mL)/22.5,胰島B細胞功能(HOMA-B):HOMA-B(%)=20×空腹胰島素(μIU/mL)/[FPG(mg/dL)-3.5]和胰島素敏感性檢測指標(QUICKI):QUICKI=1/{lg[空腹胰島素(μIU/mL)+lg[FPG(mg/dL)]}。
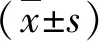
2 結果
2.1 兩組糖代謝指標比較 治療前,兩組糖代謝指標無顯著性差異(P>0.05);經過12周飲食治療后,A組HOMA-IR顯著低于B組(P<0.05),而QUICKI顯著高于B組(P<0.05,表1)。
2.2 兩組血脂譜比較 治療前,兩組血脂指標HDL、LDL、TG和TC水平無顯著性差異(P>0.05);在12周觀察期末,A組血LDL、TC和TG水平顯著低于(P<0.05),而血HDL水平顯著高于B組(P<0.05,表2)。
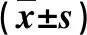
表1 兩組患者治療前后血糖指標比較
與B組患者比,①P<0.05
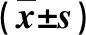
表2 兩組治療前后血脂譜比較
與B組患者比,①P<0.05
2.3 兩組血清MDA水平比較 治療前,A組血MDA水平為(60.6±35.2)μmol/L,與B組[(60.7±36.2)μmol/L,P>0.05]比,無顯著性差異;在12周觀察期末,A組血MDA水平為(55.5±35.8)μmol/L,顯著低于B組[(60.3±34.3)μmol/L,P<0.05]。
3 討論
NAFLD是一類排除因酒精性損肝傷因素后的肝內脂肪過度沉積的臨床病理綜合征。隨著肥胖及其相關代謝綜合征的流行,NAFLD已成為我國部分富裕地區慢性肝臟疾病的主要病因之一[9]。NAFLD發病原因與胰島素抵抗及遺傳易感性有關,臨床表現主要為出現超重、向心性肥胖、空腹血糖增高、血脂紊亂、高血壓等代謝綜合征的臨床表現[10,11]。NAFLD與機體內膽固醇改變、血清TG水平增高以及健康相關生活質量顯著下降均有明顯的關聯。飲食習慣的改變被認為是治療NAFLD有效的策略,采用熱量限制飲食模式后能夠有效控制目標患者食物的熱量。當將機體的能量消耗量調低,能夠達到減重的目的,同時經熱量控制飲食治療后并不會導致營養不良狀態的出現。研究表明,熱量限制飲食可明顯改善超重和肥胖的NAFLD患者各項代謝參數,對這些患者的身體狀態有著明顯的改善。本研究的目的是評估熱量限制飲食對NAFLD患者胰島素抵抗、血脂譜和氧化應激指標等各項指標的影響。
NAFLD與一系列的肝臟疾病相關,從單純脂肪變性到炎癥性脂肪性肝炎,以及肝硬化和終末期肝病等的出現。大多數NAFLD患者伴有血脂異常、氧化應激水平升高及葡萄糖代謝產物紊亂等。這些異常的代謝情況可能導致多種并發癥,如代謝綜合征的進展、心血管和腎臟并發癥的出現、急慢性肝功能衰竭、肝細胞癌風險增加、門靜脈高壓以及出血風險等[12]。HOMA-IR、QUICKI等指標是基于空腹血糖及空腹胰島素計算的,可以反映患者空腹胰島素敏感性,是反映糖負荷后胰島素抵抗的良好指標。本研究結果表明,經過12周限制熱量飲食后,NAFLD患者HOMA-IR和QUICKI均較對照組明顯改善,而其他如FPG、HOMA-B等指標沒有產生顯著的變化。NAFLD患者因胰島素抵抗,機體代償機制促使胰島素分泌增多,引起胰島β細胞功能衰竭,血糖升高,這或許就是NAFLD患者易于伴發糖尿病的原因。研究表明,約50%脂質代謝紊亂患者同時伴有NAFLD。由于NAFLD患者TG在體內沉積,血脂譜中常常表現為TG升高為主。一般情況下,肝臟所合成的TG以脂肪微粒的形式儲存在細胞質中,HDL通過與受體相互作用后使膽固醇從動脈壁內膜中逆行運輸至肝臟,參與氧化LDL的逆向轉運,同時可以抑制LDL氧化過程。所以,HDL有助于減輕患者體內氧化應激程度,可以進一步降低NAFLD的發生。目前的研究報道對HDL與NAFLD發生是否相關的結論尚未統一。在本研究中,經過12周限制熱量飲食治療后,A組患者HDL值顯著高于B組患者,且差異具有統計學意義,同時A組患者血LDL、TG和TC等血脂譜指標顯著低于B組患者。不過,還需要大量的前瞻性臨床研究來繼續討論HDL與NAFLD相關性。當上述LDL、TG等脂質在肝臟內沉積并對肝功能造成第一次損傷后,局部沉積于肝臟的脂質能夠引起機體大量氧自由基生成,接著氧自由基介導的氧化應激損傷可以造成機體的第二次損傷。在氧自由基引起肝細胞損傷的過程中,肝細胞內的LDL和TG等脂質與氧自由基發生氧化反應并生成 MDA。在本研究中,經過治療后的A組血清MDA顯著低于B組,說明限制熱量飲食可以改善NAFLD患者氧化應激損傷。
通過對現有的文獻檢索可知,目前關于熱量限制的公認標準尚不統一。多數學者表示每日熱量攝入在800~1500 kcal之間。另外,研究強調在制定熱量限制飲食的同時需要兼顧每例患者的體質量及身體代謝狀態。熱量限制飲食發揮其有益作用的確切分子機制尚未完全闡明[13],但越來越多的證據支持sirtuins作為細胞代謝傳感器來檢測能量的有效性和限制熱量飲食的細胞效應的介質[14,15]。目前研究表明,sirtuins能夠對機體內的代謝及代謝相關疾病產生重要的調節作用,sirtuin家族在代謝方面的作用被廣泛關注。sirtuins是一類依賴NADC的蛋白/組蛋白去乙酰酶家族,在哺乳動物中,發現sirtuin家族包含7種蛋白質(SIRT1-SIRT7),其中sirtuin-1(SIRT1)可調節多種代謝途徑,包括糖穩態、脂代謝、胰島素分泌和敏感性、細胞衰老和凋亡[16]。已有研究認為限制熱量飲食的有益細胞效應在很大程度上是通過SIRT1的誘導而實現的[17-19]。有證據表明,NAFLD患者SIRT1蛋白表達和血漿SIRT1水平降低[20]。因此,SIRT1是預防和減少NAFLD并發癥、疾病發展和進展為肝炎的潛在的治療靶點。

