HFE基因多態性檢測判斷慢性丙型肝炎患者疾病活動的價值*
劉億軍,段舒馨,游春芳,龔 科
丙型肝炎病毒(hepatitis C virus,HCV)感染屬世界流行性疾病,近年來其發病率呈逐年增長趨勢,大約20%~30%患者經過10~20年后可能進展為肝硬化,而每年大約1%~4%肝硬化患者會進展為肝細胞癌(HCC)[1]。目前,HCV感染后具體發病機制尚未完全明確,可能與病毒和機體免疫功能狀態等因素交互作用所致[2]。HCV感染者機體鐵負荷劇增,尤其是肝組織內鐵含量顯著上升,且與患者肝組織炎癥呈正相關[3]。遺傳性血色素沉著癥基因(hereditary hemochromatosis gene)HFE屬調控鐵吸收、代謝的關鍵基因之一。有資料顯示,HFE基因單核苷酸多態性(single nucleotide polymorphism,SNPs)與體內鐵過量儲存密切相關,其遺傳變異可能干擾機體對鐵的攝取,最終影響丙型肝炎病程進展,但目前關于這個方面的研究報道仍較少[4]。基于此,本文納入257例慢性丙型肝炎(CHC)患者,檢測了HFE基因多態性,旨在為該病臨床診治提供可參考的依據,現將結果報道如下。
1 資料與方法
1.1 一般資料 2016年11月~2018年11月我院收治的CHC患者257例,男174例,女83例;年齡18~84歲,平均年齡(52.7±5.9)歲。診斷符合《丙型肝炎防治指南(2015年更新版)》[5]的標準,入組前未接受過抗病毒治療。排除標準:(1)伴肝炎肝硬化或乙型肝炎病毒感染;(2)伴嚴重的心、腦、腎、肺和造血系統等原發性疾病;(3)精神疾患;(4)妊娠期或哺乳期婦女。包括無癥狀病毒攜帶者131例,血清抗HCV陽性,HCV RNA陰性,ALT正常,和CHC126例。患者簽署知情同意書,本研究獲得我院醫學倫理委員會批準。
1.2 檢測方法 使用日立7600型全自動生化分析儀檢測血生化指標(中生北控生物科技股份有限公司);采用酶結合免疫吸附法測定血清鐵蛋白(serum ferritin,SF)水平(上海生工生物技術有限公司);使用ABIPrismsTM-7900實時熒光定量PCR儀和TaqMan-MGB熒光探針(英國NEB公司),以實時定量PCR法檢測HFE基因rs2071303和rs9366637位點基因型,引物購自英國NEB公司。
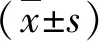
2 結果
2.1 兩組一般資料比較 兩組HCV基因Ⅰb型頻率比較差異無統計學意義(P>0.05);CHC患者血清SF、ALT、AST顯著高于病毒感染者(P<0.05,表1)。
與CHC比,①P<0.05
2.2 兩組HFE基因rs2071303和rs9366637位點不同基因型患者血清SF水平比較 CHC患者rs2071303位點GG、GA、AA基因型和rs9366637位點TT、TC、CC基因型血清SF水平顯著高于病毒感染者(P<0.05,表2)。


rs2071303GGGAAArs9366637TTTCCC病毒感染13197.6±4.297.6±4.196.7±3.797.4±4.097.2±4.099.1±4.5CHC 126199.5±45.4①207.5±34.7①198.0±44.8①206.4±35.6①208.5±34.0①178.5±58.6①
與病毒感染者比,①P<0.05
2.3 兩組HFE基因兩個多態性位點分布情況比較 HFE基因多態性位點rs2071303和rs9366637在病毒感染者中實際頻數與理論頻數分布符合HWE平衡,結果顯示,病毒感染者rs2071303位點AA基因型頻率顯著低于CHC患者(P<0.05,表3)。

表3 兩組HFE基因兩個多態性位點分布情況(%)比較
與CHC比,①P<0.05
2.4 兩組單倍型頻率分布比較 采用PHASE 2.0重構HFE基因rs2071303和rs9366637 SNP位點四種單倍型及頻率,結果顯示,病毒感染者AC單倍型頻率顯著低于CHC患者(P<0.05,表4)。

表4 兩組單倍型頻率分布(%)比較
與CHC比,①P<0.05
3 討論
HCV主要經血液/體液傳播,屬輸血后病毒性肝炎重要的病原體之一。通常,感染HCV人群易導致感染慢性化,部分患者可進展為肝硬化,甚至誘發原發性肝癌及肝衰竭。目前,大量資料表明,丙型肝炎的發生是病毒基因與環境因素共同作用的結果[6-8]。CHC患者血清SF和鐵濃度顯著增高,與正常人、自身免疫性肝炎或慢性乙型肝炎患者相比,肝組織鐵濃度也明顯增加[9]。本研究結果顯示,病毒感染者血清SF水平明顯低于CHC患者,這與上述研究結論相似。究其根源,肝臟屬人體處理、儲存、調節鐵代謝的重要器官,在機體鐵代謝平衡中起著重要作用,而HCV感染者機體鐵負荷會明顯增加,尤其是肝細胞內鐵含量上升顯著,多因HCV感染本身會干擾機體鐵代謝平衡。機體鐵負荷增加會導致肝臟病變進一步加重。有資料顯示,HCV感染者機體鐵負荷增加,尤其是肝組織內鐵含量上升顯著,與其肝臟炎癥、纖維化程度呈正相關,與肝硬化、肝癌的發生也具有相關性[10]。鐵以鐵離子或非轉鐵蛋白結合形式在丙型肝炎發病過程中發揮著重要作用,鐵離子經催化反應將活性氧中間產物如超氧陰離子、過氧化氫等轉變為具有較大毒性的羥基自由基,攻擊碳水化合物、脂質、蛋白質等生物大分子,引起肝細胞壞死、凋亡,而肝臟炎性狀態會進一步加劇氧化應激,影響丙型肝炎患者的臨床轉歸。HFE基因屬調控鐵吸收、代謝的關鍵基因,近幾年有研究表明,HFE基因多態性與丙型肝炎發病密切相關[11]。
本研究結果顯示, rs2071303位點GG、GA、AA基因型病毒感染者血清SF水平明顯低于CHC患者,rs9366637位點TT、TC、CC基因型血清SF水平明顯低于CHC患者,且病毒感染者rs2071303位點AA基因型頻率和AC單倍型頻率明顯低于CHC患者,提示攜帶HFE基因rs2071303位點突變基因型AA或AC單倍型會增加丙型肝炎病程進展的風險,與上述研究相似。HFE屬Ⅰ類組織相容性復合體相關蛋白,在肝組織中表達豐富,主要經結合轉鐵蛋白受體,形成穩定的復合物,引起轉鐵蛋白和轉鐵蛋白受體的親和力下降,從而調節機體鐵吸收。HFE基因處于第6號染色體短臂上,距HLA-A基因端粒端約4000 kb,其產物與HLA-Ⅰ類分子相似。近年來,大量報道證實HFE基因變異會引起體內鐵過量儲存,在嚴重情況下會誘發原發性血色素沉著癥,與機體鐵沉積介導的損傷作用有關[12-14]。基于血漿鐵水平較低的情況,HFE與轉鐵蛋白競爭性結合轉鐵蛋白受體1,最終誘導細胞鐵水平攝取下降;反之,轉鐵蛋白飽和度上升會降低HFE競爭性結合轉鐵蛋白受體1的能力,穩定轉鐵蛋白受體2;轉鐵蛋白受體1結合血漿轉鐵蛋白,促進鐵的攝取,同時轉鐵蛋白結合轉鐵蛋白受體1釋放HFE,導致肝鐵調素轉錄增加[15]。分子生物學研究顯示,HFE基因遺傳變異會改變體內鐵代謝通路,導致心臟、胰腺尤其是肝臟中鐵過多沉積,誘發內分泌功能紊亂、心功能異常及肝臟疾病[16]。HFE基因突變會增加鐵過載發生的風險[17]。我們推測,攜帶HFE基因rs2071303位點突變基因型AA和AC單倍型會增加鐵吸收,引起鐵過負荷,最終加重丙型肝炎的病情。
目前,國外關于HFE基因突變與HCV感染相關疾病的研究多集中于第282位上的半胱氨酸突變成酪氨酸(C282Y)及第63位上的組氨酸突變成天冬氨酸(H63D)兩個位點。研究發現,H63D位點突變會加重丙型肝炎病情[18],而H63D位點突變對丙型肝炎進展無顯著影響,可能與H63D對鐵吸收的調控作用有關[19]。考慮到漢族人群H63D和C282Y兩個位點頻率較低,故本研究未納入這兩個位點。此外,本研究還存在一些不足之處,如研究對象均來自醫院,可能存在選擇偏倚;運用SNPs位點篩選原則,無法排除丙型肝炎病程進展與HFE基因其它SNPs的關聯;環境因素與丙型肝炎病程進展密切相關,而環境因素是否會影響易感性基因位點生物學效應的發揮尚不明確[20];未涉及HFE多態性位點功能學研究,無法詳細闡述HFE基因多態性位點與丙型肝炎病程進展的關系。因此,今后仍需深入研究這些問題。
綜上所述,血清鐵蛋白水平和HFE基因多態性與丙型肝炎病情活動具有明顯的相關性,臨床上應引起足夠的重視。

