感染赤星病煙草葉際細菌的多樣性分析
劉 暢,汪漢成,謝紅煉,向立剛,黃 宇,陳乾麗,余知和,鄒光進
1. 長江大學生命科學學院,湖北省荊州市荊州區荊秘路88 號 434025
2. 貴州省煙草科學研究院,貴陽市觀山湖區龍灘壩路29 號 550081
3. 長江大學農學院,湖北省荊州市荊州區荊秘路88 號 434025
4. 貴州大學農學院,貴陽市花溪區花溪大道南段2708 號 550081
5. 貴州煙草公司黔東南州公司,貴州省黔東南苗族侗族自治州凱里市韶山南路31 號 556000
在煙草生長過程中易被多種植物病原菌侵染,進而造成煙草田間病害的發生[1]。據統計,未使用藥劑防治時煙草因各種葉部病害可引起較大的經濟損失[2]。近年來,貴州省部分煙區煙草赤星病頻發,且造成的損失較大[3]。赤星病菌是引起煙草生長發育中后期病害的主要病原菌,病原菌侵入所導致的葉際微生物種群結構變化通常會造成相關病害的發生,赤星病菌侵染后,是否有其他附生微生物參與危害目前尚不清楚。但煙草葉部病害的發生與葉際微生物群落結構及其生態環境密切相關。高爽等[4]綜述了葉際微生物群落的組成、特點及其與外界環境交互作用,發現已報道的葉際微生物群落組成均存在一定規律,表明微生物群落并不是隨機組成[5-9]。Finkel 等[8]采集了以色列及美國不同地區的樹葉樣品進行相關微生物群落結構組成分析,發現地理位置決定了排鹽荒漠樹系統球體微生物群落的種群結構,不同種類葉際微生物群落的Tamarix 屬高度相似,而生長在不同氣候區的同一物種的樹木存在不同的微生物群落。其中,細菌是葉際微生物中數量最多的一種[10]。隨著高通量測序技術的發展,基于擴增子測序的分析技術被用于葉際微生物多樣性的研究[11]。Lindow 等[12]研究發現,葉際微生物有引發植物病害的作用;孫泓等[13]研究了不同生境中桂花和夾竹桃葉際細菌的群落結構,提出植物種類、生態環境及二者的交互作用均能顯著影響葉際細菌群落結構。在煙草上,徐慧等[14]采用傳統分離鑒定方法測定了健康煙葉上的細菌分布,發現不同產地煙草葉片上細菌種類不同,分離得到19 個屬共129 株細菌。該試驗結果有助于了解煙葉葉際及內生菌組成。但傳統分離鑒定方法存在一定局限性,無法對不可培養微生物進行檢測[15],也無法測定其在群落中的相對含量。同時是否有葉際附生細菌參與了赤星病的侵染與危害,目前尚不清楚。為此,采用IonS5XL 高通量測序技術分析了感染赤星病煙草葉際附生細菌群落結構與多樣性,旨在明確與赤星病發生相關的煙草葉際細菌種群結構,為煙草赤星病的有效防治提供依據。
1 材料與方法
1.1 試驗基本情況及樣品采集
黔東南州煙區(26°36’N,107°59’E)屬中亞熱帶季風濕潤氣候區,具有冬無嚴寒,夏無酷暑,雨熱同季的特點。年平均氣溫14~18 ℃。境內年日照時數為1 068~1 296 h,無霜期270~330 d,降雨量1 000~1 500 mm,相對濕度為78%~84%。供試品種云煙87,種子消毒后采用漂浮育苗,煙苗長至8 片真葉期時移栽,按當地優質煙葉生產技術規范進行田間管理。2018 年8 月29 日,在貴州省煙草赤星病爆發嚴重的煙田進行樣品采集。田間隨機選取3 株感赤星病嚴重的煙株,剪刀經酒精消毒后分別剪取每煙株發病葉片樣品,置于無菌取樣袋中并分別編號。將樣品放入低溫保藏箱,并迅速帶回實驗室,置于-80 ℃的冰箱中保存、備用。
1.2 試劑與儀器
試劑盒及測序系統:GeneJET 膠回收試劑盒和Ion Plus Fragment Library Kit 48 rxns 建庫試劑盒(美國Thermofisher 公司)。IonS5XL 測序系統由北京諾禾致源科技股份有限公司提供。
1.3 方法
1.3.1 樣品DNA 提取、擴增及純化
采用CTAB 法對樣品基因組DNA 進行提取,取5 μL 提取物于離心管中,用無菌水稀釋至1 ng/μL,檢測樣品DNA 的純度和濃度。
樣品16S 區的PCR 擴增以稀釋后的樣品基因組DNA 為 模 板,采 用 引 物515F(5’-GTGYCAG CMGCCGCGGTAA-3’)和806R(5’-GGACTACH VGGGTWTCTAAT-3’)進行擴增。PCR 擴增體系為30 μL:2×Phusion High-Fidelity PCR Master Mix with GC Buffer 15 μL,引物(2 μM)3 μL,gDNA(1 ng/μL)2 μL,用滅菌的ddH2O 補至30 μL。產物純化后回收目標條帶。使用GeneJET 膠回收試劑盒回收產物。
1.3.2 16S 文庫構建及高通量測序
使用Ion Plus Fragment Library Kit 48 rxns 建庫試劑盒構建文庫,采用Qubit 定量。文庫檢測合格后,使用IonS5XL 測序系統進行上機測序。以上步驟均由北京諾禾致源科技股份有限公司完成。
1.3.3 數據分析
將IonS5XL 下機數據導出fastq 文件,根據barcode 序列區分各個樣品的數據,barcode 允許的錯配數為0,最大引物錯配數為2。采用Cutadapt(V1.9.1, http://cutadapt.readthedocs.io/en/stable/)[16]對數據進行剪切拆分等相關質控,Reads 序列通過https://github.com/torognes/vsearch/[17]與物種注釋數據庫進行比對,去除嵌合體序列[18],得到最終的有效數據(Clean Reads)。
利用Uparse 軟件(Uparse v7.0.1001,http://www.drive5.com/uparse/)[19]對 全 部Clean Reads 進 行 聚類,默認以97%的一致性(Identity)將序列聚類成為可操作分類單元OTUs(Operational Taxonomic Units),并進行物種注釋。使用Mothur 方法與SILVA132(http://www.arb-silva.de/)[20]的SSUrRNA數據庫[21](設定閾值為0.8~1)獲得相關分類學信息,并分別在各個分類水平上統計群落組成。快速 多 序列 比 對 使 用MUSCLE[22](Version 3.8.31,http://www.drive5.com/muscle/)軟件進行,以得到所有OTUs 序列的系統發生關系。然后以樣品中數據量最少的為標準,對各樣品的數據進行均一化處理。使用Qiime 軟件(Version 1.9.1)計算各Alpha 多樣性指數,使用R 軟件(Version 2.15.3)繪制稀釋曲線。并以分析為基礎進行基于OTUs、物種組成的聚類分析和統計比較,挖掘樣品之間的物種組成差異。
2 結果與分析
2.1 16S 序列測序深度分析及數據質控
圖1 稀釋曲線(Rarefaction curve)展示了不同樣品間多樣性的差異。本次測序3 個樣品的稀釋曲線在測序深度為30 000 時趨于平緩,表明此時增加測序數據無法再找到更多的OTU。因此,可以認為測序數據量足以反映樣品中的物種多樣性,測序深度已經覆蓋到樣品中的所有物種。
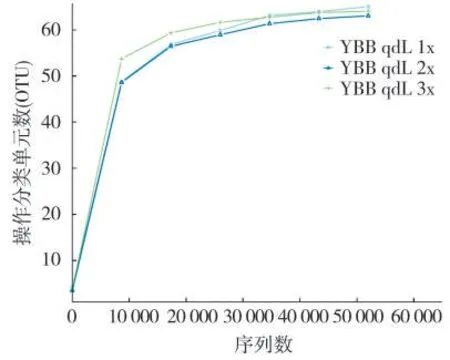
圖1 稀釋曲線(OTU 水平)Fig.1 Rarefaction curve(OTU level)
共獲得3 個感赤星病煙草葉際樣品,分別為YBBqdL1x、YBBqdL2x、YBBqdL3x。原始序列經優化處理后,3 個樣品共得到24 0176 條高質量序列片段,97 919 144 個堿基,單一樣品序列數在80 047~80 074 條之間,序列平均長度為407 bp,共檢測到78 個OTUs。
2.2 OTU 聚類分析
在97%的相似度水平下對樣品序列進行OTU聚類,3 個葉片樣品共鑒定出細菌的5 個門,8 個綱,17 個目,22 個科,25 個屬,18 個種,66 個OTU,見表1。
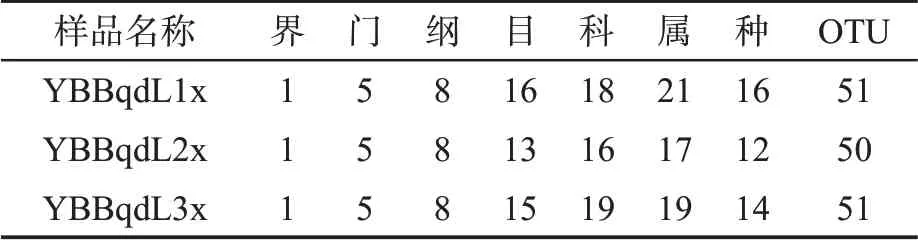
表1 感染赤星病煙草葉際細菌群落不同分類水平的總量Tab.1 Total amount of bacterial communities in different tobacco plants infected by brown spot disease at different taxonomic levels (個)
Venn 圖分析結果(圖2)表明,在OTU 水平下,3 個樣品之間細菌種類較為接近,共有的OTU 種類為37 個,遠高于各樣品中獨有的種類。
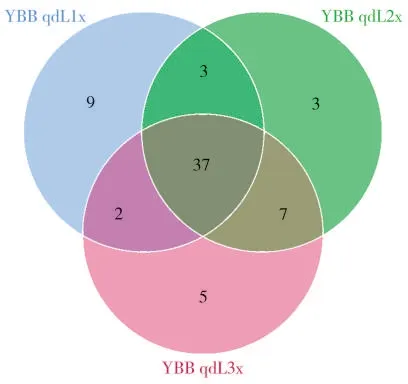
圖2 感染赤星病煙草葉際細菌群落Venn 圖Fig.2 Venn diagram illustrating the numbers of unique and shared OTUs of bacterial community of brown spot disease
2.3 微生物多樣性指數分析
基于OTU 水平的Alpha 多樣性指數(表2)表明,YBBqdL1x 與YBBqdL3x 樣品檢測到的細菌OTU 數量略高于YBBqdL2x,但無顯著差異。3 個樣品的覆蓋度指數(Coverage index)均到達了0.999 以上,表明測序結果合理。豐富度指數(Richness index)Chao1、Ace 均為YBBqdL1x 樣品細菌群落豐富度高于YBBqdL2x 與YBBqdL3x。多 樣 性 指 數(Diversity index)Shannon 指 數 及Simpson 指數中,均為YBBqdL3x 樣品多樣性高于YBBqdL1x 與YBBqdL2x;PD_whole_tree 指 數 中,YBBqdL1x 樣品高于YBBqdL2x 與YBBqdL3x。
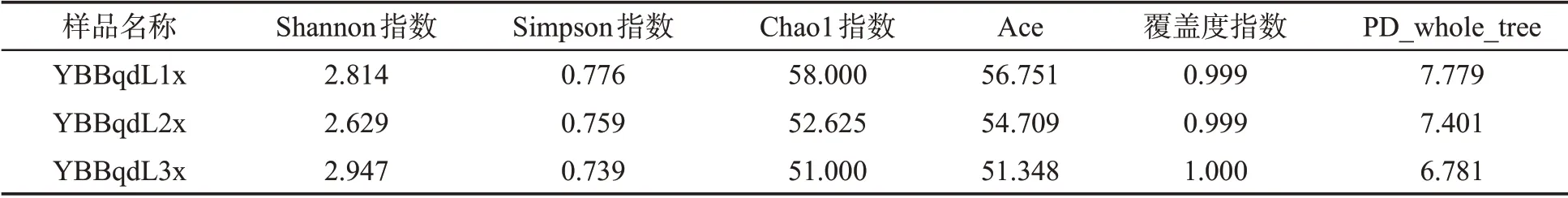
表2 感染赤星病煙草葉際細菌群落Alpha 多樣性指數分析(OTU 水平)Tab.2 Alpha diversity index of phyllosphere bacterial community in tobacco leaves infected by brown spot disease(OTU level)
2.4 細菌群落組成與結構分析
在門水平上,YBBqdL1x 的群落主要組成為變形菌門Proteobacteria(85.35%)、厚壁菌門Firmicutes(1.06%)、放線菌門Actinobacteria(0.30%);YBBqdL2x的群落主要組成為變形菌門Proteobacteria(79.45%)、厚壁菌門Firmicutes(0.65%)、放線菌門Actinobacteria(0.02%);YBBqdL3x 的群落主要組成為變形菌門Proteobacteria(49.97%)、厚壁菌門Firmicutes(0.72%)、放線菌門Actinobacteria(0.47%),見圖3。
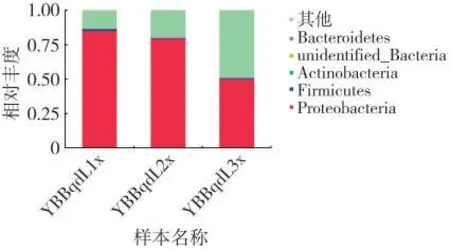
圖3 不同樣品細菌群落門水平的相對豐度Fig.3 Relative abundances of bacterial community phyla in different samples
在屬水平上,YBBqdL1x 的群落主要組成為泛菌屬Pantoea(40.88%)、假單胞菌屬Pseudomonas(25.54%)、鞘氨醇單胞菌屬Sphingomonas(8.58%)、甲醇桿菌屬Methylobacterium(7.65%)、Aureimonas(1.58%)、Falsirhodobacter(0.05%)、細 桿 菌 屬Microbacterium(0.03%)、乳 酸 菌 屬 Lactobacillus(0.12%)、Fusicatenibacter(0.21%)、Blautia(0.19%)、雙歧 桿 菌 屬Bifidobacterium(0.15%)、糞 桿 菌 屬Faecalibacterium(0.15%)、四折疊球菌屬Quadrisphaera(0.12%)、毛螺旋菌屬Anaerostipes(0.09%)、Romboutsia(0.03%);YBBqdL2x的群落主要組成為泛菌屬Pantoea(40.15%)、假單胞菌屬Pseudomonas(33.59%)、鞘氨醇單胞菌屬Sphingomonas(1.36%)、甲醇桿菌屬 Methylobacterium(1.24%)、Falsirhodobacter(0.47%)、Aureimonas(0.13%)、細桿菌屬Microbacterium(0.02%)、乳 酸 菌 屬 Lactobacillus(0.23%)、糞 桿 菌 屬Faecalibacterium(0.02%)、腸 球 菌 屬Enterococcus(0.02%)、Candidatus_Saccharimonas(0.03%)、螺桿菌屬Helicobacter(0.03%);YBBqdL3x 的群落主要組成為 泛 菌 屬 Pantoea(12.66%)、甲 醇 桿 菌 屬Methylobacterium(9.63%)、假單胞菌屬Pseudomonas(8.20%)、鞘氨醇單胞菌屬Sphingomonas(8.14%)、Aureimonas(4.55%)、Falsirhodobacter(3.55%)、細桿菌屬Microbacterium(0.35%)、Novosphingobium(0.31%)、乳 酸 菌 屬Lactobacillus(0.23%)、纖 維桿 菌 屬Cellulomonas(0.12%)、腸球菌屬Enterococcus(0.11%)、黃單胞桿菌屬Xanthomonas(0.07%)、Roseomonas(0.05%)、螺桿菌屬Helicobacter(0.02%),見圖4。
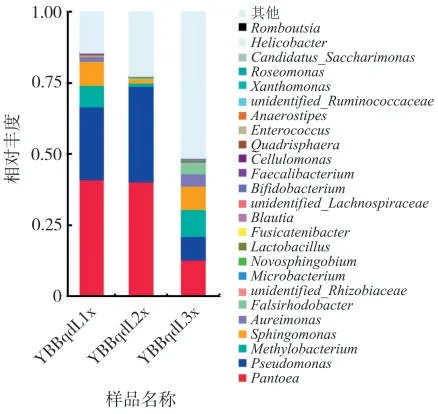
圖4 不同樣品細菌群落屬水平的相對豐度Fig.4 Relative abundances of bacterial community genera in different samples
屬水平的相對豐度熱圖通過顏色的變化直觀顯示了各樣品在屬水平相對豐度位列前30 的群落分布情況,見圖5。
使用UPGMA(Unweighted Pair Group Method with Arithmetic mean)算術平均非加權配對群聚類方法,輸入Bray Curtis 距離矩陣,將各樣品在門水平上的物種相對豐度進行聚類,結果見圖6。通過顏色變化直觀顯示出不同樣品在門水平上相對豐度位列前10 的分布情況,熱圖左側的UPGMA 聚類樹表明:3 個樣品細菌群落結構存在差異,因而聚集為兩大類。其中YBBqdL2 和YBBqdL3 樣品群落結構較相似可聚集為一類,YBBqdL1 樣品聚為一類,但3 個樣品總體差異不大。
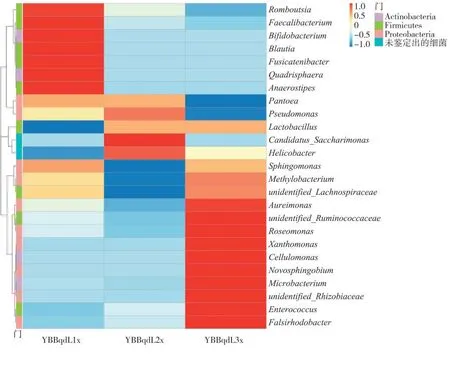
圖5 不同樣品細菌群落屬水平的相對豐度熱圖Fig.5 Heat map of relative abundances of bacterial community genera in different samples
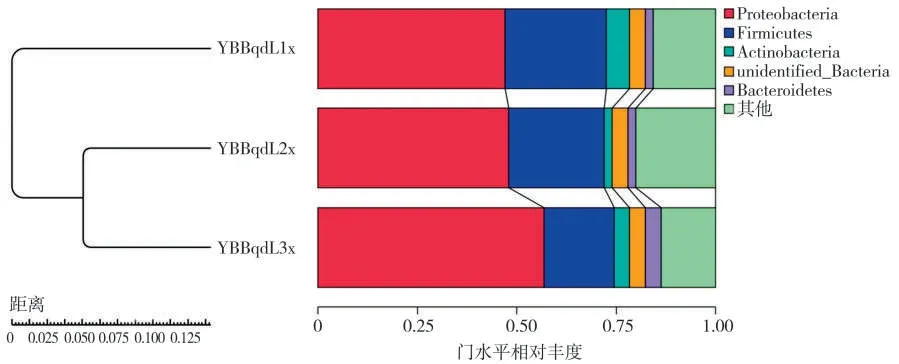
圖6 基于Unweighted Unifrac 距離的非加權組平均法聚類分析Fig.6 UPGMA clustering tree based on Unweighted Unifrac distance
3 討論
感染赤星病煙草葉片3 個樣品擴增的16S rRNA 基因的V3~V4 區域的長度均為407 bp,與實際V3~V4 區域的長度基本吻合,結果證實了IonS5XL 高通量測序技術研究感赤星病煙葉葉際細菌群落結構的可行性。
與建立在純種分離和純培養技術基礎之上的傳統研究方法相比,在對葉際微生物總群落結構分析上,高通量測序技術可鑒定出部分不可培養菌種以及更多種類可培養細菌。IonS5XL 系統采用半導體測序技術,與其他基于光學原理的測序儀不同,無需使用復雜的光學元件或帶標記的核苷酸,在保證質量的同時可達到較高的測序速度。
葉際微生物和宿主植物、葉際微生物之間都會發生復雜的交互作用[23],微生物和宿主之間包括寄生、共生和互利共生的關系。本試驗中對細菌群落結構分析發現,泛菌屬Pantoea(31.23%)、假單胞菌屬Pseudomonas(22.44%)、甲醇桿菌屬Methylobacterium(6.17%)、鞘 氨 醇 單 胞 菌 屬Sphingomonas (6.02%)、 Aureimonas (2.08%)、Falsirhodobacter(1.35%)為感赤星病煙葉葉際中優勢菌屬(組成所占比例1%以上),此結果與徐慧等[14]測定的煙草葉際細菌多樣性結果基本一致,多數葉際定殖的細菌推測可能與煙葉多為共生關系。群落組成占比最高的泛菌屬Pantoea 與煙草赤星病病原菌Alternaria alternata 之間是否存在一定的關系還有待進一步深入研究。在煙草赤星病病原菌侵染煙草過程中,其在葉際微生物環境中占主導地位,葉際細菌群落結構尚未發生明顯的變化,推測煙草赤星病菌與大部分葉際細菌可共生,同時可導致環境中腐生菌在煙草葉際的富集。煙葉生產上煙草赤星病防治多為使用化學殺菌劑,已有學者進行了大量相關研究[24],而從增加生防細菌含量方面來有效防治煙草赤星病有待于進一步試驗。
對感赤星病煙草葉際微生物進行測序分析,有利于揭示煙草赤星病葉際細菌群落結構及多樣性。通過群落組成分析,各細菌群落在煙草赤星病發生中后期葉際間的作用以及各細菌群落間的關系則需要進一步深入研究。另外本試驗中測序樣品數量有限,且僅局限于貴州省黔東南州煙區,因此樣品數量還有待增加,采樣范圍有待擴大,同時還應增加不同感病程度的樣品,以分析在煙草赤星病發生過程中細菌群落結構的變化規律性。
4 結論
感染赤星病煙草葉際細菌群落優勢菌屬為泛菌屬Pantoea(31.23%)、假單胞菌屬Pseudomonas(22.44%)、甲醇桿菌屬Methylobacterium(6.17%)、鞘氨醇單胞菌屬Sphingomonas(6.02%)、Aureimonas(2.08%)和Falsirhodobacter(1.35%)。煙草赤星病菌可與大部分葉際細菌共生,同時煙草赤星病的發生或可導致環境中腐生菌在煙草葉際的富集。煙草赤星病病原菌鏈格孢菌的侵染沒有明顯改變葉際細菌群落結構。

