Peficitinib治療類風濕關節炎療效和安全性的系統評價
劉鑫 徐昌靜 鐘小燕 趙丹潔 余彬 黃毅嵐
摘 要 目的:系統評價JAK抑制劑Peficitinib治療類風濕關節炎(RA)的療效和安全性,以為臨床治療RA提供循證參考。方法:計算機檢索PubMed、Embase、The Cochrane Library、中國期刊全文數據庫、維普網和萬方數據庫,檢索時限均為建庫起至2019年9月,收集Peficitinib(試驗組)對比安慰劑 (對照組)治療RA的療效和安全性的隨機對照試驗(RCT),對符合納入標準的臨床研究進行資料提取后,采用Cochrane系統評價員手冊5.1.0提供的偏倚風險評估工具進行質量評價,采用Stata 16統計軟件對療效[達到美國風濕病學會20%緩解標準的患者比例(ACR20)、ACR50和ACR70,以紅細胞沉降率計算的28個關節疾病活動指數<2.6的患者比例(DAS28-ESR<2.6),以C反應蛋白計算的28個關節疾病活動指數<2.6的患者比例(DAS28-CRP<2.6)等]和安全性(總不良反應發生率)進行Meta分析。結果:共納入5項RCT,合計1 773例患者。Meta分析結果顯示,試驗組患者ACR20{總體[RR=1.85,95%CI(1.45,2.36),P<0.001]、50 mg[RR=1.51,95%CI(1.04,2.20),P=0.030]、100 mg[RR=2.01,95%CI(1.29,3.13),P=0.002]、150 mg[RR=2.39,95%CI(1.58,3.61),P<0.001]}、ACR50{總體[RR=2.38,95%CI(1.65,3.42),P<0.001]、100 mg[RR=2.87,95%CI(1.61,5.11),P<0.001]、150 mg[RR=3.52,95%CI(1.78,6.96),P<0.001]}、ACR70{總體[RR=2.51,95%CI(1.52,4.14),P<0.001]、100 mg[RR=3.50,95%CI(1.62,7.58),P=0.001]、150 mg[RR=4.59,95%CI(1.47,14.30),P=0.009]}、DAS28-ESR<2.6{總體[RR=4.83,95%CI(3.20,7.28),P<0.001]、100 mg[RR=5.37,95%CI(2.68,10.77),P<0.001]、150 mg[RR=7.44,95%CI(3.78,14.65),P<0.001]}、DAS28-CRP<2.6{總體[RR=3.41,95%CI(2.65,4.39),P<0.001]、100 mg[RR=4.00,95%CI(2.67,5.99),P<0.001]、150 mg[RR=4.45,95%CI(2.99,6.63),P<0.001]}均顯著高于對照組,差異均有統計學意義。安全性方面,兩組患者總不良反應發生率比較,差異均無統計學意義[RR=1.05,95%CI(0.94,1.16),P=0.395]。結論:Peficitinib 100 mg或150 mg,每日1次用于治療RA,在改善ACR20、ACR50和ACR70、DAS28-ESR<2.6、DAS28-CRP<2.6方面優于安慰劑,不良反應輕微可耐受,可能會成為治療RA的新選擇。
關鍵詞 Peficitinib;類風濕關節炎;JAK抑制劑;Meta分析
ABSTRACT? ?OBJECTIVE: To systematically evaluate the efficacy and safety of peficitinib for treating rheumatoid arthritis (RA), and to provide evidence-based reference for the clinical treatment of RA. METHODS: Retrieved from PubMed, Embase, The Cochrane Library, CJFD, VIP and Wanfang database during from their establishment to September 2019, randomized controlled trials (RCTs) about the efficacy and safety of Peficitinib (trial group) versus placebo (control group) in the treatment of RA were collected. The risk of bias assessment tool provided in Cochrane System Evaluator Manual 5.1.0 was used to evaluate the quality after data extracted from clinical studies which met the inclusion criteria. Meta-analysis of the efficacy [the proportion of patients who met the American College of Rheumatology 20% improvement criteria (ACR20), ACR50, ACR70, the proportion of the patients with 28 joint disease activity index<2.6 calculated by erythrocyte sedimentation rate (DAS28-ESR<2.6), the proportion of patients with 28 joint disease activity index<2.6 calculated by C-reactive protein (DAS28-CRP<2.6), etc.] and safety (incidence of total ADR) was performed by using Stata 16 statistical software. RESULTS: Totally 5 RCTs were included, involving 1 773 patients. Meta-analysis results showed that ACR20 {total [RR=1.85,95%CI(1.45,2.36),P<0.001], 50 mg[RR=1.51,95%CI(1.04,2.20),P=0.030], 100 mg[RR=2.01,95%CI(1.29,3.13),P=0.002], 150 mg[RR=2.39,95%CI(1.58,3.61),P<0.001]}, ACR50{total [RR=2.38,95%CI(1.65,3.42),P<0.001], 100 mg[RR=2.87,95%CI(1.61,5.11),P<0.001],150 mg[RR=3.52,95%CI(1.78,6.96),P<0.001]}, ACR70{total [RR=2.51,95%CI(1.52,4.14),P<0.001], 100 mg[RR=3.50,95%CI(1.62,7.58),P=0.001], 150 mg[RR=4.59,95%CI(1.47,14.30),P=0.009]}, DAS28-ESR<2.6{total [RR=4.83,95%CI(3.20,7.28),P<0.001],100 mg[RR=5.37,95%CI(2.68,10.77),P<0.001], 150 mg[RR=7.44,95%CI(3.78,14.65),P<0.001]} and DAS28-CRP<2.6{total [RR=3.41,95%CI(2.65,4.39),P<0.001], 100 mg[RR=4.00,95%CI(2.67,5.99),P<0.001], 150 mg[RR=4.45,95%CI(2.99,6.63),P<0.001]} in trial group were significantly higher than control group, with statistical significance. In term of safety, there was no statistical significance in the incidence of total ADR [RR=1.05,95%CI(0.94,1.16),P=0.395] between 2 groups. CONCLUSIONS: For the treatment of RA, 100 mg or 150 mg peficitinib once per day is superior to placebo in terms of ACR20, ACR50 and ACR70, DAS28-ESR<2.6, DAS28-CRP<2.6;? the adverse events are mild and tolerable and it may be a new treatment option for RA.
KEYWORDS? ?Peficitinib; Rheumatoid arthritis; JAK inhibitor; Meta-analysis
類風濕關節炎(Rheumatoid arthritis,RA)是一種以持續性滑膜炎、進行性關節損傷、畸形甚至殘疾為主要臨床表現的慢性自身免疫性疾病,可發生于任何年齡階段,影響著全世界大約1%的人口,在我國的發病率為0.42%,且女性發病率顯著高于男性[1-3]。臨床上對于RA的治療,均明確推薦首選傳統類改善病情抗風濕藥物(DMARDs)甲氨蝶呤;對于單藥治療后仍然是中/高疾病活動度的患者,推薦給予DMARDs或生物類DMARDs聯合使用[4-5]。但由于甲氨蝶呤、生物制劑等不能對所有患者產生廣泛且持久的療效,因此臨床上迫切需要尋找新的RA治療方案。近年來,JAK家族的非受體蛋白酪氨酸激酶被認為是RA治療的新靶點,JAK抑制劑口服小分子靶向藥物成為了治療RA的新選擇,截至2019年8月,Tofacitinib、Baricitinib和Upadacitinib被美國食品藥品監督管理局(FDA)批準用于RA的治療,Peficitinib(研究代碼:ASP015K、JNJ-54781532)被日本醫藥品醫療器械綜合機構(PMDA)批準在日本上市[6]。目前Peficitinib正在國內進行臨床試驗,但筆者尚未見較全面的系統評價。因此,本研究采用系統評價的方法,對Peficitinib治療RA的療效和安全性進行評價,以期為其在國內上市及臨床治療提供循證證據。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 Peficitinib治療RA的隨機對照試驗(RCT),語種限定為中文和英文。
1.1.2 研究對象 根據1987年美國風濕病學會(ACR)修訂標準或者2010年ACR/歐洲抗風濕病聯盟(EULAR)標準診斷為RA的患者,年齡≥18歲,種族不限,性別不限。
1.1.3 干預措施 試驗組:Peficitinib(不限劑量);對照組:安慰劑或陽性藥物。兩組患者均可給予其他干預措施。
1.1.4 結局指標 ①第12周達到ACR 20%緩解標準的患者比例(ACR20);②第12周達到ACR 50%緩解標準的患者比例(ACR50);③第12周達到ACR 70%緩解標準的患者比例(ACR70);④以紅細胞沉降率計算的28個關節疾病活動指數<2.6的患者比例(DAS28-ESR<2.6);⑤以C反應蛋白計算的28個關節疾病活動指數<2.6的患者比例(DAS28-CRP<2.6);⑥總不良反應發生率;⑦嚴重不良反應發生率。其中,①為主要結局指標,②~⑦為次要結局指標。
1.1.5 排除標準 其他炎性風濕性關節炎疾病;有結核感染病史(活動性或潛伏性);最近接受過活疫苗或減毒疫苗治療;需要抗菌治療的活動性感染或由于免疫系統受損而發展為感染的高風險患者;乙肝、丙肝或人類免疫缺陷病毒檢測呈陽性者;惡性腫瘤患者;僅進行安全性研究的文獻。
1.2 檢索策略
計算機檢索PubMed、Embase、The Cochrane Library、中國期刊全文數據庫、維普網和萬方數據庫,檢索時限均為自建庫起至2019年9月,中英文檢索詞包括“Peficitinib”“ASP015K”“JNJ-54781532”“類風濕關節炎”“Rheumatoid arthritis”。中文檢索式為(Peficitinib OR ASP015K OR JNJ-54781532)AND(類風濕關節炎),英文檢索式為(Peficitinib OR ASP015K OR JNJ-54781532)AND(Rheumatoid arthritis)。檢索采取主題詞和自由詞相結合的方式。
1.3 資料提取和質量評價
由兩名研究者根據納入和排除標準,獨立閱讀文獻題目和摘要進行初篩,對可能符合標準的文獻閱讀全文確定是否納入,如遇分歧則通過討論或由第3名研究者裁決。提取數據包括:研究的基本特征、患者的基線情況、干預措施、背景治療、療程、結局指標等。采用Cochrane系統評價員手冊5.1.0提供的偏倚風險評估工具,對納入的文獻從以下幾個方面進行質量評價:隨機方法、分配隱藏、對受試者和干預提供者施盲、結果數據完整、選擇性結果報告、其他偏倚來源。采用修改后的Jadad量表對文獻質量進行評分,其中隨機序列生成、分配隱藏和雙盲分別占2分,退出/失訪占1分,總分為1~7分,低于4分提示文獻質量較低。
1.4 統計學方法
采用Stata 16軟件進行統計學分析。連續性變量采用加權均數差(WMD)作為效應量,二分類變量采用相對危險度(RR)作為效應量,區間估計均采用95%置信區間(95%CI)表示。采用χ2檢驗對納入研究進行異質性檢驗,檢驗水準α=0.1,并結合I 2進行判斷:若各研究間無統計學異質性(P>0.1,I 2≤50%),則采用固定效應模型;反之,則認為各研究間存在統計學異質性。通過亞組分析及敏感性分析異質性來源,若仍無法確定異質性來源,則采用隨機效應模型。采用Egger檢驗進行發表偏倚風險分析。
2 結果
2.1 納入研究基本信息
檢索初得文獻98篇,首先用EndNote軟件去除重復文獻,然后進一步閱讀文獻進行篩選,最終納入符合標準的文獻5篇[7-11],共計1 773例患者,發表語種均是英文。文獻篩選流程及結果詳見圖1,納入研究的基本特征詳見表1。
2.2 納入研究的質量評價
本研究納入的5項RCT均為隨機、雙盲的臨床試驗,2項研究[10-11]描述了隨機序列生成的具體方案,1項研究[10]描述了分配隱藏的具體方案,5項研究[7-11]均報道了退出或失訪,Jadad評分均在5分以上,總體研究質量較高。納入研究的質量評價結果詳見表2。
2.3 Meta分析結果
2.3.1 ACR20 5項研究[7-11](1 773例患者)均報道了ACR20。各研究間有統計學異質性(P<0.001,I 2=80.0%),采用隨機效應模型合并效應量進行分析。結果顯示,試驗組的ACR20顯著高于對照組,差異有統計學意義[RR=1.85,95%CI(1.45,2.36),P<0.001]。按照試驗組給藥劑量進行亞組分析,結果顯示,25 mg劑量組[RR=1.07,95%CI(0.66,1.73),P=0.786]的ACR20高于對照組,但差異無統計學意義;50 mg劑量組[RR=1.51,95%CI(1.04,2.20),P=0.030]、100 mg劑量組[RR=2.01,95%CI(1.29,3.13),P=0.002]、150 mg劑量組[RR=2.39,95%CI(1.58,3.61),P<0.001]的ACR20均顯著高于對照組,差異均有統計學意義。ACR20的Meta分析森林圖詳見圖2。
2.3.2 ACR50 5項研究[7-11](1 773例患者)均報道了
ACR50。各研究間有統計學異質性(P<0.001,I 2=74.2%),采用隨機效應模型合并效應量進行分析。結果顯示,試驗組的ACR50顯著高于對照組,差異有統計學意義[RR=2.38,95%CI(1.65,3.42),P<0.001]。按照試驗組給藥劑量進行亞組分析,結果顯示,25 mg劑量組[RR=0.92,95%CI(0.55,1.56),P=0.769]的ACR50低于對照組,但差異無統計學意義;50 mg劑量組[RR=1.48,95%CI(0.97,2.25),P=0.067]的ACR50高于對照組,但差異無統計學意義;100 mg劑量組[RR=2.87,95%CI(1.61,5.11),P<0.001]、150 mg劑量組[RR=3.52,95%CI(1.78,6.96),P<0.001]的ACR50均顯著高于對照組,差異均有統計學意義。ACR50的Meta分析森林圖詳見圖3。
2.3.3 ACR70 5項研究[7-11](1 773例患者)均報道了ACR70。各研究間有統計學異質性(P=0.001,I 2=60.1%),采用隨機效應模型合并效應量進行分析。結果顯示,試驗組的ACR70顯著高于對照組,差異有統計學意義[RR=2.51,95%CI(1.52,4.14),P<0.001]。按照試驗組給藥劑量進行亞組分析,結果顯示,25 mg劑量組[RR=0.79,95%CI(0.36,1.71),P=0.547]的ACR70低于對照組,但差異無統計學意義;50 mg劑量組[RR=1.54,95%CI(0.80,2.94),P=0.196]的ACR70高于對照組,但差異無統計學意義;100 mg劑量組[RR=3.50,95%CI(1.62,7.58),P=0.001]、150 mg劑量組[RR=4.59,95%CI(1.47,14.30),P=0.009]的ACR70均顯著高于對照組,差異均有統計學意義。ACR70的Meta分析森林圖詳見圖4。
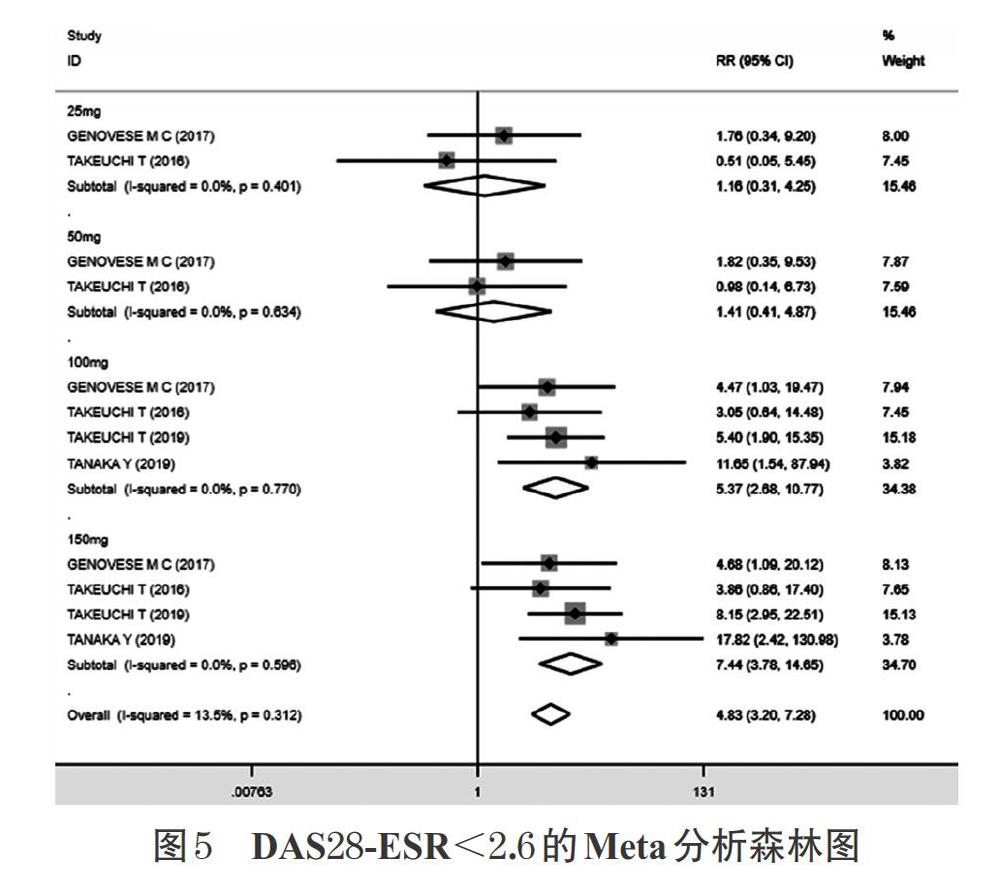
2.3.4 DAS28-ESR<2.6 4項研究[7,9-11](1 395例患者)均報道了DAS28-ESR<2.6。各研究間無統計學異質性(P=0.312,I 2=13.5%),采用固定效應模型合并效應量
進行分析。結果顯示,試驗組的DAS28-ESR<2.6顯著高于對照組,差異有統計學意義[RR=4.83,95%CI(3.20,7.28),P<0.001]。按照試驗組給藥劑量進行亞組分析,結果顯示,25 mg劑量組[RR=1.16,95%CI(0.31,4.25),P=0.827]、50 mg劑量組[RR=1.41,95%CI(0.41,4.87),P=0.588]的DAS28-ESR<2.6均高于對照組,但差異均無統計學意義;100 mg劑量組[RR=5.37,95%CI(2.68,10.77),P<0.001]、150 mg劑量組[RR=7.44,95%CI(3.78,14.65),P<0.001]的DAS28-ESR<2.6均顯著高于對照組,差異均有統計學意義。DAS28- ESR<2.6的Meta分析森林圖詳見圖5。
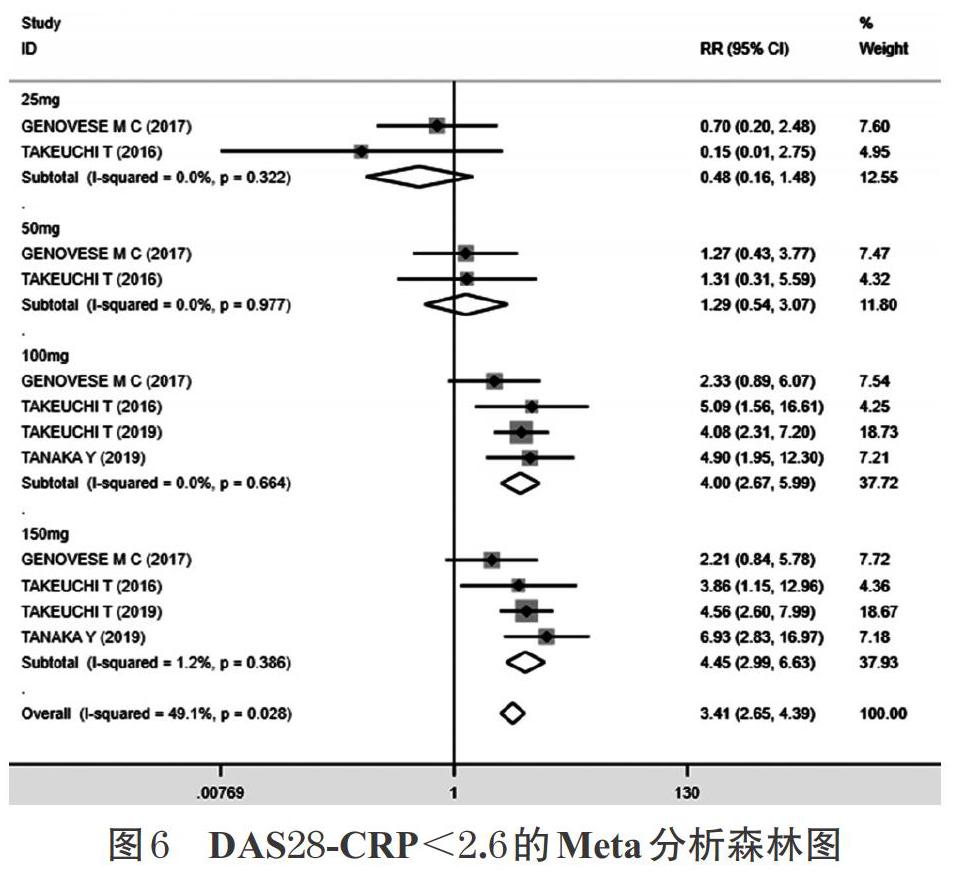
2.3.5 DAS28-CRP<2.6 4項研究[7,9-11](1 395例患者)均報道了DAS28-CRP<2.6。各研究間無統計學異質性
(P=0.028,I 2=49.1%),采用固定效應模型合并效應量進行分析。結果顯示,試驗組的DAS28-CRP<2.6顯著高于對照組,差異有統計學意義[RR=3.41,95%CI(2.65,4.39),P<0.001]。按照試驗組給藥劑量進行亞組分析,結果顯示,25 mg劑量組[RR=0.48,95%CI(0.16,1.48),P=0.203] 的DAS28-CRP<2.6低于對照組,但差異無統計學意義;50 mg劑量組[RR=1.29,95%CI(0.54,3.07),P=0.568]的DAS28-CRP<2.6高于對照組,但差異無統計學意義;100 mg劑量組[RR=4.00,95%CI(2.67,5.99),P<0.001]、150 mg劑量組[RR=4.45,95%CI(2.99,6.63),P<0.001]的DAS28-CRP<2.6均顯著高于對照組,差異均有統計學意義。DAS28- CRP<2.6的Meta分析森林圖詳見圖6。
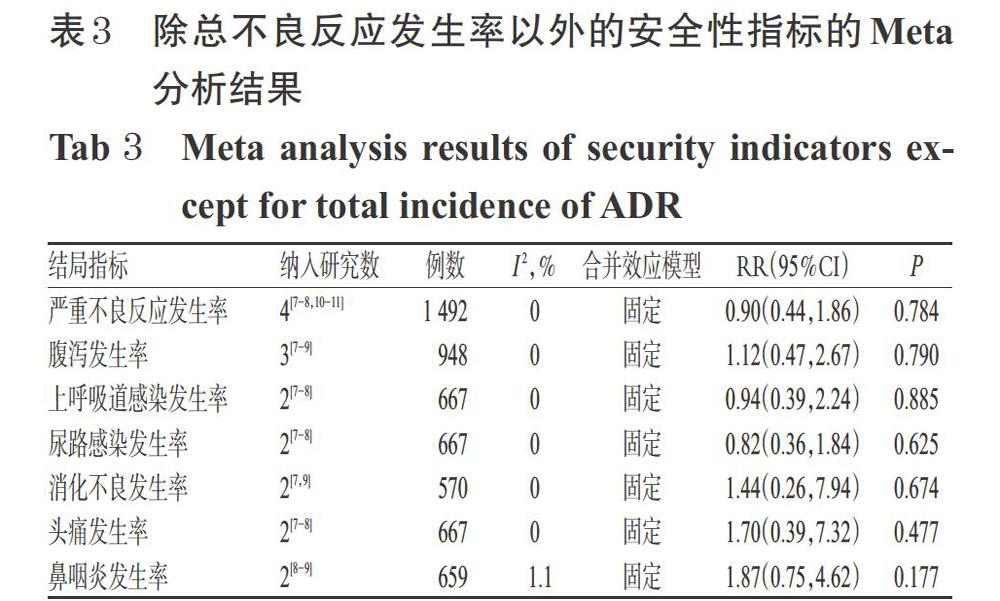
2.3.6 安全性指標 5個研究[7-11](1 773例患者)均報道了總不良反應發生率。各研究間無統計學異質性(P=0.898,I 2=0%),采用固定效應模型合并效應量進行分析。結果顯示,試驗組與對照組的總不良反應發生率差異無統計學意義[RR=1.05,95%CI(0.94,1.16),P=0.395]。試驗組其他安全性指標與對照組比較,差異無統計學意義(P>0.05),Meta分析結果詳見表3。
2.4 發表偏倚分析結果
對Peficitinib與安慰劑總不良反應發生率結局指標比較的發表偏倚風險分析結果顯示,納入的研究間不存在發表偏倚風險(P=0.109)。
3 討論
JAK是一種非受體酪氨酸激酶,包括JAK1、JAK2、JAK3和選擇性酪氨酸激酶2(TYK2)等4個成員,與信號傳導及轉錄激活因子(STAT)形成重要的信號傳導通路[12]。該通路是一條與炎癥、腫瘤相關的信號傳導通路,廣泛參與體內細胞增殖、分化、凋亡、調節免疫反應與細胞穩態等重要過程[13]。RA患者免疫紊亂與腫瘤壞死因子α(TNF-α)、白細胞介素(IL)-1、IL-6等細胞因子激活該通路有關[13]。Peficitinib是JAK1/2/3及TYK2的抑制劑,尤其對JAK3有很強的抑制作用,可通過阻斷JAK-STAT信號傳導通路,調節體內免疫反應,改善RA患者關節受損狀況[13]。
本研究對Peficitinib的療效和安全性進行了Meta分析,結果顯示,在ACR20方面,25 mg劑量組與對照組比較差異無統計學意義(P>0.05),50 mg、100 mg和150 mg劑量組與對照組比較差異有統計學意義(P<0.05);在ACR50、ACR70、DAS28-ESR<2.6和DAS28- CRP<2.6等療效指標方面,25、50 mg劑量組與對照組比較差異無統計學意義(P>0.05),100、150 mg劑量組均顯著高于對照組(P<0.05),表明該劑量對RA患者有效,因此推薦臨床使用100 mg或150 mg劑量。除此之外,在預防關節破壞方面,Takeuchi T等[10]的研究表明,與安慰劑相比,Peficitinib組患者關節間隙狹窄(JSN)和糜爛評分較基線顯著降低,該藥還具有預防結構性關節損傷的價值。
安全性方面,本研究表明Peficitinib不良反應輕微,總不良反應發生率及其他安全性指標與對照組比較差異均無統計學意義(P>0.05)。持續時間達52周的Takeuchi T等[10]和Tanaka Y等[11]的研究表明,100 mg和150 mg劑量的Peficitinib耐受性良好,從安全角度看沒有明顯的劑量依賴性,并且與其他JAK抑制劑相比,在嚴重感染、帶狀皰疹相關疾病(包括水痘)和惡性腫瘤發病率方面沒有顯著差異。一項開放標簽、單臂、非比較性、長達2年的安全性研究[14]也表明,Peficitinib 100 mg,每日1次,能夠對中、重度RA患者表現出穩定的安全性和持續的有效性。
患者依從性方面,Tofacitinib、Baricitinib、Upadacitinib、Peficitinib等具有新型作用機制的JAK抑制劑小分子靶向藥物比生物制劑的價格相對較低,且只需口服,可顯著提高患者的依從性。
本研究共納入5項RCT,均為隨機、雙盲的高質量研究,Jadad評分均不低于5分,總體研究質量較高。與之前的Meta分析[15](包括本文納入的3篇早期Ⅱ期研究[7-9],948例患者)相比,本研究更新納入多篇高質量Ⅲ期研究,新增DAS28-ESR<2.6及DAS28-CRP<2.6等療效指標,同時對可能發生的不良反應均進行了安全性分析。本研究也存在一定的局限性:(1)納入的研究數量較少,樣本量較小,隨訪持續時間較短,且Peficitinib與陽性藥物頭對頭比較的臨床試驗少,而僅納入安慰劑比較的RCT,尚需設計更多的RCT及陽性對照試驗以全面評估其療效和安全性。(2)本研究采用傳統Meta分析方法,未對25、50、100、150 mg劑量的Peficitinib的相對療效和安全性進行比較。(3)由于客觀條件的限制,本研究未對日語數據庫進行檢索,語種僅限中文和英文。(4)部分指標異質性較大,可能與不同研究納入人群的差異有關,排除Kivitz AJ等[8]的研究后可一定程度降低異質性。
綜上所述,每日口服Peficitinib 100 mg或150 mg在治療RA方面優于安慰劑,且不良反應輕微、可耐受,對于以前使用其他DMARDs治療無效的患者來說,Peficitinib可能會成為治療RA的新選擇。受納入研究方法學質量和樣本量限制,該結論有待更多設計嚴格、長期隨訪的大樣本RCT加以驗證。
參考文獻
[ 1 ] MCINNES IB,SCHETT G. Pathogenetic insights from the treatment of rheumatoid arthritis[J]. Lancet,2017,389(10086):2328-2337.
[ 2 ] SMOLEN JS,ALETAHA D,MCINNES IB. Rheumatoid arthritis[J]. Lancet,2016,388(10055):2023-2038.
[ 3 ] 曾小峰,朱松林,譚愛春,等.我國類風濕關節炎疾病負擔和生存質量研究的系統評價[J].中國循證醫學雜志,2013,13(3):300-307.
[ 4 ] 中華醫學會風濕病學分會.2018中國類風濕關節炎診療指南[J].中華內科雜志,2018,57(4):242-251.
[ 5 ] 李世琴,李亞玲,黃毅嵐,等.選擇性Janus激酶1抑制藥Upadacitinib和Filgotinib治療類風濕性關節炎療效和安全性的Meta分析[J].中國藥房,2019,30(15):2130- 2135.
[ 6 ] TANAKA Y. Recent progress and perspective in JAK inhibitors for rheumatoid arthritis:from bench to bedside[J]. J Biochem,2015,158(3):173-179.
[ 7 ] GENOVESE MC,GREENWALD M,CODDING C,et al. Peficitinib,a JAK inhibitor,in combination with limited conventional synthetic disease-modifying antirheumatic drugs in the treatment of moderate-to-severe rheumatoid arthritis[J]. Arthritis Rheumatol,2017,69(5):932-942.
[ 8 ] KIVITZ AJ,GUTIERREZ-URENA SR,POILEY J,et al. Peficitinib,a JAK inhibitor,in the treatment of moderate-to-severe rheumatoid arthritis in patients with an inadequate response to methotrexate[J]. Arthritis Rheumatol,2017,69(4):709-719.
[ 9 ] TAKEUCHI T,TANAKA Y,IWASAKI M,et al. Efficacy and safety of the oral Janus kinase inhibitor peficitinib (ASP015K) monotherapy in patients with moderate to severe rheumatoid arthritis in Japan:a 12-week,randomised,double-blind,placebo-controlled phase Ⅱb study[J]. Ann Rheum Dis,2016,75(6):1057-1064.
[10] TAKEUCHI T,TANAKA Y,TANAKA S,et al. Efficacy and safety of peficitinib (ASP015K) in patients with rheumatoid arthritis and an inadequate response to methotrexate:results of a phase Ⅲ randomised,double-blind,placebo-controlled trial (RAJ4) in Japan[J]. Ann Rheum Dis,2019,78(10):1305-1319.
[11] TANAKA Y,TAKEUCHI T,TANAKA S,et al. Efficacy and safety of peficitinib (ASP015K) in patients with rheumatoid arthritis and an inadequate response to conventional DMARDs:a randomised,double-blind,placebo-controlled phase Ⅲ trial (RAJ3)[J]. Ann Rheum Dis,2019,78(10):1320-1332.
[12] 張蓓蓓,蔡輝. Janus激酶抑制劑治療類風濕關節炎的研究進展[J].中華風濕病學雜志,2017,21(6):421-424.
[13] 紀前前,郭偉偉,張倩倩,等. JAK抑制劑在類風濕性關節炎治療中的研究進展[J].中國藥房,2016,27(5):711-713.
[14] GENOVESE MC,GREENWALD MW,GUTIERREZ- URENA SR,et al. Two-year safety and effectiveness of peficitinib in moderate-to-severe rheumatoid arthritis:a phase Ⅱb,open-label extension study[J]. Rheumatol Ther,2019,6(4):503-520.
[15] LEE YH,SONG GG. Comparative efficacy and safety of peficitinib 25,50,100,and 150 mg in patients with active rheumatoid arthritis:a Bayesian network meta-analysis of randomized controlled trials[J]. Clin Drug Investig,2020,40(1):65-72.
(收稿日期:2020-01-07 修回日期:2020-02-22)
(編輯:劉明偉)

