一鍋法合成新型異吲哚啉酮衍生物
張亞明,張燕霞,伍鵬程,柳軍璽,魏小寧
(1.中國(guó)科學(xué)院 蘭州化學(xué)物理研究所 中國(guó)科學(xué)院西北特色植物資源化學(xué)重點(diǎn)實(shí)驗(yàn)室 甘肅省天然藥物重點(diǎn)實(shí)驗(yàn)室,甘肅 蘭州 730000;2.中國(guó)科學(xué)院大學(xué),北京 100049)
異吲哚啉酮類化合物是一類含氮雜環(huán)骨架的化合物,主要分布于天然產(chǎn)物中[1],具有豐富的生物活性,包括抗高血壓[2]、抗精神病[3]、抗病毒[4]、抗癌[5]等,引起了醫(yī)藥界科研工作者的廣泛關(guān)注。
已有諸多文獻(xiàn)報(bào)道了異吲哚啉酮化合物的合成。傳統(tǒng)方法為,以鄰苯甲酰亞胺為起始原料,通過(guò)Wittig 反應(yīng)[6]、Grignard反應(yīng)[7]、Diels-Alder反應(yīng)[8]、光化學(xué)反應(yīng)[9]制備異吲哚啉酮化合物。此外,也可以通過(guò)堿催化鄰炔基衍生的苯甲酰胺分子內(nèi)關(guān)環(huán)合成異吲哚啉酮[10]。以上反應(yīng)存在反應(yīng)條件劇烈、區(qū)域選擇性差、底物不易獲得等問(wèn)題。
近年來(lái)有機(jī)金屬催化反應(yīng)合成復(fù)雜分子越來(lái)越受歡迎,出現(xiàn)了用鈀催化合成異吲哚啉酮化合物的合成反應(yīng)[11],如Kundu小組[12]利用鈀催化,將2-碘苯甲酰胺與不同的端基炔高度立體選擇性的合成(Z)-3-烯基異吲哚啉酮類化合物;Cossy小組[13]利用炔酰胺和硼酸通過(guò)鈀催化Heck-Suzuki-Miyaura多米諾反應(yīng),立體選擇性合成了(E)-3烯基異吲哚啉酮;Alper小組[14]利用鈀和銅作催化劑,經(jīng)Sonogashira偶聯(lián)后,再插羰環(huán)合合成該類化合物的核心骨架。
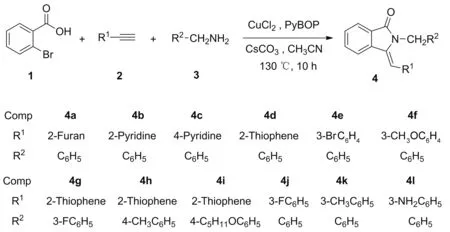
Scheme 1
以上反應(yīng)均需使用較為昂貴的鈀催化劑。用廉價(jià)、低毒的銅催化偶聯(lián)、關(guān)環(huán)反應(yīng)合成異吲哚啉酮類化合物受到研究人員的關(guān)注。如通過(guò)鹵代苯甲酰胺衍生物與炔烴反應(yīng),利用銅離子與不同的配體配位形成的催化劑作用下反應(yīng)得到異吲哚啉酮[15];利用銅催化劑,以氯化銨提供胺源,利用鄰碘苯甲酸與芳炔基羧酸合成異吲哚啉酮[16]。已有的異吲哚啉酮類化合物的合成方法,普遍存在反應(yīng)底物需要預(yù)合成、中間體需要分離純化、操作比較復(fù)雜、反應(yīng)時(shí)間長(zhǎng)等不足因素。“一鍋法”反應(yīng)由于操作簡(jiǎn)單,合成方便高效等特點(diǎn)而倍受關(guān)注[17-18]。
本文以二價(jià)銅為催化劑,鄰溴苯甲酸(1)、端炔(2)、伯胺(3)為原料,一鍋法合成了9種新型異吲哚啉酮衍生物(4a~4l,Scheme 1),總收率55%~91%,其結(jié)構(gòu)經(jīng)1H NMR,13C NMR和HR-MS(ESI)表征。并對(duì)催化機(jī)理進(jìn)行了探討。
1 實(shí)驗(yàn)部分
1.1 儀器與試劑
X-4型熔點(diǎn)儀;Bruker 400 MHz型超導(dǎo)核磁共振儀(CDCl3或Acetone-d6為溶劑,TMS為內(nèi)標(biāo));Bruker micro TOF-Q Ⅱ型高分辨四級(jí)桿飛行時(shí)間質(zhì)譜儀。
所用試劑均為化學(xué)純或分析純。
1.2 4a~4l的合成通法
氮?dú)獗Wo(hù)下,在25 mL圓底燒瓶中加入鄰溴苯甲酸類原料1(0.5 mmol)、苯乙炔衍生物2(1.5 mmol),伯胺3(1.2 mmol),CuCl2(0.1 mmol),PyBOP(1 mmol),CsCO3(3 mmol)和乙腈3 mL,攪拌下回流(130 ℃)反應(yīng)10 h(TLC檢測(cè))。冷卻至室溫,用硅藻土過(guò)濾,濃縮,殘余物經(jīng)硅膠柱層析[洗脫劑:V(石油醚)/V(乙酸乙酯)=15/1~1/1]純化后重結(jié)晶得目標(biāo)化合物4a~4l。
(Z)-3-亞芐基-2-(2-甲基呋喃)異吲哚啉-1-酮(4a):白色固體,收率82%,m.p.140~ 142 ℃;1H NMR(400 MHz,Acetone-d6)δ:8.00(d,J=7.6 Hz,1H),7.85(d,J=7.6 Hz,1H),7.72(t,J=7.6 Hz,1H),7.60(t,J=7.6 Hz,1H),7.45~7.31(m,5H),7.24(s,1H),6.97(s,1H),6.23~6.04(m,1H),5.42(d,J=3.2 Hz,1H),4.92(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.2,150.2,141.9,138.8,135.0,134.1,132.5,129.7,129.2,128.0,127.8,127.4,122.9,119.9,109.9,107.3,106.8,38.1;HR-MS(ESI)m/z:Calcd for C20H15NO2Na{[M+Na]+}324.0995,found 324.0998。
(Z)-3-亞芐基-2-(2-甲基吡啶)異吲哚啉-1-酮(4b):白色固體,收率89%,m.p.133~135 ℃;1H NMR(400 MHz,Acetone-d6)δ:8.25(d,J=4.4 Hz,1H),8.02(d,J=8.0 Hz,1H),7.87(d,J=7.6 Hz,1H),7.74(t,J=7.6 Hz,1H),7.62(t,J=7.6 Hz,1H),7.50(t,J=8.0 Hz,1H),7.27~7.16(m,3H),7.12~7.06(m,3H),6.92(s,1H),6.57(d,J=8.0 Hz,1H),4.99(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.4,156.3,148.8,138.8,136.1,134.7,134.7,132.4,129.3,129.1,128.2,127.8,127.2,122.9,121.6,120.2,120.0,107.0,46.3;HR-MS(ESI)m/z:Calcd for C21H16N2ONa{[M+Na]+}335.1155,found 335.1141.
(Z)-3-亞芐基-2-(4-甲基吡啶)異吲哚啉-1-酮(4c):白色固體,收率85%,m.p.119~121 ℃;1H NMR(400 MHz,Acetone-d6)δ:7.99(d,J=8.0 Hz,1H),7.85(d,J=8.0 Hz,1H),7.71(td,J=7.6 Hz,1.2 Hz,1H),7.59(t,J=7.2 Hz,1H),7.47~7.34(m,6H),7.16(dd,J=5.2 Hz,1.2 Hz,1H),7.00(s,1H),6.71(dd,J=5.2,3.2 Hz,1H),6.16(d,J=3.6 Hz,1H),5.13(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.2,139.6,138.9,135.0,133.8,132.5,129.9,129.2,128.2,127.6,126.1,125.4,124.9,122.9,120.0,107.5,39.6;HR-MS(ESI)m/z:Calcd for C21H17N2O{[M+H]+}313.1341,found 313.1329。
(Z)-3-亞芐基-2-(2-甲基噻吩)異吲哚啉-1-酮(4d):白色固體,收率91%,m.p.138~140 ℃;1H NMR(400 MHz,Acetone-d6)δ:8.27(d,J=6.0 Hz,2H),8.05(d,J=7.6 Hz,1H),7.89(d,J=7.6 Hz,1H),7.76(t,J=7.6 Hz,1H),7.65(t,J=7.4 Hz,1H),7.27(qd,J=8.6 Hz,7.9 Hz,3.7 Hz,2H),7.13(d,J=7.2 Hz,2H),6.99(s,1H),6.55(d,J=5.2 Hz,2H),4.95(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.1,149.3,146.3,138.6,134.5,134.0,132.6,129.6,129.4,127.9,127.7,127.4,123.1,121.1,120.1,107.6,43.8;HR-MS(ESI)m/z:Calcd for C20H15NOS{[M+H]+}340.0772,found 340.0787。
(Z)-3-亞芐基-2-(3-溴芐基)異吲哚啉-1-酮(4e):白色固體,收率87%,m.p.110~112℃;1H NMR(400 MHz,Acetone-d6)δ:8.02(d,J=7.6 Hz,1H),7.89(d,J=7.6 Hz,1H),7.74(t,J=7.6 Hz,1H),7.63(t,J=7.6 Hz,1H),7.36~7.26(m,4H),7.20~7.14(m,2H),7.05(t,J=8.0 Hz,1H),6.97(s,1H),6.57(s,2H),4.95(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.2,139.9,138.6,134.6,133.9,132.6,129.9,129.7,129.6,129.3,129.2,127.9,127.7,127.4,125.0,123.0,121.6,120.0,107.6,43.9;HR-MS(ESI)m/z:Calcd for C22H16NOBrNa{[M+Na]+}412.0307,found 412.0301。
(Z)-3-亞芐基-2-(3-甲氧基芐基)異吲哚啉-1-酮(4f):白色固體,收率87%,m.p.110~112 ℃;1H NMR(400 MHz,CDCl3)δ:7.93(d,J=7.6 Hz,1H),7.74(d,J=7.6 Hz,1H),7.62(td,J=7.6,1.2 Hz,1H),7.53(t,J=7.6 Hz,1H),7.18(t,J=8.0 Hz,1H),7.12~7.03(m,3H),6.82(dd,J=8.4,2.4 Hz,1H),6.75~6.67(m,2H),6.62~6.55(m,2H),6.48(s,1H),4.94(s,2H),3.62(s,3H).13C NMR(101 MHz,CDCl3)δ:168.98,159.69,138.42,135.12,134.49,132.14,129.65,129.10,128.74,128.03,127.01,126.67,126.31,123.54,122.12,119.46,114.38,113.82,107.32,55.07,44.93;HR-MS(ESI)m/z:Calcd for C23H19NO2{[M+H]+}341.1398,found 341.1402。
(Z)-3-(3-氟亞芐基)-2-(2-甲基噻吩)異吲哚啉-1-酮(4g):白色固體,收率78%,m.p.120~122 ℃;1H NMR(400 MHz,Acetone-d6)δ:8.01(d,J=8.0 Hz,1H),7.86(d,J=7.6 Hz,1H),7.73(t,J=7.6 Hz,1H),7.62(t,J=7.6 Hz,1H),7.47(q,J=7.6 Hz,1H),7.25~7.11(m,3H),7.08(d,J=9.6 Hz,1H),6.97(s,1H),6.79~6.71(m,1H),6.24(d,J=2.4 Hz,1H),5.13(s,2H);13C NMR(101 MHz,Acetone-d6)δ:168.1,161.2,139.6,138.7,137.3,134.5,132.6,129.9,129.4,127.8,126.2,125.9,125.1,124.8,123.0,120.0,116.2,114.1,105.9,39.7;HR-MS(ESI)m/z:Calcd for C20H14NOSFNa{[M+Na]+}358.0672,found 358.0660。
(Z)-3-(4-甲基亞芐基)-2-(2-甲基噻吩)異吲哚啉-1-酮(4h):白色固體,收率75%,m.p.115~117 ℃;1H NMR(400 MHz,Acetone-d6)δ:7.97(d,J=7.6 Hz,1H),7.83(d,J=7.6 Hz,1H),7.69(t,J=7.6 Hz,1H),7.57(t,J=7.6 Hz,1H),7.26(s,4H),7.16(d,J=4.8 Hz,1H),6.96(s,1H),6.79~6.65(m,1H),6.21(d,J=2.8 Hz,1H),5.14(s,2H),2.39(s,3H);13C NMR(101 MHz,Acetone-d6)δ:168.2,139.6,139.0,137.4,133.5,132.4,131.9,129.8,129.0,128.8,127.8,126.0,125.5,124.9,122.9,119.9,107.6,39.5,20.4;HR-MS(ESI)m/z:Calcd for C21H16N2NaO{[M+Na]+}354.0923,found 354.0928。
(Z)-3-(4-(戊氧基)亞芐基)-2-(2-甲基噻吩)異吲哚啉-1-酮(4i):白色固體,收率75%,m.p.115~125 ℃;1H NMR(400 MHz,Acetone-d6)δ:7.95(d,J=7.6 Hz,1H),7.83(d,J=7.6 Hz,1H),7.68(t,J=7.6 Hz,1H),7.56(t,J=7.6 Hz,1H),7.30(d,J=8.4 Hz,2H),7.21~7.10(m,1H),7.00(d,J=8.8 Hz,2H),6.93(s,1H),6.77~6.66(m,1H),6.27(d,J=3.2 Hz,1H),5.16(s,2H),4.05(t,J=6.4 Hz,2H),1.90~1.73(m,2H),1.55-1.33(m,4H),0.93(t,J=7.2 Hz,3H);13C NMR(101 MHz,Acetone-d6)δ:168.3,158.8,139.7,139.1,133.1,132.4,131.2,128.9,127.8,126.8,126.1,125.5,124.8,122.8,119.8,114.2,107.6,67.8,39.5,37.6,28.0,22.2,13.5;HR-MS(ESI)m/z:Calcd for C25H25NO2SNa{[M+Na]+}426.1498,found 426.1485。
(Z)-2-芐基-3-(3-氟亞芐基)異吲哚啉-1-酮(4j):白色固體,收率83%,m.p.126~128 ℃;1H NMR(400 MHz,CDCl3)δ:8.00(d,J=8.0 Hz,1H),7.89(d,J=7.6 Hz,1H),7.74(td,J=7.6 Hz,1.2 Hz,1H),7.63(t,J=7.6 Hz,1H),7.38~7.29(m,1H),7.13~7.00(m,5H),6.89(s,1H),6.80(d,J=10.0 Hz,1H),6.58(d,J=5.2 Hz,2H),4.95(s,2H);13C NMR(101 MHz,CDCl3)δ:168.3,161.0,138.5,137.3,137.0,134.8,132.6,129.7,129.5,128.1,127.9,126.7,125.9,125.8,123.0,120.1,116.3,113.9,105.9,44.4;HR-MS(ESI)m/z:Calcd for C22H16NOFNa{[M+Na]+}352.1108,found 352.1124。
(Z)-2-芐基-3-(3-甲基亞芐基)異吲哚啉-1-酮(4k):白色固體,收率79%,m.p.108~110 ℃;1H NMR(400 MHz,Acetone-d6)δ:7.94(d,J=7.2 Hz,1H),7.87(d,J=7.6 Hz,1H),7.68(t,J=7.6 Hz,1H),7.58(t,J=7.2 Hz,1H),7.18(t,J=7.2 Hz,1H),7.12~7.04(m,4H),6.97(d,J=7.2 Hz,1H),6.87(s,1H),6.84(s,1H),6.57(d,J=6.0 Hz,1H),4.90(s,2H),2.18(s,3H);13C NMR(101 MHz,Acetone-d6)δ:168.4,138.7,137.4,137.4,134.7,134.2,132.4,130.3,129.1,128.0,127.9,127.9,127.8,126.7,126.6,126.1,122.9,119.9,107.6,44.5,20.5.HR-MS(ESI)m/z:Calcd for C23H19NONa{[M+Na]+}348.1359,found 348.1366。
(Z)-2-芐基-3-(3-胺基亞芐基)異吲哚啉-1-酮(4l):黃色固體,收率59%,m.p.144~146 ℃;1H NMR(400 MHz,CDCl3)δ:7.92(d,J=7.6 Hz,1H),7.72(d,J=7.6 Hz,1H),7.61(t,J=7.6 Hz,1H),7.52(t,J=7.6 Hz,1H),7.13(m,3H),7.06(td,J=8.0 Hz,2.0 Hz,1H),6.75~6.64(m,3H),6.59(d,J=8.0 Hz,1H),6.53(d,J=7.6 Hz,1H),6.27(s,1H),4.95(s,2H),3.50(s,2H);13C NMR(101 MHz,CDCl3)δ:169.1,145.9,138.5,137.2,135.4,134.3,132.1,128.9,128.8,128.0,126.6,126.5,126.4,123.4,119.9,119.4,116.3,114.2,107.8,45.0;HR-MS((ESI)m/z:Calcd for C22H19N2O{[M+H]+}327.1497,found 327.1503。
1 結(jié)果與討論
1.1 反應(yīng)條件篩選
首先對(duì)催化劑進(jìn)行了篩選,在乙腈中,130 ℃下,以CsCO3為堿,選取了CuCl2、CuBr2、CuSO4、Cu(AcO)2作催化劑,發(fā)現(xiàn)CuCl2相對(duì)其它三種催化劑更適合本反應(yīng),可以得到最高產(chǎn)率,達(dá)到83%(No.1~4)。然后以CuCl2為催化劑,對(duì)不同的堿進(jìn)行篩選,包括CsCO3、K2CO3、Na2CO3、K2PO4和Et3N,發(fā)現(xiàn)在同種條件下,只有CsCO3、K2CO3、K2PO4反應(yīng)很明顯,CsCO3為堿可以得到最高的反應(yīng)產(chǎn)率(No.4,No.5~10)。隨后,考察了DMF、DMSO和1,4-二氧六環(huán)等作溶劑對(duì)反應(yīng)的影響,發(fā)現(xiàn)乙腈作溶劑可以得到較高的產(chǎn)率(No.4,No.11~14)。此外,當(dāng)反應(yīng)中未加PyBOP時(shí),未檢測(cè)到目標(biāo)產(chǎn)物(No.17),具體原因仍在研究中。最終確定此反應(yīng)的最優(yōu)條件為:鄰溴苯甲酸0.3 mmol,苯乙炔1.5 eq.和糠胺1.2 eq.在0.1eq.CuCl2,3 eq.CsCO3和1 eq.PyBOP的乙腈溶液中反應(yīng),產(chǎn)率最高達(dá)到83%。
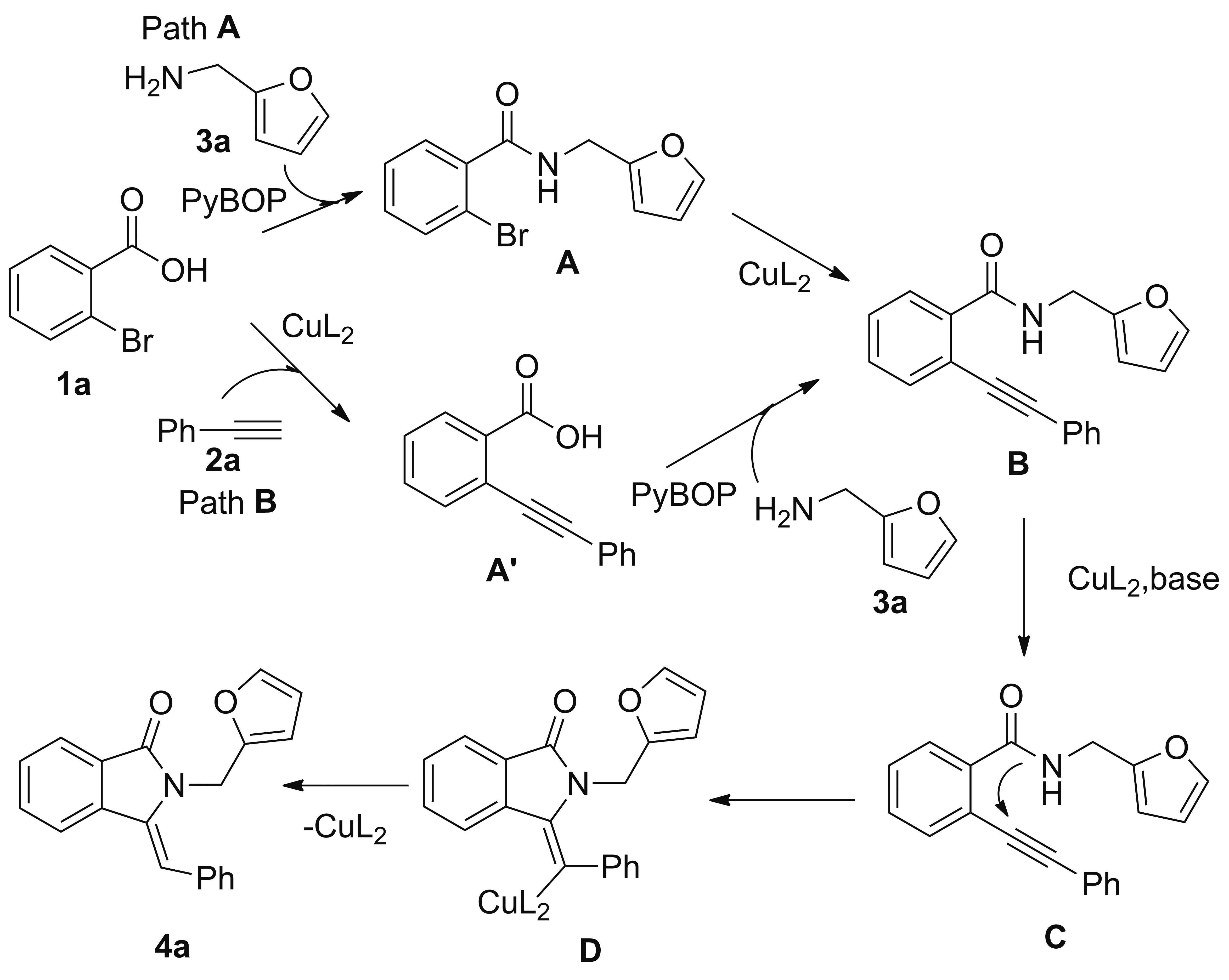
Scheme 2
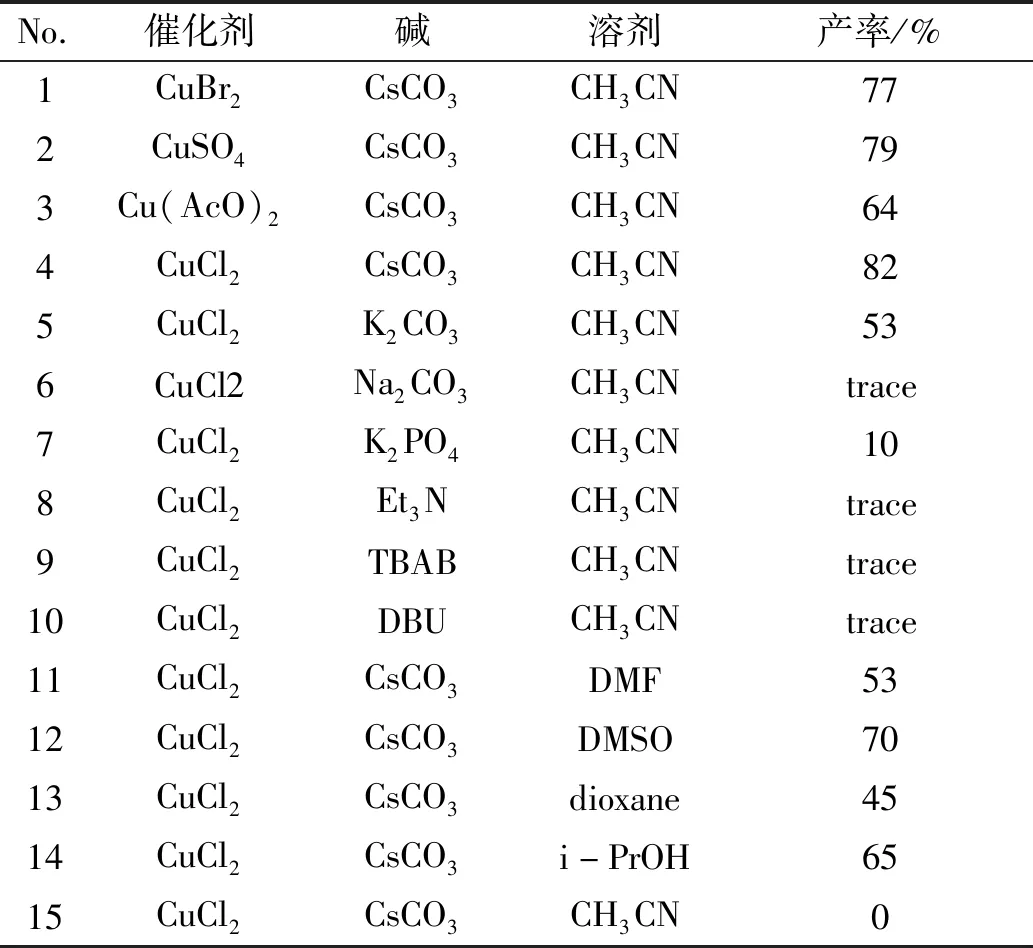
表1 反應(yīng)條件優(yōu)化Table 1 Optimization of reaction conditions
1.2 底物拓展
在最優(yōu)化反應(yīng)條件下,對(duì)苯乙炔和氨甲基上的取代基R1和R2進(jìn)行了研究。當(dāng)氨甲基取代基為呋喃、吡啶、噻吩雜環(huán)時(shí),都能以較高的產(chǎn)率得到異吲哚啉酮衍生物,并且吡啶的不同位置被氨甲基取代,得到的收率差別不大。同時(shí),當(dāng)氨甲基被苯環(huán)取代時(shí),苯環(huán)上不同取代的吸電子或給電子基團(tuán)對(duì)反應(yīng)收率影響均不明顯。此外,氨甲基的雜環(huán)取代相對(duì)苯環(huán)取代收率有所降低。隨后我們對(duì)苯乙炔上不同取代基的性質(zhì)和位置進(jìn)行考察,發(fā)現(xiàn)同一取代位置上,苯乙炔上吸電子取代基F相對(duì)給電子取代基CH3、NH2等可以獲得更高的收率,并且被取代基取代的苯乙炔相對(duì)苯乙炔收率有所降低。
1.3 反應(yīng)機(jī)理
根據(jù)實(shí)驗(yàn)結(jié)果及文獻(xiàn)[19]報(bào)道,PyBOP是一種可參與酰胺化的含磷縮合劑,我們猜想PyBOP在該反應(yīng)中不僅起到了活化羧酸,進(jìn)行酰胺化的作用,而且可能與銅金屬配位進(jìn)行偶聯(lián)反應(yīng)。由此,我們提出該反應(yīng)的可能機(jī)理為(Scheme 2):該反應(yīng)存在兩種路徑,一種是鄰溴苯甲酸(1a)通過(guò)PyBOP縮合劑與糠胺(3a)作用得到酰胺化產(chǎn)物A,再通過(guò)PyBOP配位的銅催化Sonogashira 偶聯(lián)反應(yīng)得苯乙炔(2a)偶聯(lián)的中間體(B);另一種是鄰溴苯甲酸(1a)通過(guò)PyBOP配位的銅催化Sonogashira偶聯(lián)反應(yīng)得到苯乙炔(2a)偶聯(lián)的鄰苯甲酸中間體A′,再經(jīng)過(guò)酰胺化反應(yīng)得到中間體(B);再經(jīng)過(guò)酰胺化合物氮上氫去質(zhì)子分子內(nèi)關(guān)環(huán)經(jīng)中間體(C),然后經(jīng)過(guò)(D)脫去金屬配體得到異吲哚啉酮目標(biāo)產(chǎn)物(4a)。
3 結(jié)論
報(bào)道了一種簡(jiǎn)單、高效合成異吲哚啉酮類化合物的新方法。該方法原料易得、操作簡(jiǎn)便、底物適用性良好,可以合成雜環(huán)修飾的異吲哚啉酮類化合物,為豐富異吲哚啉酮類化合物的結(jié)構(gòu)多樣性,以及心血管系統(tǒng)藥物的活性篩選奠定了基礎(chǔ)。

