下調miR-27a表達對三陰乳腺癌細胞增殖、遷移和侵襲的影響
程 龍,徐五琴,張 鵬,黃建軍,李小寧
1. 皖南醫學院弋磯山醫院檢驗科,蕪湖 241001;2. 皖南醫學院弋磯山醫院病理科,蕪湖 241001
三陰乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)和人類表皮生長因子受體2(human epidermal growth factor receptor-2,HER2)表 達均為陰性的乳腺癌,其占所有乳腺癌的15%~25%,且具有特殊的生物學表達及臨床病理特性[1]。與非三陰乳腺癌(non-triple-negative breast cancer,non-TNBC)相 比,TNBC具有較高的復發率及轉移率,患者生存時間短,且因其HER2表達陰性而無法應用曲妥珠單抗等靶向治療藥物[1-2]。因此探討TNBC發生發展的分子機制,尋找有效的TNBC治療靶點已成為目前乳腺癌研究領域的熱點。
miRNA是一類具有轉錄后調節功能的單鏈RNA分子,其異常表達在腫瘤發生過程中發揮重要作用[3]。miR-27a作為一種致癌因子在多種實體腫瘤中表達升高,并能夠促進腫瘤細胞增殖和侵襲[4-5]。研究[4,6]發現,miR-27a在乳腺癌組織中高表達,其通過抑制鋅指蛋白ZBTB10(zinefinger and BTB domain containing 10)、泛素連接酶FBW7(F-box and WD repeat domain-containing 7,FBW7)等蛋白表達促進乳腺癌細胞的增殖和侵襲。FBW7是泛素-蛋白酶體系統中的一種重要蛋白,可通過介導多種腫瘤相關蛋白,如Egl 9同源物2(Egl nine homolog 2,EGLN2)泛素化發揮抑癌作用[7]。EGLN2又名脯氨酸羥基化酶1(proly hydroxylase 1,PHD1),具有在特定環境下調控缺氧誘導因子(hypoxia inducible factor,HIF)的作用[8]。EGLN2在乳腺癌中的表達升高,并促進乳腺癌細胞系的增殖及耐藥[9]。本研究通過實驗檢測miR-27a表達對TNBC細胞的增殖、遷移與侵襲的影響,并闡釋其調控的分子機制,以期為TNBC的治療提供新的靶點。
1 材料與方法
1.1 臨床標本和細胞株
選取2017年1月—2018年12月皖南醫學院弋磯山醫院甲乳外科行乳腺癌改良根治術的TNBC新鮮組織標本68例,經常規病理學檢查明確為非特殊類型的浸潤性導管癌,且免疫組織化學法染色ER、PR、HER2均為陰性。于距離腫瘤邊緣3 cm以上處取正常乳腺組織作為癌旁組織對照,標本收集后保存于液氮中備用。收集患者基本臨床資料,包括年齡、是否絕經、腫瘤最大直徑、腫瘤組織學分級、腫瘤臨床分期、增殖細胞核抗原Ki-67指數、有無淋巴結轉移等。采用2012版WHO乳腺癌腫瘤組織學分級將乳腺癌分為Ⅰ級(高分化)、Ⅱ級(中分化)、Ⅲ級(低分化),腫瘤臨床分期采用TNM分期將乳腺癌分為Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期。根據熒光定量PCR結果,miR-27a表達較癌旁組織升高大于等于50%列為miR-27a高表達組,miR-27a表達較癌旁組織不升高或升高小于50%列為miR-27a低表達組。所有患者術前均未行放射治療和化學治療。本研究經皖南醫學院弋磯山醫院倫理委員會批準,所有患者均簽署知情同意書。人轉移性TNBC細胞系MDA-MB-453以及人正常乳腺上皮細胞MCF-10A均購自中國科學院細胞庫。
1.2 主要試劑
RPMI-1640培養基、DMEM高糖培養基、胎牛血清、0.25%胰酶細胞消化液均購自美國Gibco公司,miR-27a抑制物及其對照購自上海吉瑪公司,轉染試劑Lipofectamine 3000、總RNA抽提試劑TRIzol購自美國ThermoFisher公司,SYBR Green熒光定量PCR試劑盒、miR-27a及U6引物購自日本TaKaRa公司,IPA裂解液、蛋白酶抑制劑PMSF、BCA蛋白濃度檢測試劑盒、SDS-PAGE凝膠配制試劑盒、CCK-8試劑及凋亡檢測試劑盒均購自碧云天生物技術研究所,Transwell小室購自美國Corning公司,Matrigel基底膜基質膠購自美國BD公司,FBW7、EGLN2、β- 肌動蛋白(β-actin)抗體及二抗購自美國Abcam公司。
1.3 細胞培養
TNBC細胞MDA-MB-453采用RPMI-1640培養基培養,MCF-10A細胞采用DMEM高糖培養基培養。培養基均加入10%胎牛血清、100 U/L青霉素和100 U/L鏈霉素,培養箱條件為37 ℃、95%飽和濕度及5% CO2。根據細胞生長狀態2~3 d換液1次。細胞生長至70%融合時,0.25%胰酶細胞消化液消化傳代,取第3代對數生長期細胞用于后續實驗。
1.4 實時熒光定量PCR檢測miR-27a表達
采用TRIzol-氯仿提取組織及細胞總RNA,將mRNA反轉錄為cDNA。SYBR Green熒光定量PCR試劑盒檢測miR-27a表達,以U6為內參基因,采用2-ΔΔCT計算目的基因的相對定量結果。miR-27a上、下游引物序列[10]分 別 為 5'-CGGCGGTTTCACAGTGGCTAAG-3'和5'-CCAGTGCAGGGTCCGAGGTAT-3';U6上、下游引物序列分別為5'-CTCGCTTCGGCAGCACA-3'和5'-AACGCTT CACGAATTTGCGT-3'。
1.5 細胞轉染
取對數生長期細胞接種于6孔板,使用Lipofectamine 3 000轉染試劑,參考說明書分別向MDA-MB-453細胞轉染miR-27a抑制物(miR-27a inhibitor組)和miR-27a陰性對照片段(NC組),未轉染組作為空白對照(control組)。熒光顯微鏡下檢查轉染效率,轉染成功后培養板置37 ℃培養箱繼續培養,48 h后收集細胞進行后續實驗。miR-27a抑制物序列為5'-GCGGAACUUAGCCCACUGUGAA-3'。
1.6 CCK-8實驗檢測細胞增殖能力
收集轉染48 h后的細胞接種于96孔板中,每孔接種2×104細胞,分別在接種后1、2、3、4、5 d,采用CCK-8法檢測細胞活性。直接向每孔加入10 μL的CCK-8試劑,37 ℃培養箱中避光孵育30 min,酶標儀上測定450 nm處吸光度值[D(450 nm)],根據吸光度值計算各組細胞生存率。
1.7 Transwell實驗檢測細胞遷移和侵襲能力
收集各組對數生長期細胞,采用無血清RPMI-1640培養基重懸細胞后接種于Transwell上室,每組設置5個復孔,每室接種100 μL密度為2.5×105/mL的細胞懸液。其中遷移實驗直接使用未處理的Transwell小室,侵襲實驗采用包被Matrigel基質膠的Transwell小室。下室加入600 μL含10%胎牛血清的RPMI-1640培養基,37 ℃培養箱中培養24 h。4%多聚甲醛固定后,結晶紫染色,高倍鏡下計數穿膜細胞數。
1.8 蛋白質印跡法檢測FBW7和EGLN2蛋白表達
細胞裂解法提取各組細胞總蛋白,BCA法檢測蛋白質濃度,并行蛋白質印跡法(Western blotting)檢測。于SDSPAGE蛋白電泳結束后轉膜,5%脫脂奶粉封閉3 h,加入一抗,4 ℃封閉過夜,次日洗膜后加入二抗,37 ℃孵育1 h。洗膜后加入化學發光底物,凝膠成像系統掃描成像。以β-actin作為內參照,分析所得條帶灰度值,計算蛋白相對含量。
1.9 統計學分析
應用SPSS 13.0和Graphpad Prism 8.0軟件進行數據分析和作圖。定量資料用±s表示,組間比較采用t檢驗;定性資料用頻數和百分比表示,組間比較采用χ2檢驗。P<0.05認為差異有統計學意義。所有實驗至少進行3次獨立重復實驗。
2 結果
2.1 miR-27a表達與TNBC患者臨床特征的關系
通過分析miR-27a表達與TNBC患者臨床特征的關系,發現miR-27a表達與患者組織學分級、臨床分期、淋巴結轉移以及腫瘤最大直徑相關(均P<0.05);而與患者年齡、是否絕經以及Ki-67指數無明顯相關性(表 1)。

表1 不同miR-27a表達水平的TNBC患者臨床特征比較[n(%)]Tab 1 Comparison of clinical characteristics of TNBC patients with different levels of miR-27a expression [n (%)]
2.2 miR-27a在TNBC組織及MDA-MB-453細胞系中的表達
實時熒光定量PCR(quantitative real-time PCR,qPCR)檢測結果顯示,TNBC組織中miR-27a表達明顯高于癌旁組織(P=0.039)(圖1A),miR-27a在TNBC細胞系MDAMB-453中表達顯著高于正常乳腺上皮細胞MCF-10A(P=0.015)(圖 1B)。

圖1 qPCR檢測miR-27a在TNBC組織及細胞系中的表達水平Fig 1 Expression of miR-27a in TNBC tissues and TNBC cell line detected by qPCR
2.3 MDA-MB-453細胞系中miR-27a干預實驗
MDA-MB-453細胞轉染miR-27a抑制物后48 h,細胞內miR-27a含量與NC組相比顯著下降(P=0.041),而NC組細胞miR-27a含量與control組相比差異無統計學意義(圖2A)。Western blotting實驗結果顯示,轉染miR-27a抑制物后,細胞內FBW7蛋白表達顯著上升,而EGLN2蛋白表達明顯下降(均P<0.05)(圖2B)。這表明抑制TNBC細胞中miR-27a表達可以上調FBW7蛋白質表達,同時抑制EGLN2蛋白表達。
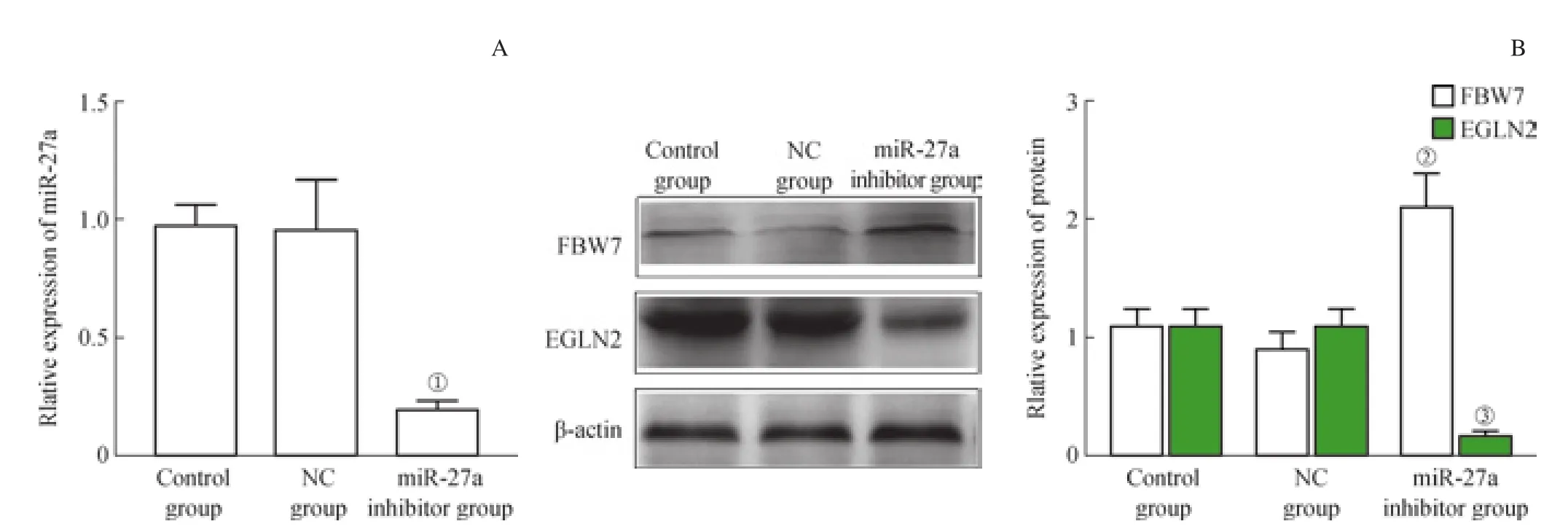
圖2 轉染miR-27a抑制物對MDA-MB-453細胞miR-27a表達以及FBW7、EGLN2蛋白表達的影響Fig 2 Effect of transfection of miR-27a inhibitor on miR-27a, FBW7 and EGLN2 expression in MDA-MB-453 cells
2.4 轉染miR-27a抑制物對MDA-MB-453細胞增殖的影響
CCK-8檢測結果,在接種后3、4和5 d,miR-27a inhibitor組細胞增殖活性較NC組明顯降低(均P<0.05);而在各檢測時間點,NC組與control組,增殖活性差異無統計學意義(圖3)。表明下調MDA-MB-453細胞中miR-27a表達可顯著抑制細胞增殖能力。
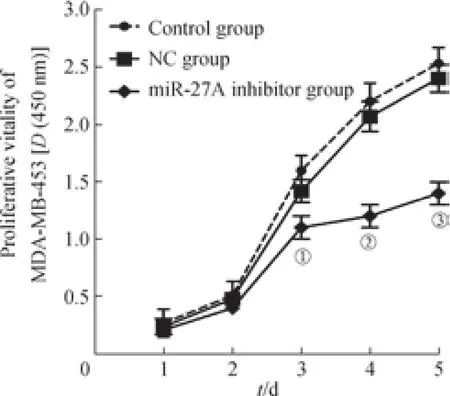
圖3 下調miR-27a表達對MDA-MB-453細胞增殖能力的影響Fig 3 Effect of miR-27a down-regulation on the proliferation of MDA-MB-453 cells
2.5 轉染miR-27a抑制物對MDA-MB-453細胞遷移和侵襲的影響
Transwell遷移實驗結果顯示,轉染miR-27a抑制物48 h后穿膜細胞數明顯少于NC組(P<0.05),而NC組與control組相比穿膜細胞數無明顯差異(圖4A);同樣,Transwell侵襲實驗呈現出一致的結果(圖4B)。表明下調miR-27a表達可抑制TNBC細胞MDA-MB-453的遷移和侵襲能力。
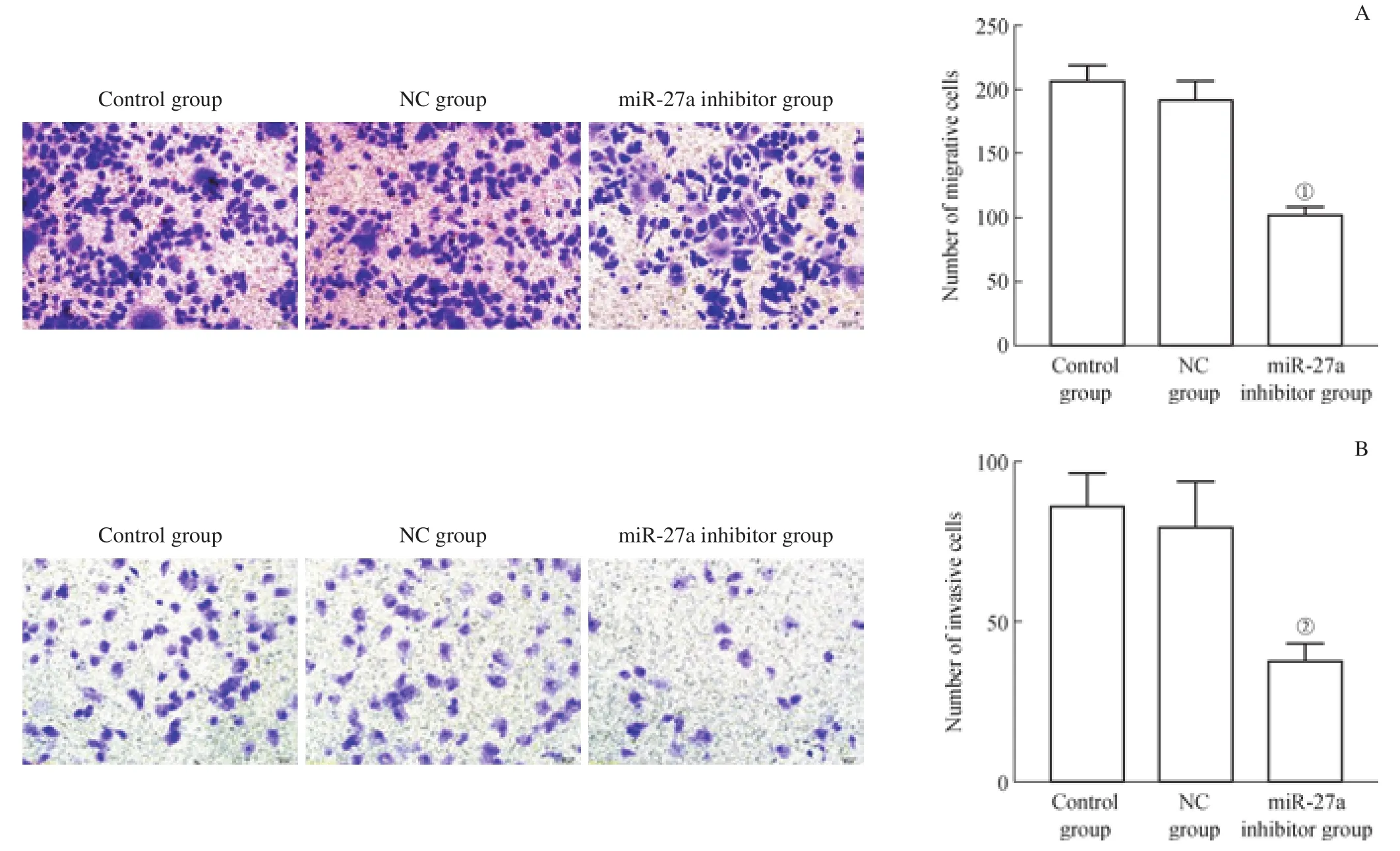
圖4 下調miR-27a表達對MDA-MB-453細胞遷移和侵襲的影響(×400,結晶紫染色)Fig 4 Effect of miR-27a down-regulation on the migration and invasion of MDA-MB-453 cells (×400, crystal violet staining)
3 討論
乳腺癌是女性最常見的惡性腫瘤之一,其發病率和死亡率在全球范圍內逐年增高,研究乳腺癌發病的分子機制成為世界普遍關注的熱點。TNBC作為一種特殊類型的乳腺癌,有發病年齡低、家族史明顯、惡性程度高、淋巴結轉移率和復發率高等特點[11-12],其發生、發展機制更加值得關注。
miR-27a作為一種致癌因子已被發現在多種實體腫瘤中表達升高,并且與腫瘤細胞的增殖、遷移和侵襲密切相關。Xia等[13]研究發現,胰腺癌細胞中miR-27a呈高表達,而下調miR-27a表達能夠顯著抑制胰腺癌細胞系的增殖和侵襲能力。最近的研究發現,miR-27a參與調控乳腺癌細胞的增殖和侵襲。如miR-27a能夠通過特異性地調控FBW7蛋白促進乳腺癌細胞發生上皮間質轉化[14];此外miR-27a可直接上調轉錄因子SP1,促進腫瘤細胞G1/S期轉換,導致乳腺癌細胞異常增殖,而下調miR-27a能夠顯著抑制乳腺癌細胞增殖[15]。本研究在TNBC組織中檢測發現miR-27a表達升高,并且miR-27a表達與TNBC患者組織學分級、臨床分期、淋巴結轉移以及腫瘤最大直徑相關,差異具有統計學意義。此外,在TNBC細胞株MDAMB-453中同樣發現miR-27a高表達;進一步轉染miR-27a抑制物下調miR-27a表達,并檢測細胞增殖、遷移和侵襲能力。實驗結果顯示,miR-27a inhibitor組細胞在接種后3、4和5 d的細胞增殖活性明顯低于NC組,并且Transwell遷移和侵襲實驗中miR-27a inhibitor組穿膜細胞數均顯著少于NC組。證實了下調miR-27a可抑制TNBC細胞MDA-MB-453的增殖、遷移和侵襲。
近年來有研究[7]發現,在TNBC細胞中FBW7表達缺失,這一缺失導致EGLN2蛋白升高并與腫瘤細胞的生長和轉移相關。FBW7是一種泛素連接酶,其基因在多種腫瘤包括直腸癌、胃癌、卵巢癌和乳腺癌中存在著突變或缺失。FBW7可直接結合和靶向作用多種轉錄激活因子或原癌基因并對其進行泛素化修飾[16],誘導靶蛋白水解,從而調控腫瘤細胞的增殖與凋亡[17]。為進一步明確miR-27a對TNBC細胞生物學功能影響的分子機制,本實驗對各組細胞FBW7以及EGLN2蛋白表達進行了檢測。結果顯示,與NC組相比下調miR-27a表達導致MAD-MB-453細胞中FBW7表達上升,而EGLN2蛋白表達顯著下降。已有研究[18-20]證實miR-27a可負向調控FBW7蛋白表達,與本實驗結果一致。綜上所述,在TNBC細胞MDA-MB-453中下調miR-27a表達可顯著抑制腫瘤細胞增殖、遷移和侵襲,并可能與FBW7介導的EGLN2蛋白泛素化密切相關。

