可溶性高尿酸對人臍靜脈內皮細胞NLRP3炎性體途徑的影響
蘇畢·阿吉 尹洪超
尿酸(uric acid,UA)作為體內嘌呤代謝產物,是血漿中主要的抗氧化物之一,能有效抵抗氧自由基導致的氧化應激[1]。然而在人類進化中,由于丟失了尿酸酶這一基因,導致人體血液中的UA比其他哺乳動物體內高出10倍左右。當人體血尿UA濃度高于6.8mg/dl時被定義為高尿酸血癥。近年來的流行病研究結果顯示,高尿酸血癥與多種心血管疾病的病理過程相關,如高血壓、冠心病、動脈粥樣硬化等,然而UA在其中的病理生理學作用仍有待于進一步研究[2~4]。內皮細胞作為血管的第1層屏障和內分泌細胞,通過旁分泌作用分泌多種血管活性物質和炎性細胞因子在調節血管功能方面起著重要作用[5]。內皮細胞活化被Pober等[6]研究者定義為,內皮細胞在損傷因素的刺激下改變了蛋白質的合成,并以細胞因子的形式傳遞細胞對刺激的反應。當內皮細胞發生活化時,選擇素、黏附分子、趨化分子等炎性介質表達增加,從而參與心血管等疾病的使動環節[7]。因此,內皮細胞在心血管疾病發生、發展中起重要作用。
NOD樣受體(NOD-like receptor,NLR)家族蛋白3(NLRP3)炎性體是由NLRP3、凋亡相關微粒蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和胱冬肽酶-1前體(pro-caspase-1)組成的異源三聚體。被激活時,NLRP3蛋白募集銜接蛋白ASC,ASC募集下游失活狀態的pro-caspase-1[8]。該炎性體復合物的聚合會使pro-caspase-1自我催化形成活化狀態的caspase-1。活化的caspase-1切割游離的IL-1β前體(pro-IL-1β)形成成熟的IL-1β并釋放于胞外。普遍認為,NLRP3炎性體通路需要兩步激活[9]。第一步需要炎性體啟動(inflammasome priming)信號,負責誘導NLRP3和pro-IL-β的轉錄翻譯,使其表達量上調,為轉錄水平調控;第二步為炎性體活化(inflammasome activation)信號,負責誘導NLRP3炎性體復合物的募集,如形成NLRP3-ASC復合物等,為轉錄后水平調控。多種配體可作為NLRP3炎性體的啟動信號刺激物,包括作用于Toll樣受體4(TLR4)的脂多糖(LPS)和作用于TLR2的Pam3CSK4均激活NF-κB通路從而促進NLRP3和pro-IL-1β的轉錄[10]。多種刺激物可作為NLRP3的活化信號,包括UA晶體、ATP等,他們共同的作用機制可能通過ROS生成、溶酶體降解或陽離子外流等途徑[11~13]。
NLRP3炎性體是固有免疫的重要組成部分,其主要作用是識別非微生物危險信號并誘發無菌性炎性反應參與各種炎性慢性疾病的發生、發展[14]。近期許多研究結果顯示,UA作為一種內源性危險信號,不僅單鈉尿酸鹽(MSU)能激活NLRP3炎性體,溶解性UA也能激活NLRP3,如在小鼠骨髓源巨噬細胞、大鼠心肌細胞、人單核細胞、平滑肌細胞和腎小管上皮細胞等[15~19]。目前并不了解溶解性UA是否能激活人內皮細胞NLRP3炎性體通路并影響其功能。已有研究報道,200μg/ml的可溶性高濃度UA作用于內皮細胞,并通過HMGB1/RAGE通路誘導內皮細胞功能紊亂[20]。且200μg/ml以上的UA在低溫下可能會析出[21]。因此,本研究用高濃度(200μg/ml)可溶性UA明確高濃度UA是否對HUVECs NLRP3炎性體通路有顯著影響。
材料與方法
1.材料:原代人臍靜脈內皮細胞(human umbilical vein endothelial cell, HUVEC)和血管內皮細胞培養基(endothelial cell medium, ECM)購自美國ScienCell公司;尿酸(uric acid, UA)購自美國Sigma公司;TB GreenTMPremix Ex TaqTMⅡ(RR820A)購自寶日醫生物技術(北京)有限公司;蛋白質定量試劑盒(BCA法)(P1511)、抗β-tubulin單克隆抗體(C1340)、HRP標羊抗小鼠二抗(C1308)、HRP標羊抗兔二抗(C1309)和活性氧檢測試劑盒(S0033)購自碧云天生物技術公司;NLRP3一抗(ab214185,ab4207)、IL-1β一抗(ab9722)、ASC一抗(ab155970)、羊抗兔熒光標記IgG(ab96899)和驢抗羊熒光標記IgG(ab150131)購自英國Abcam公司;P65一抗(D14E12)購自美國CST公司;TRIzol(15596026)和驢抗兔熒光標記IgG(A21206)購自美國賽默飛公司。
2.細胞培養方法:HUVECs用含5%胎牛血清、1%內皮細胞生長添加劑 (ECGS,Cat.No.1052)的ECM培養基于37℃、5%CO2孵箱中常規培養。細胞隔天換液,融合至80%~90%時胰酶按1∶3傳代,取4~7代細胞用于后續實驗。
3.UA溶液配制:參考如前所述的方法配制200μg/ml的UA溶液[21]:將稱取好的UA粉末直接添加至ECM,37℃孵育40min,并每隔10min上下顛倒混勻。待UA粉末完全溶解,用0.22μm濾器過濾至無菌容器中。尿酸酶法檢測UA濃度,并根據檢測結果進行矯正,再次確認濃度,4℃保存,并1周內用完。
4.RNA提取和qPCR檢測:取第4~5 代細胞,前1天將細胞傳代至6cm皿,次日更換200μg/ml的UA培養液并培養24h。用TRIzol(1毫升/皿)收集各組細胞,在預處理過的無RNase環境抽提細胞RNA。用微量分光光度計測RNA濃度,并按RT-PCR試劑盒(北京全式金生物技術有限公司,AT311)流程進行反轉錄。根據qPCR試劑盒(RR820A)說明進行qPCR反應。β-actin作內參,以2-ΔΔCt值計算各基因的相對表達量。PCR反應引物序列及擴增片段長度見表1。
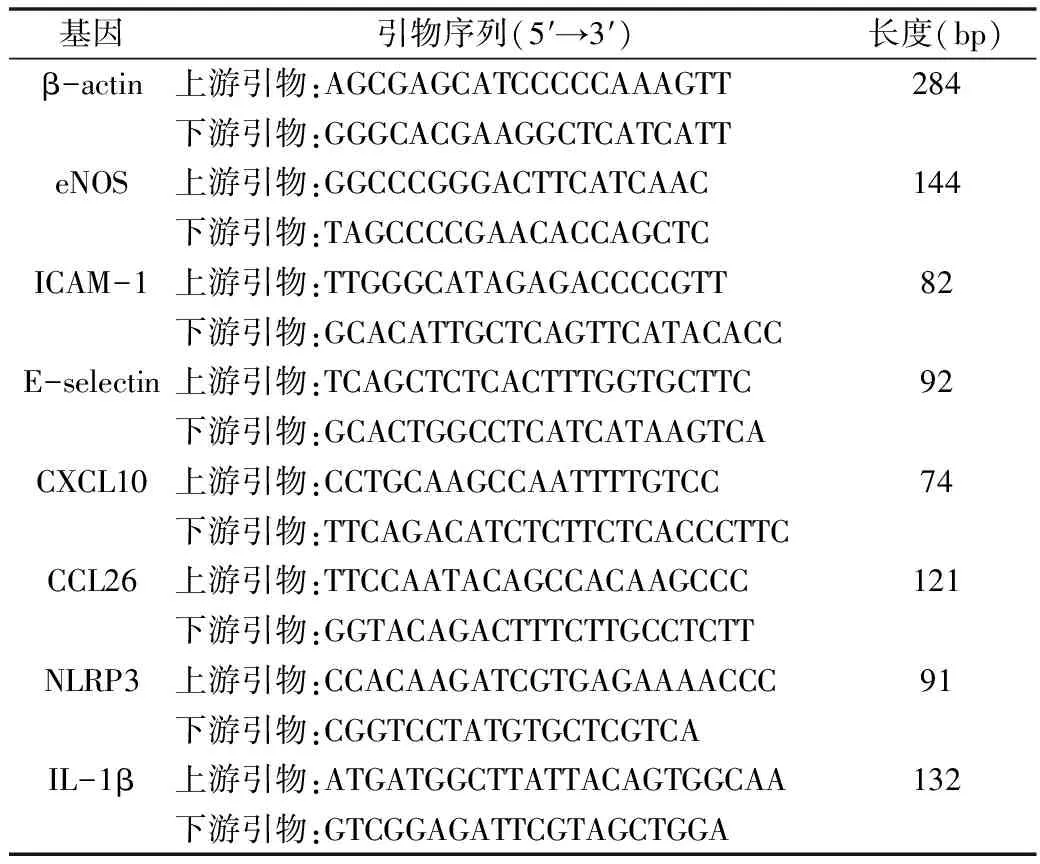
表1 PCR反應引物序列及擴增片段長度
5.Western blot法檢測蛋白表達:細胞處理同qPCR。其中LPS(500ng/ml,12h)作陽性對照。用Western blot法及IP細胞裂解液(碧云天生物技術公司,P0013)提取細胞總蛋白,并用BCA法測定蛋白濃度。調整蛋白濃度后95℃金屬浴10min,并取10μg蛋白進行SDS-PAGE膠電泳,將蛋白電泳產物轉印至NC膜上。用5% BSA室溫封閉1h,分別加入β-tubulin一抗(1∶5000)、NLRP3一抗(1∶200)及IL-1β一抗(1∶1000),4℃孵育過夜。次日,TBST洗5min×4次,加入相應二抗(1∶5000),室溫孵育1h。TBST洗5min×8次,ECL發光、顯影。采用Image J圖像處理軟件分析各蛋白灰度值。以tubulin為內參,目的蛋白灰度值/內參蛋白灰度值算出目的蛋白相對表達量。
6.免疫熒光染色:將HUVEC以密度1.5×105接種于24孔板爬片過夜培養,并用200μg/ml UA處理細胞24h或500ng/ml LPS處理12h(陽性對照)。4%多聚甲醛室溫固定15min,PBS洗3次,含0.3% Triton X-100的5%BSA室溫封閉60min。棄上清加入P65一抗(1∶400)4℃過夜。次日,PBS洗3次加入羊抗兔二抗(1∶250)室溫避光孵育1h,PBS洗3次,含DAPI甘油封片,并用共聚焦顯微鏡拍照。至于NLRP3和ASC雙染實驗采用依次孵育的方法,即先孵育NLRP3一抗(1∶200)4℃過夜,之后室溫避光孵育1h驢抗羊紅色熒光二抗(1∶500),再孵育ASC一抗(1∶250)4℃避光過夜,最后室溫避光孵育1h驢抗兔綠色熒光二抗(1∶500),含DAPI甘油封片并拍照。采用對照組調整背景熒光強度后固定條件,每個實驗組拍攝5~10個視野。
7.ROS檢測:采用DCFH-DA法。細胞處理同免疫熒光染色。各組在培養6h時分別加入1∶1000稀釋的 DCFH-DA(終濃度10μmol/L),繼續37℃避光孵育45min。遇冷PBS洗3次,1%多聚甲醛室溫固定15min,PBS洗3次,含DAPI甘油封片,及時用共聚焦顯微鏡觀察并拍照,并采用Image J圖像處理軟件統計各組照片中平均細胞光密度(IOD)值。

結 果
1.UA誘導表達HUVECs黏附分子和趨化因子mRNA:200μg/ml的UA誘導HUVECs的黏附分子ICAM-1和E-選擇素mRNA水平上調(圖1中A、B)。其中ICAM-1表達量上調約5倍(P=0.000),E-選擇素表達量上調約2倍(P<0.01)。此外,200μg/ml的UA誘導HUVECs的趨化因子CXCL10和CCL26 mRNA表達量上調(圖1中C、D),且CXCL10和CCL26 mRNA均上調5倍左右(P=0.000,P<0.01)。
2.UA降低HUVECs內皮型一氧化氮合酶(eNOS)mRNA水平:由圖2可見,與對照組比較,200μg/ml UA組eNOS mRNA表達量下調約2.4倍,提示溶解性高UA下調eNOS表達量。
3.UA對HUVECs NLRP3炎性體核酸和蛋白水平的影響:用LPS作陽性對照顯示,細胞NLRP3和pro-IL-1β蛋白水平均顯著上調(圖3中C、D),且切割后成熟IL-1β水平也增加到約2倍。然而,200μg/ml的可溶性UA對 HUVECs內NLRP3、pro-IL-1β的mRNA(圖3中A、B)和蛋白水平沒有顯著影響(圖3中C、D),且未切割形成成熟的IL-1β(圖3中C、D)。可溶性高UA對HUVECs NLRP3和pro-IL-β轉錄水平無顯著影響。由圖4可見,200μg/ml UA刺激HUVECs 24h后,未檢測到NF-κB核移位。而陽性組LPS明顯上調了HUVECs的NF-κB表達并激活入核。可溶性高UA對HUVECs NF-κB通路無明顯的刺激作用。
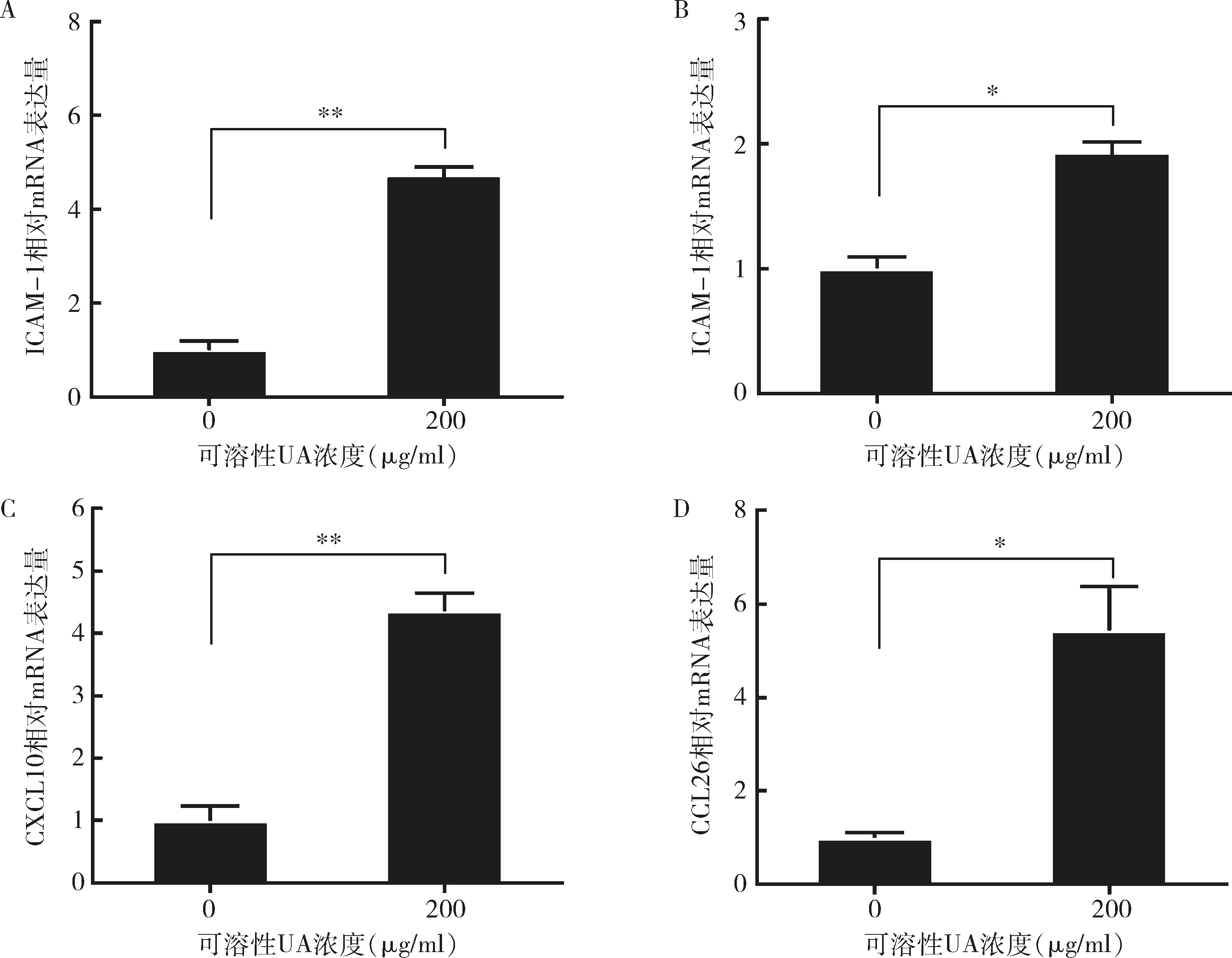
圖1 UA誘導HUVECs黏附分子和趨化因子mRNA表達用200μg/ml的可溶性UA刺激HUVEC 24h,并通過qPCR檢測黏附分子ICAM-1、E-選擇素和趨化因子CXCL10、CCL26 mRNA水平。數據來自3個獨立實驗,*P<0.01, **P=0.000
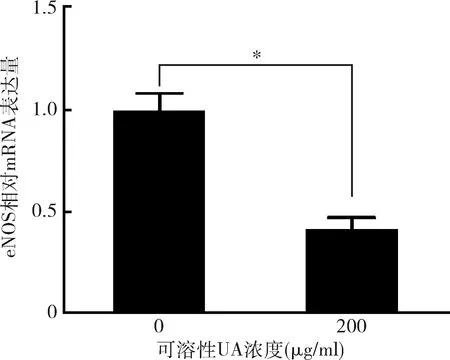
圖2 qPCR檢測eNOS mRNA表達量用200μg/ml的可溶性UA刺激HUVEC 24h,并通過qPCR檢測eNOS mRNA水平。數據來自3個獨立實驗,*P<0.01
4.UA誘導HUVECs內NLRP3-ASC復合體形成:200μg/ml UA誘導NLRP3-ASC共定位,可溶性高UA促進了HUVECs 內NLRP3-ASC復合體形成(圖5)。
5.UA上調HUVECs ROS水平:HUVECs胞質ROS水平顯著增高(圖6中A、B,P=0.000)。
討 論
心血管疾病是世界上高發生率和高病死率的疾病之一。大規模的流行病學研究提示,高尿酸血癥與心血管疾病的病程進展密切相關。很多研究者傾向于認為,UA可能是心血管疾病發生率和病死率獨立的特異性標志物之一[2]。然而其相關機制尚需進一步研究。NLRP3炎性體作為固有免疫的重要組成部分,識別非微生物危險信號并誘發無菌性炎性反應參與心血管疾病等慢性炎性疾病的發生、發展[14]。因此,筆者通過高濃度的UA體外處理HUVECs,探究可溶性高UA是否誘導HUVECs NLRP3炎性體通路來參與這一過程。
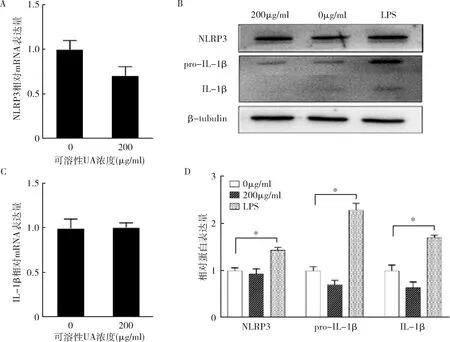
圖3 UA對HUVECs NLRP3炎性體啟動無顯著影響A、B.200μg/ml的可溶性UA刺激HUVECs 24h或500ng/ml LPS處理12h后 Western blot法檢測NLRP3、pro-IL-1β和IL-1β的蛋白表達量;C.用qPCR檢測NLRP3相應mRNA水平;D.用qPCR檢測IL-1β相應mRNA水平。數據來自3個獨立實驗,*P<0.01

圖4 UA對HUVECs NF-κB無明顯刺激作用200μg/ml UA刺激HUVECs 24h或500ng/ml LPS處理12h后,共聚焦顯微鏡觀察NF-κB的表達和核移位情況(免疫熒光染色)

圖5 UA誘導HUVECs 內NLRP3-ASC募集200μg/ml UA刺激HUVECs 24h或500ng/ml LPS處理12h+5mmol/L ATP處理30min后,共聚焦顯微鏡檢測NLRP3和ASC共定位情況(免疫熒光染色)

圖6 UA誘導HUVECs 產生ROSA.200μg/ml的可溶UA處理HUVEC 24h后,用DCFH-DA熒光探針檢測胞質ROS水平;B.通過ImageJ圖像處理軟件統計ROS相對熒光強度。柱狀圖代表至少5個單獨視野中單個細胞總熒光強度(免疫熒光染色)
eNOS通過產生一氧化氮(NO)發揮舒血管作用,在內皮細胞功能調節中起標志性重要作用[22]。eNOS的轉錄水平調控和轉錄后調控以及蛋白之間的相互作用均會影響NO的合成和釋放,從而影響內皮細胞功能。由于NLRP3炎性體啟動過程需要NF-κB通路的參與,因此筆者用UA處理HUVECs之后熒光標記NF-κB確定UA是否能激活NF-κB途徑[10]。ASC作為NLRP3通路的銜接分子,一旦與NLRP3產生復合體,募集下游的效應器分子并最終切割pro-IL-1β形成有生物學活性的IL-1β。因此,NLRP3-ASC共定位可作為NLRP3炎性體活化的標志。本研究結果顯示,可溶性高UA誘導HUVECs上調黏附分子ICAM-1、E-選擇素和趨化分子CXCL10、CCL-26,提示UA誘導HUVECs活化。同時可溶性高UA下調HUVECs eNOS mRNA水平,提示UA在轉錄水平影響eNOS表達,從而可能影響HUVECs NO合成功能。
QPCR和Western blot法檢測結果顯示,可溶性高UA對NLRP3和pro-IL-1β mRNA和蛋白水平均無顯著影響,提示可溶性高UA并未激活HUVECs NLRP3炎性體的啟動信號。雖然UA誘導HUVECs形成了NLRP3-ASC復合物,但可能由于NLRP3炎性體復合物形成較少且細胞內沒有上調的pro-IL-1β,并未在細胞水平檢測到切割成熟的IL-1β。已有研究報道用LPS+UA的共刺激作用于小鼠骨髓源巨噬細胞等檢測到IL-1β的釋放[15,23]。因此,UA與其他危險因素如高脂、高糖等共同存在的條件下,UA與這些因子是否有協同作用激活NLRP3炎性體途徑并加劇內皮細胞功能不良有待做深入研究。
本研究結果顯示,可溶性高UA未誘導HUVECs NF-κB活化。有多項研究報道,在人外周血單核細胞(PBMCs),UA通過NF-κB通路誘導NLRP3炎性體啟動,顯著上調 NLRP3和pro-IL-1β,為NLRP3炎性體活化提供分子基礎[10]。但本實驗結果提示,UA在HUVECs不通過激活NF-κB通路誘導NLRP3和pro-IL-1β的轉錄表達。
本實驗也觀察到UA誘導ROS在HUVECs內累積。UA被認為具有抗氧化性,但之后被報道UA的(抗)氧化能力取決于它所處的環境,UA在細胞外基質和血漿中主要承擔抗氧化作用,一旦進入細胞就發揮促氧化作用[1]。關于HUVECs的一項研究表明,高UA能正反饋進入細胞中,并通過下調UA外流通道抑制UA流出,導致UA在內皮細胞內大量積累并產生ROS[24]。另外,曾在單核細胞、人THP-1細胞等其他細胞系中多次被報道ROS可激活NLRP3炎性體[13]。但在本實驗中,ROS對HUVECs 內IL-1β的產生沒有顯著影響,提示ROS在HUVECs對NLRP3炎性體途徑的激活無直接刺激作用。
綜上所述,本研究首次用原代人臍靜脈內皮細胞探討了UA對NLRP3炎性體通路的作用。結果顯示,可溶性高UA能使HUVECs活化。雖然UA促進NLRP3-ASC復合體形成,但沒有誘導IL-1β的產生。雖然UA上調HUVECs ROS水平,但跟NLRP3通路的激活不直接相關。因此可溶性高UA不激活HUVECs NLRP3炎性體途徑從而影響HUVECs相關功能。實驗結果也顯示,細胞內NLRP3-ASC復合物顯著增加,因此不能排除UA在其他因素協同作用下誘導NLRP3炎性體的激活并促進內皮細胞功能紊亂,從而參與心血管疾病等慢性炎性疾病的發生、發展。

