豬瘟病毒化學發光競爭ELISA抗體檢測試劑盒的應用研究
徐 璐 , 張乾義 , 夏應菊 , 任雪健 , 李 翠 , 鄒興啟 , 徐 嫄 , 王 兆 , 趙啟祖 , 王 琴
(1.中國獸醫藥品監察所 國家/OIE豬瘟參考實驗室 , 北京 海淀 100081 ; 2. 洛陽萊普生信息科技有限公司 , 河南 洛陽 471000)
豬瘟在我國為優先防治的重大動物疫病之一。雖然在2017年3月,該病已經正式退出國家的強制免疫計劃[1],但豬瘟疫苗仍然是我國免疫覆蓋率最高的豬用疫苗之一。近年來,市場上不斷有豬瘟抗體檢測試劑盒面世,但仍以傳統的間接或阻斷ELISA方法為主[2],試劑盒的操作便捷性和信號靈敏度等方面并未有明顯的提高。對于各大中型養豬場及各級動物疫病控制中心來說,豬瘟抗體檢測的樣本量大,操作復雜,存在檢測時間長,勞動強度大等問題。另外,傳統ELISA試劑盒多采用TMB底物,信號的線性范圍窄,無法準確區分不同抗體效價的血清,大大影響了試劑盒的檢測效果。
本課題組采用豬瘟病毒E2蛋白單克隆抗體作為競爭抗體,以化學發光底物作為顯色體系,開發了豬瘟病毒化學發光競爭ELISA抗體檢測試劑盒(簡稱:發光試劑盒)。為了評價該試劑盒的臨床應用效果,采用本試劑盒和進口試劑盒同時在6個地區進行了臨床試驗,共檢驗血清樣本2 200份。為了進一步驗證試劑盒檢測結果的準確性,對田間采集的391份血清樣本采用豬瘟抗體檢驗金標準方法-熒光抗體病毒中和試驗(Fluorescent antibody virus neutralisation test,FAVN)進行了定性檢測,評價本試劑盒與FAVN的符合率。另外,采用本試劑盒對5頭免疫豬的抗體消長規律進行了監測,進一步評價本試劑盒對免疫血清的檢測效果。
1 材料與方法
1.1 材料 PK15傳代細胞系、豬瘟病毒Thiverval 株由中國獸醫藥品監察所鑒定、保存并提供;豬瘟病毒E2蛋白單克隆抗體,由中國獸醫藥品監察所制備并提供;FITC羊抗鼠二抗,購自Sigma公司;發光試劑盒,批號為E160602,由洛陽萊普生信息科技有限公司制備;豬瘟病毒抗體檢測試劑盒(簡稱:進口試劑盒),批號為G261,購自IDEXX公司。
1.2 試驗動物 3月齡健康仔豬,未免疫豬瘟疫苗,無豬瘟母源抗體,購自保定山區散養戶。
1.3 血清樣本 臨床血清樣本2 200份,分別由6家地市級動物疫病預防控制中心提供,采自山東、河南、山西省和陜西省;田間采集的豬瘟疫苗免疫和非免疫血清,共計391份。
1.4 試驗方法
1.4.1 臨床血清樣本的檢測 將6家實驗單位提供的2 200份臨床血清樣本,分別用發光試劑盒和進口試劑盒進行檢測,檢測步驟按照試劑盒說明書進行,計算2種試劑盒的一致性。
1.4.2 與金標準方法的比較 將田間采集的391份血清,分別采用發光試劑盒和FAVN方法對血清樣本進行檢測,計算發光試劑盒與FAVN之間的一致性。FAVN試驗具體操作步驟參見《陸生動物診斷試劑和疫苗手冊》[3]。
1.4.3 統計學方法 選擇SPSS統計學軟件計算Kappa值,進行一致性分析,對應Kappa 值為:0.0~0.20極低的一致性、0.21~0.40一般的一致性、0.41~0.60 中等的一致性、0.61~0.80 高度的一致性和0.81~1幾乎完全一致。
1.4.4 對免疫抗體消長的檢測 將試驗豬分為2組。第1組5頭豬,為免疫組,每頭豬免疫1頭份豬瘟活疫苗(傳代細胞源),批號為0907,廣東永順生物制藥有限公司產品;第2組2頭豬,為對照組,每頭豬接種1 mL生理鹽水。分別于免疫之后的第1、3、6、9、12、15、18、21、28、32、39、50、56、63、70、80、112天和第177天采集血清,用發光試劑盒進行檢測,觀察免疫抗體消長趨勢。
2 結果
2.1 對臨床血清樣本的檢測 在臨床檢測的2 200份豬血清樣本中,發光試劑盒檢測出1 452份陽性,748份陰性;進口試劑盒檢測出1 420份陽性,769份陰性,結果見表1。采用SPSS軟件,計算2種試劑盒的Kappa值為0.78,說明發光試劑盒與進口商品化試劑盒具有高度一致性。
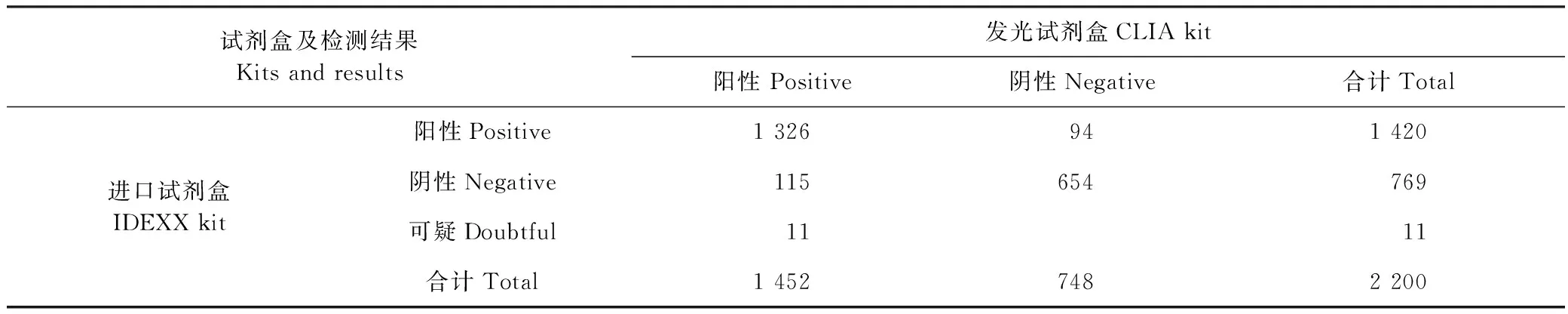
表1 發光試劑盒與進口試劑盒的一致性Table 1 The coincidence of CLIA kit with IDEXX kit
2.2 與金標準方法的比較 在391份血清中,包括豬瘟抗體陽性血清191份,陰性血清200份。其中發光試劑盒檢測出191份陽性,其中182份與FAVN結果一致;檢測出200份陰性,有191份與FAVN結果一致,結果見表2。采用SPSS軟件,計算2種方法的Kappa值為0.908,二者結果幾乎完全一致,說明該試劑盒的檢測結果更接近于金標準方法。
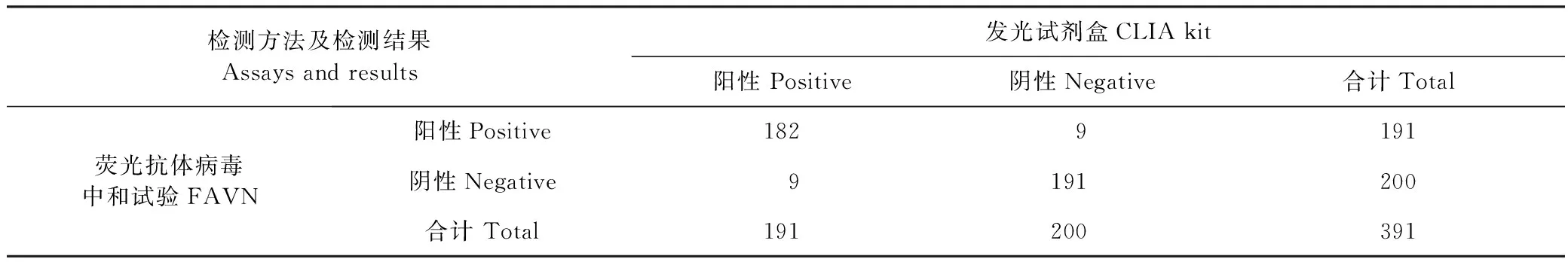
表2 發光試劑盒與FAVN的一致性Table 2 The coincidence of CLIA kit with FAVN
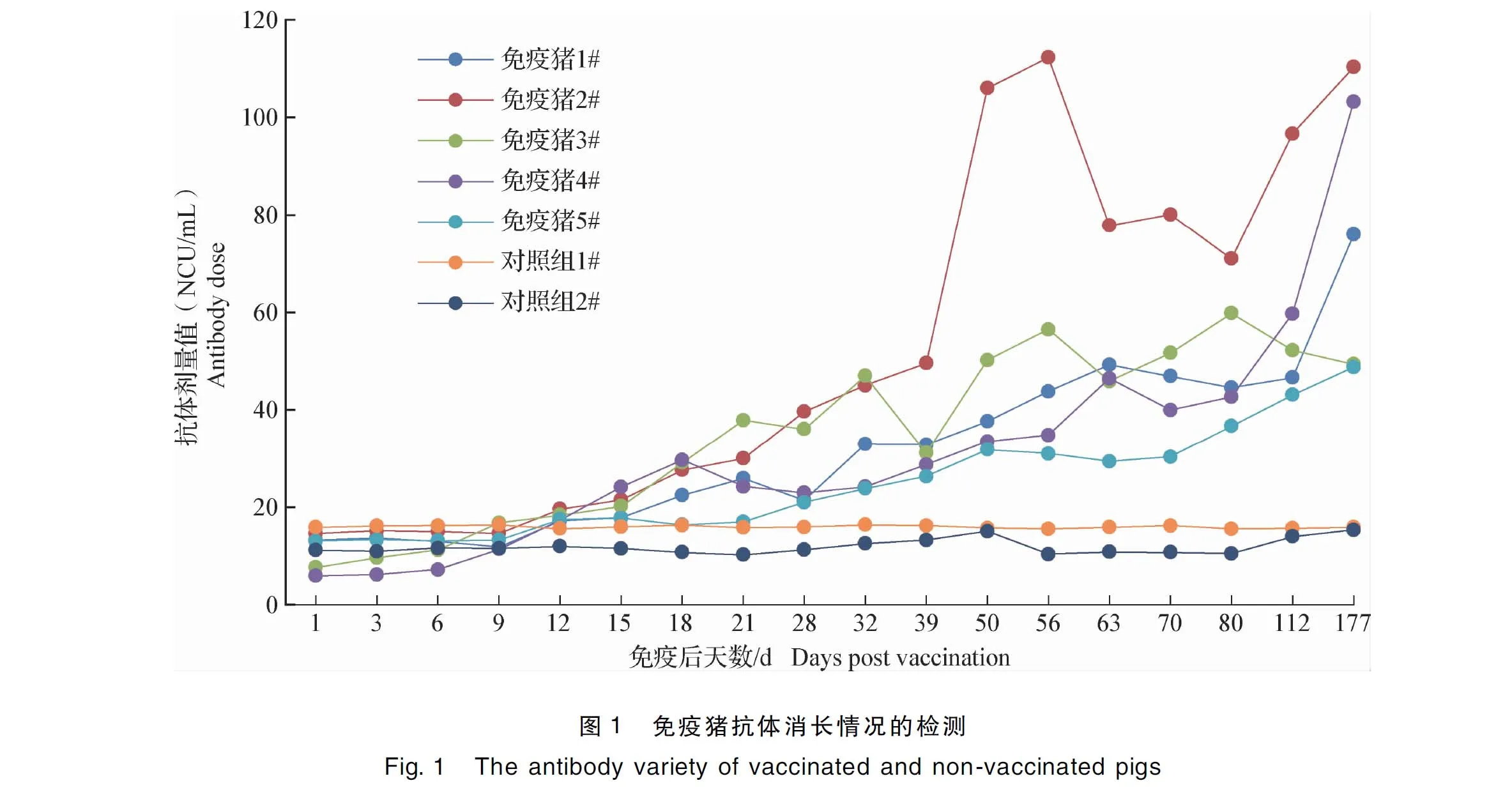
2.3 免疫血清抗體消長規律 從檢測結果可以看出,免疫后15 d,4/5的免疫豬抗體轉陽,免疫后18 d, 全部免疫豬的抗體轉陽。而未免疫對照組直至試驗結束均為抗體陰性。從中插彩版圖1中可以看出,免疫后177 d,5頭免疫豬的豬瘟抗體仍為陽性,且不同個體的抗體水平存在較大差異。
3 討論
ELISA方法檢測到的抗體均為結合抗體,雖然這些抗體能夠與抗原發生特異性結合,但不一定會使病原失去感染性。而中和抗體則不同,與病原結合后,能夠使病原喪失感染宿主細胞的能力。有研究表明[4],疫苗免疫后的陽性血清對不同豬瘟毒株的中和抗體效價不同。在豬瘟疫苗免疫初期,細胞免疫對攻毒保護起了非常重要的作用。而在免疫的中后期,體液免疫在疫苗保護中起了決定作用。因此中和抗體能夠更加準確的反應機體的免疫狀況,更適用于免疫效果評價。有研究者對結合抗體和中和抗體效價進行了比較,證明二者的相關性根據方法不同而有所差異[5-6]。
豬瘟疫苗免疫后,能夠引起體液免疫反應,使機體產生特異性的抗體。豬瘟抗體檢測包括2類,一類為檢測結合抗體的酶聯免疫吸附試驗(ELISA)、正相間接血凝試驗(IHA)、抗體膠體金免疫快速檢測技術[7]、瓊脂擴散試驗以及免疫芯片技術等;另一類為檢測中和抗體的病毒中和試驗。病毒中和試驗是檢測豬瘟抗體的金標準方法,但該方法的操作復雜,檢測時間長,檢測成本高,影響因素多,無法推廣使用。發光試劑盒通過對單克隆抗體的篩選,選擇了1株具有適宜親和力、且具有中和活性的單克隆抗體作為本試劑盒的競爭抗體,減少了檢測步驟,大大縮短檢測時間至1 h以內。通過對2 200份臨床血清的檢測,證明發光試劑盒與進口商品化試劑盒的檢測結果具有高度的一致性,說明本試劑盒的敏感性、特異性等關鍵指標均不低于進口產品。而與金標準方法(FAVN)的比較結果說明本試劑盒的結果與中和抗體效價更為接近。
采用發光試劑盒對免疫后豬血清抗體的消長情況進行檢測,證明在免疫后18 d,所有的免疫血清全部轉為陽性。而在本課題組之前的研究中,免疫豬血清在免疫后15~28 d可全部轉為陽性,與本研究的結果基本一致[8-9],說明本試劑盒的靈敏度不低于現有商品化ELISA試劑盒產品。另外,從結果中可以看出,不同的個體免疫后抗體增長的時間和增長幅度有很大差異,說明個體差異對免疫效果存在很大影響。

