MTA2、HIF-1α和E-cadherin在喉鱗狀細胞癌組織及轉染MTA2siRNA喉癌細胞中的表達觀察
劉玉東,甄娟,韓曉麗,郭明麗
河北省人民醫院,石家莊050051
喉鱗狀細胞癌(簡稱喉癌)是頭頸部腫瘤中最常見惡性腫瘤,其局部浸潤和轉移對治療效果和臨床預后有重要影響,是造成喉癌患者治療失敗和死亡的主要原因。喉癌的轉移受多因素影響,涉及許多因子表達水平變化。近年研究[1]表明,轉移相關蛋白(MTA)家族調節著眾多的細胞通路,這些通路在腫瘤細胞的進展和轉移過程中扮演著重要角色。MTA2通過自身的結構域參與核小體重構及組蛋白去乙酰化阻遏基因的轉錄,進而導致細胞轉化,從而參與細胞增殖分化和轉錄調控過程,同時,MTA2蛋白的增加會造成各種腫瘤細胞的侵襲和轉移[2,3]。低氧誘導因子1α(HIF-1α)在細胞低氧反應中發揮關鍵作用,活化的 HIF-1α在多種腫瘤中高表達,并且與腫瘤新生血管的生成、侵襲及轉移密切相關[4]。細胞間黏附異常所致的腫瘤細胞從原發灶脫落是腫瘤發生侵襲轉移的早期關鍵步驟,上皮鈣黏蛋白(E-cadherin)具有促進上皮細胞間相互黏附、維持上皮組織完整性和上皮極性的功能。研究[5]發現,MTA2通過調節HIF-1α和E-cadherin的表達在胰腺癌細胞增殖和轉移過程中發揮作用。目前,喉癌中MTA2是否通過調控HIF-1α和E-cadherin的表達從而在侵襲轉移中發揮作用仍未明確,2017年5月~2018年12月,本研究觀察了MTA2、HIF-1α、E-cadherin蛋白在喉癌組織中的表達變化,并探討了其與喉癌患者臨床病理參數的關系,同時觀察了在喉癌細胞系中干擾MTA2表達后,HIF-1α和 E-cadherin的表達變化,以明確三者之間的調控關系。
1 材料與方法
1.1 組織、細胞、試劑及儀器 55例份喉癌組織、35例份癌旁喉組織均為河北省人民醫院病理科存檔的石蠟標本,患者術前均未接受放、化療,組織學分級:G1級33例,G2+G3級22例;臨床分期:Ⅰ~Ⅱ期35例份,Ⅲ~Ⅳ期20例份;有淋巴結轉移38例份、無淋巴結轉移17例份。標本的使用均通過了本院倫理委員會審核且患者本人知情同意。喉癌細胞株(Hep-2)購自 ATCC(美國菌種收集中心)(Manassas,VA,USA),用含10%胎牛血清的RPMI1640培養基,在37 ℃、5% CO2的條件下培養。免疫組織化學S-P檢測試劑盒和DAB酶底物顯色試劑盒(福州邁新生物技術公司);MTA2鼠單克隆抗體、HIF-1α鼠單克隆抗體、E-cadherin鼠單克隆抗體及MTA2 siRNA均購自美國Santa Cruz公司,β-actin抗體(北京中杉金橋生物技術有限公司);Lipofectamine 2000(美國Invitrogen公司)。4 ℃低溫離心機(美國sigma 公司),CO2培養箱(上海力申科學儀器有限公司),NanoDrop 2000 紫外分光光度計(美國熱電公司)。
1.2 喉癌組織及癌旁組織中MTA2、HIF-1α、E-cadherin蛋白的檢測 ①采用免疫組織化學染色法:取55例份喉癌組織及35例份癌旁組織,經中性甲醛固定、石蠟包埋,4 μm厚連續切片。按照免疫組織化學S-P檢測試劑盒說明書步驟進行免疫組織化學染色,一抗用PBS緩沖液進行稀釋,稀釋比例分別為MTA2(1∶200)、HIF-1α(1∶200)、E-cadherin(1∶200)。用PBS代替一抗作陰性對照,已知陽性片作陽性對照。結果判定:MTA2及HIF-1α蛋白以細胞核中出現棕黃色顆粒為陽性顯色。E-cadherin蛋白以細胞膜中出現棕黃色顆粒為陽性顯色。按MTA2、HIF-1α和E-cadherin蛋白陽性細胞百分比和細胞著色強度乘積的方法分5級:無陽性細胞計0分、≤10%計1分、11%~50%計2分,51%~80%計3分、>80%計4分;細胞著色強度:無著色計0分、淺黃色計1分、棕黃色計2分、黃褐色計3分。上述兩分值相乘<3為陰性、≥3為陽性。②采用Western blotting法。收集喉癌組織及癌旁組織,加入裂解液,4 ℃靜置24 h,低溫高速離心(4 ℃,12 000 r/min,40 min),提取上清即為總蛋白,Bradford法測定細胞提取物的蛋白濃度。聚丙烯酰胺瓊脂糖凝膠電泳(4%濃縮膠電壓80 V,10%分離膠電壓120 V)、恒壓轉膜,脫脂奶粉封閉2 h,將膜放在含一抗的封閉液中,一抗分別為MTA2(1∶150)、HIF-1α(1∶200)、E-cadherin(1∶200)和抗β-actin(1∶200)4 ℃孵育過夜;與相應二抗室溫下孵育2 h,ECL發光,經自動電泳凝膠成像分析儀采集圖像。分析特異性條帶的光密度值,作為目的蛋白相對表達量。
1.3 喉癌細胞系Hep-2 MTA2siRNA轉染后HIF-1α、E-cadherin蛋白檢測 取喉癌細胞系Hep-2,貼壁生長。細胞接種在含10%胎牛血清的RPMI1640培養液中,在37 ℃、5% CO2環境下培養。待細胞密度達70%左右進行轉染,使用脂質體Lipofectamine 2000將MTA2siRNA導入喉癌細胞系Hep-2中作為轉染組,并設立未轉染組、轉染對照組(轉染非特異性siRNA),實驗重復3次。轉染48 h后收集各組細胞采用Western blotting法檢測MTA2、HIF-1α、E-cadherin蛋白。
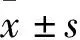
2 結果
2.1 喉癌組織及癌旁正常喉組織MTA2、HIF-1α、E-cadherin蛋白表達比較 喉癌組織中MTA2與HIF-1α呈核表達強陽性,而在癌旁正常喉組織中二者均呈弱陽性或陰性表達;E-cadherin在癌旁正常喉組織中呈膜表達強陽性,在喉癌組織中呈弱陽性或陰性表達。喉癌及癌旁正常喉組織中MTA2蛋白陽性細胞率分別為69.1%、14.3%,HIF-1α蛋白陽性細胞率分別為74.5%、11.4%,E-cadherin蛋白陽性細胞率分別為38.2%、91.4%,兩種組織中MTA2、HIF-1α、E-cadherin蛋白陽性細胞率比較,χ2分別為25.748、30.083、25.049,P均< 0.05。
MTA2蛋白的相對表達量分別為0.95±0.10、0.73±0.07,HIF-1α分別為1.11±0.11、0.56±0.08,E-cadherin分別為0.98±0.12、1.31±0.09,二者MTA2蛋白相對表達量比較,t=-6.811,P=0.000;HIF-1α蛋白相對表達量比較,t=-14.934,P=0.000;E-cadherin相對表達量比較,t=8.416,P=0.000。
2.2 喉癌組織MTA2、HIF-1α、E-cadherin蛋白表達與患者臨床病理參數的關系 喉癌組織中MTA2與HIF-1α蛋白的表達均與喉癌組織學分級、臨床分期及淋巴結轉移呈正相關(P均<0.05),與年齡、性別、腫瘤部位無關(P均>0.05);E-cadherin蛋白的表達與喉癌臨床分期及淋巴結轉移呈負相關(P均<0.05),與年齡、性別、腫瘤部位及組織學分級無關(P均>0.05)。見表1。

表1 喉癌組織中MTA2、HIF-1α及E-cadherin的表達與患者臨床病理學參數的關系(例)
2.3 喉癌組織及細胞系中MTA2、HIF-1α、E-cadherin蛋白之間的關系 喉癌組織中,MTA2和HIF-1α表達呈正相關(r=0.512,P=0.000),MTA2和E-cadherin表達呈負相關(r=-0.608,P=0.000)。
轉染組、轉染對照組、未轉染組MTA2蛋白相對表達量分別為0.42±0.02、0.92±0.04、0.84±0.01,HIF-1α蛋白的相對表達量分別為0.48±0.03、0.87±0.01、0.91±0.01,E-cadherin蛋白的相對表達量分別為0.90±0.04、0.44±0.01、0.51±0.02。與轉染對照組、未轉染組比較,轉染組喉癌細胞中中MTA2、HIF-1α蛋白表達低(t=34.95,P=0.001),E-cadherin蛋白表達高(t=-10.20,P=0.009)。
3 討論
腫瘤轉移相關基因(mta)是近年發現的與腫瘤進展及轉移有關的基因家族,目前確認有mta1,mta2,mta3三類,分別定位于14q32、11q12-q13.1和2p21,Mta2基因編碼的MTA2蛋白包含668個氨基酸,4個不同的結構域:1個BAH 結構域(1~144 AA)、1個ElM2結構域(145~256 AA)、1個SANT結構域(263~315 AA)和1個非典型的 GATA 的鋅指結構域(367~394 AA)。MTA2通過這些結構域參與核小體重構及組蛋白去乙酰化阻遏基因的轉錄,進而導致細胞發生性質的轉化,促使腫瘤細胞發生侵襲轉移[6]。Zhou等[7]研究發現,MTA2在胃癌組織中表達增高,高表達MTA2與腫瘤的浸潤深度、淋巴結轉移、臨床分期呈正相關;抑制MTA2蛋白表達后能夠抑制腫瘤細胞的生長、侵襲和轉移。在胰腺癌組織和胰腺癌細胞系中MTA2 RNA和蛋白表達均高于正常胰腺組織和細胞,高表達的MTA2與胰腺癌患者的較短生存期密切相關,抑制MTA2表達后,能夠抑制胰腺癌細胞的增殖和侵襲能力,相反,過表達MTA2后胰腺癌細胞的增殖和侵襲能力提高。同時體外實驗[5]顯示,將轉染shRNA-MTA2的胰腺癌細胞導入裸鼠體內發現,移植鼠的腫瘤體積和重量均縮小,發生肝和肺轉移的小鼠數量也減少;相反,將轉染MTA2質粒的胰腺癌細胞導入裸鼠體內后,移植鼠的腫瘤體積和重量均增加,發生肝和肺轉移的小鼠增多。這些研究提示MTA2蛋白表達在胰腺腫瘤的發生發展及轉移中起著重要作用,并且與患者的不良預后相關。本研究發現,在喉癌組織中MTA2蛋白的表達量及陽性表達率均高于癌旁正常喉組織,并且與腫瘤的組織學分級、臨床分期及淋巴結轉移有關,提示MTA2蛋白與喉癌的發生及腫瘤轉移相關,這與MTA2在其他組織中作為促癌因子發揮的作用一致,提示其可作為喉癌診斷的生物學標志物,也可作為反映患者病情及預后的指標。
HIF-1是由 HIF-1α和HIF-1β兩個亞基構成的異源二聚體。HIF-1α亞基通過氧依賴起調節作用,HIF-1β亞基呈組成性表達。研究[8~11]報道,HIF-1α在肝細胞癌、胃癌、胰腺癌、宮頸癌等腫瘤中表達升高,提示患者的不良預后。低氧微環境中,HIF-1α表達升高,并且可通過調節血管內皮生長因子(VEGF)促進腫瘤血管生成,從而加速腫瘤細胞的侵襲與轉移[12,13]。HIF-1α還可以通過上調基質金屬蛋白酶MMPs,降解細胞基質成分,以及下調E-cadherin、降低細胞間的黏附力,從而促進腫瘤細胞發生侵襲與轉移[14,15]。E-cadherin作為鈣黏素家族成員,存在于人體內各種上皮細胞的細胞質和細胞膜中,它在維持細胞的極性和完整性方面起著關鍵作用。E-cadherin可特異性地與鈣離子結合發揮黏附作用,其表達水平下降可導致腫瘤細胞黏附功能障礙,進而誘發上皮來源腫瘤細胞發生浸潤及轉移[16]。本研究發現,在喉癌組織中HIF-1α蛋白的表達量和陽性表達率均高于其在癌旁正常喉組織的表達,并且與喉癌組織學分級、臨床分期及淋巴結轉移有關,提示HIF-1α蛋白可能對喉癌的發生起促進作用,并且與腫瘤轉移相關。在喉癌組織中E-cadherin蛋白表達量和陽性表達率均低于其在癌旁正常喉組織的表達,并且與喉癌臨床分期、淋巴結轉移呈負相關,提示E-cadherin蛋白在喉癌進展中可能作為抑癌因子發揮作用,并且可抑制腫瘤轉移。
Zhu等[5]在胰腺癌細胞中的研究發現,敲除MTA2的表達后,E-cadherin表達降低、HIF-1α表達升高;同時HIF-1α過表達能夠上調MTA2的表達,相反,抑制HIF-1α的表達能夠下調MTA2的表達,通過進一步研究發現MTA2與HIF-1α形成一個相互作用的反饋環在胰腺癌細胞增殖和轉移過程中發揮作用。本研究發現,在55例份喉癌組織中,MTA2和HIF-1α蛋白表達呈正相關,MTA2和E-cadherin蛋白表達呈負相關,提示MTA2和HIF-1α及E-cadherin之間可能存在一定的調控關系,為了進一步探討MTA2和HIF-1α及E-cadherin的相互關系,我們用siRNA干擾喉癌細胞系Hep-2中MTA2的表達后發現HIF-1α的蛋白水平隨之下降,E-cadherin的蛋白水平隨之上調,提示MTA2可能通過調控HIF-1α和E-cadherin的表達從而在喉癌發生、侵襲轉移中發揮重要作用。
總之,本研究發現,喉癌組織中MTA2和HIF-1α高表達,E-cadherin低表達;轉染MTA2siRNA喉癌細胞中HIF-1α蛋白表達下調,E-cadherin蛋白表達上調;MTA2、HIF-1α、E-cadherin蛋白可能與喉癌的發生及轉移有關,且MTA2和E-cadherin蛋白之間具有協同作用,MTA2與HIF-1α蛋白之間具有拮抗作用。但是腫瘤的發生發展及轉移是一個多因素、多步驟的過程,本研究只是初步的實驗結果,對于MTA2與HIF-1α和E-cadherin之間具體如何協同作用來調節喉癌發生發展有待進一步探討。

