馬爾尼菲籃狀菌致病機制相關分子研究進展
肖艷萍,鐘橋石,胡龍華
馬爾尼菲籃狀菌是一種重要的條件致病菌,其感染具有一定的地區分布特點,主要見于東南亞、中國、印度等地區[1]。以前多見于HIV感染患者,在有效的抗逆轉錄病毒的作用下,HIV患者感染馬爾尼菲籃狀菌的比例在逐漸減少,而隨著器官移植、造血干細胞移植、免疫抑制劑、新型靶向治療藥物如抗CD20單克隆抗體使用的增多,非HIV感染患者的病例在逐漸增加[2]。馬爾尼菲籃狀菌感染患者如未能及時接受抗真菌治療往往預后不良,甚至死亡[3]。本文就目前馬爾尼菲籃狀菌相關致病機制及調控基因的研究進展進行綜述。
1 馬爾尼菲籃狀菌的雙相性轉變及相關信號通路傳導
馬爾尼菲籃狀菌是一種雙相真菌,其表現出溫度依賴雙相性生長——25 ℃時的菌絲相和37℃時的酵母菌相。目前,研究認為雙相性的轉變是菌體逃避宿主免疫反應的一種應答機制。當馬爾尼菲籃狀菌暴露于25 ℃的外界環境中時,霉菌菌絲分化可產生無性孢子(分生孢子),分生孢子被吸入患者肺內后可被宿主先天免疫細胞識別,繼而引起宿主對外來物質的殺傷作用。對于普遍的真菌病原體來說,當真菌進入宿主肺內,真菌細胞壁上含有一種特殊成分稱為病原相關分子模式(pathogen-associated molecular patterns, PAMPs),其可被先天性免疫細胞(如巨噬細胞)膜上的膜相關模式識別受體(pattern recognition receptors, PRRs)識別并驅動下游細胞內信號通路,引起多種細胞免疫反應,如吞噬作用、細胞因子的產生、炎性物質的激活、活性氧的產生來破壞真菌細胞[4]。而對馬爾尼菲籃狀菌來說,它可在吞噬細胞內的存活并有效隔絕宿主其他免疫成分從而有效逃避宿主的防御反應。在這個過程中,馬爾尼菲籃狀菌雙相性的轉變——從多細胞的菌絲形態轉變成單細胞的酵母形態,是保護其在吞噬細胞內存活的重要機制。它可有效避免在被吞噬細胞吞噬后因菌絲生長時間過長而導致細胞破裂,繼而暴露于宿主的免疫系統中[6]。此外,還有研究發現,雙相性真菌的酵母相和菌絲相細胞壁PAMPs成分存在差異,可引起不同的炎癥反應[4]。酵母相真菌常常缺失了部分菌絲相細胞壁PAMPs,這幫助了酵母相細胞在吞噬細胞的存活[4]。而在這些過程中,馬爾尼菲籃狀菌具有的復雜的信號傳導機制以及抗吞噬細胞殺傷作用是保證其在吞噬細胞的存活的關鍵。其中這些信號通路包括雙組分系統、異三聚體蛋白系統(G蛋白系統)、Ras信號系統以及下游絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信號級聯系統(見圖1),但這些信號通路調控馬爾尼菲籃狀菌在吞噬細胞的存活的機制目前尚不清楚。
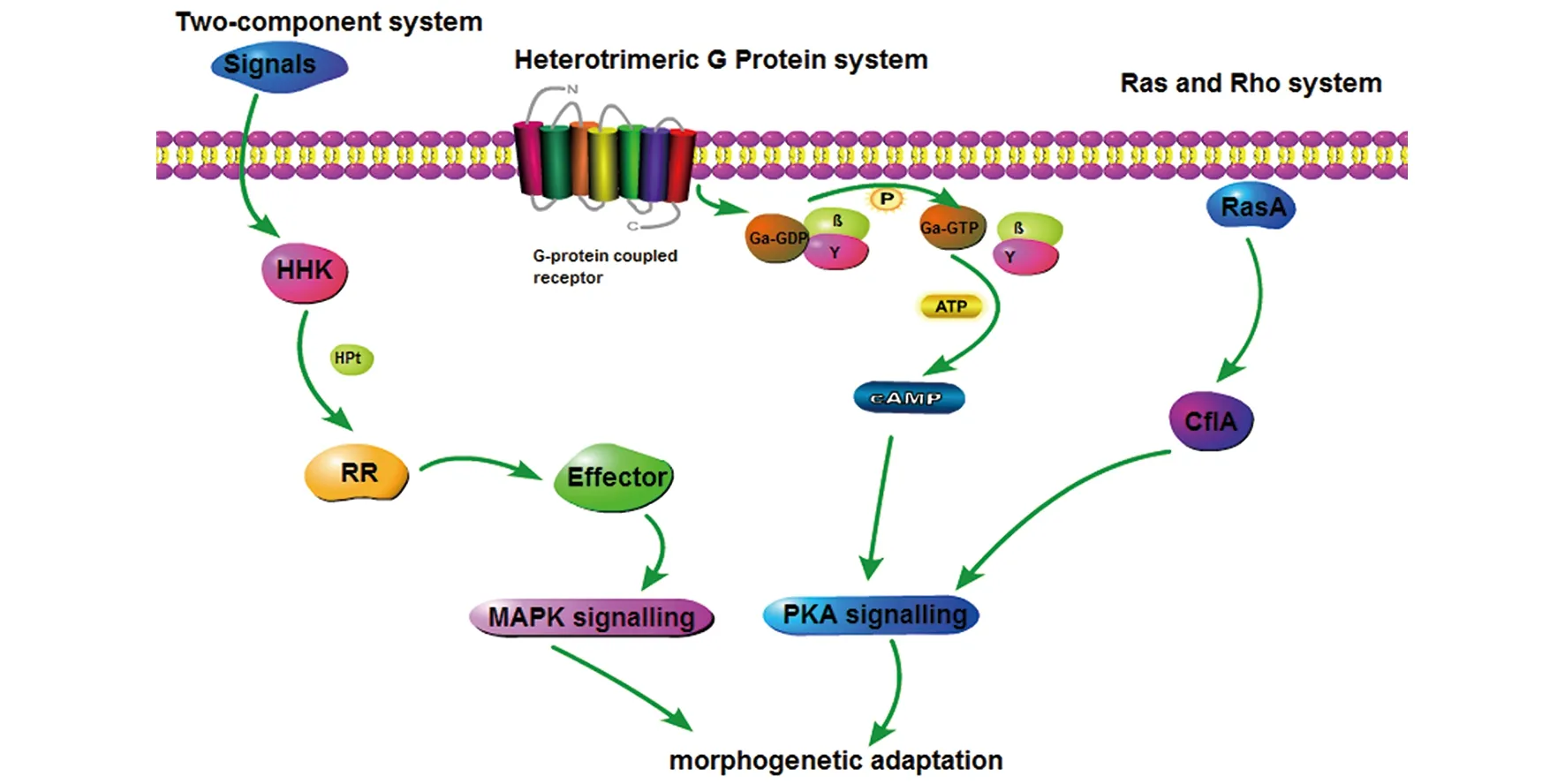
雙組分信號傳導系統是HHK接受環境刺激后產生磷酸化,然后將磷酸基團傳遞給RR,RR可激活MAPK通路進而調節馬爾尼菲籃狀菌雙相性的轉變;G蛋白系統是當接受外來刺激后,G蛋白中的α亞基發生磷酸化Gα-GTP復合物,G蛋白解離成Gα-GTP及Gβγ亞單位,Gα-GTP可通過激活PKA通路調節馬爾尼菲籃狀菌形態的轉變;Ras、Rho GTP酶及其信號通路是馬爾尼菲籃狀菌中的Ras GTP酶RasA可以激活Rho GTP酶CflA,隨后通過cAMP/PKA通路調節細胞的極化生長及細胞分裂。圖1 馬爾尼菲籃狀菌雙相性轉變相關信號通路[1,5]Fig.1 Signalling pathways controlling dimorphic switch of Talaromyces marneffei
1.1雙組分信號傳導系統 雙組分信號系統在馬爾尼菲籃狀菌雙相性轉變中發揮重要作用,當外界環境發生改變時,馬爾尼菲籃狀菌產生不同的信號導致形態的轉變以適應環境變化。在細菌中,主要存在組氨酸蛋白激酶(histidine kinase, HK)接受外周環境變化及響應調節蛋白(response regulator, RR)。HK通過感知環境變化并發生磷酸化,將磷酸化信號傳遞給RR受體,繼而直接調節基因表達或激活MAPK通路。而在真菌中,HK和RR融合成為雜合HK (hybrid histidine kinase, HHK),并且通過磷酸轉移蛋白(phosphotransfer protein, HPt)和第二RR發生磷酸化,從而介導基因表達或激活信號通路。在釀酒酵母菌中,分別存在由SLN1和YPD1編碼的HHK和HPt,以及由SSK1和SKN7編碼的第二RR,構成Sln1-Ypd1-Skn7系統,其可分別因氧化應激及滲透壓的改變而激活,繼而啟動MAPK通路。而在其它真菌中,具有多種HHKs(包括11類)來感受不同環境的變化[5]。在馬爾尼菲籃狀菌中,目前已發現存在兩類HHKs,即DrkA及SlnA,兩者的缺失都會導致對滲透壓的敏感性增加,并通過調節SakA磷酸化水平來調節HOG-MAPK通路[6]。研究表明,drkA的缺失會使細胞壁中的幾丁質分布異常并增加對細胞壁結合劑的敏感性,破壞細胞壁的完整性,同時drkA基因可明顯促進無性繁殖及酵母細胞的生長[7]。而slnA的突變可抑制吞噬細胞內的分生孢子的萌芽,從而影響分生孢子向酵母細胞的轉變[6]。此外,sakA突變體使分生孢子不能轉變為酵母相形態,提示sakA也參與了37 ℃酵母相的轉變[8]。這些因素都有可能對馬爾尼菲籃狀菌的致病潛能造成重要影響。
1.2G蛋白系統 在馬爾尼菲籃狀菌中,分生孢子是感染的繁殖體,隨著溫度的改變,分生孢子萌發產生不同的形態。分生孢子在轉變成酵母細胞的過程中,分生孢子通過極性生長形成關節孢子,并逐漸延伸,最后裂變成酵母細胞[9]。因此,分生孢子的極化萌發是決定其致病性的關鍵因素。研究表明,G蛋白系統在眾多真菌分生孢子的形成、形態的改變及對氧化應激的適應等方面發揮重要作用。當接受外來刺激時,G蛋白α亞基發生磷酸化形成Gα-GTP復合物,導致G蛋白三聚體結構解離為Gα-GTP及Gβγ2個亞單位,它們分別激活不同的效應蛋白,引起真菌對外界環境的適應性改變。Zuber等[10]發現馬爾尼菲菌中GasA(編碼G蛋白α亞基)的缺失會產生厚的氣生菌絲及真菌分生孢子的減少,對真菌的無性發育產生負性影響。同時,Zuber等[11]還發現另一種編碼G蛋白α亞基的GasC基因具有類似GasA基因作用,負性調節馬爾尼菲籃狀菌的無性發育,GasC的缺失還會影響馬爾尼菲籃狀菌的出芽速度。
1.3Ras、Rho GTP酶及其信號通路 細胞的極化在馬爾尼菲籃狀菌形態轉變過程中發揮了重要作用。而其中肌動蛋白在細胞骨架的構建及細胞極化中極為關鍵。Ras和Rho GTPases是肌動蛋白構建細胞骨架中的關鍵調節因子[1]。馬爾尼菲籃狀菌Ras和Rho GTPases家族中的ClfA、RasA在37 ℃酵母細胞的形態改變以及25 ℃時菌絲形態的形成中發揮重要作用[1],而ClfB則影響該菌無性期發育和菌絲相生長,但不影響酵母細胞生長[12]。
2 在吞噬細胞內的存活及免疫逃避機制
馬爾尼菲籃狀菌侵入人體的第一步是通過吸入環境中的分生孢子進入肺部,并通過纖維連接蛋白、層粘連蛋白、硫酸軟骨素、肝素和高度硫酸化的殼聚糖[13]等各種細胞外基質結合附著在支氣管肺泡上皮細胞。吞噬細胞作為抵抗真菌感染的首要防線,可吞噬侵入的微生物并產生殺傷作用(包括吞噬體的形成、細胞內pH的調節、營養物質的限制等)。當馬爾尼菲籃狀菌被吞噬細胞吞噬后,其可通過色素的合成、超氧化物歧化酶、過氧化氫酶-過氧化物酶、熱休克蛋白等多種機制抵抗吞噬細胞的氧化應激反應,從而使馬爾尼菲籃狀菌在吞噬細胞中存活并導致巨噬細胞裂解,繼而引起播散性感染[14]。
馬爾尼菲籃狀菌具有yapA基因可編碼Yap1類似物轉錄因子YapA。在釀酒酵母中,亮氨酸拉鏈蛋白家族中的Yap1是氧化應激反應的中樞調節器。細胞通過嚴格的調節機制調節細胞內過氧化物及其他活性氧的濃度。當細胞內活性氧濃度增高時,Yap1可在氧化應激條件下被激活。而Yap1功能的缺失將導致細胞對氧自由基的敏感度增高,同時導致超氧化物歧化酶、葡萄糖-6-磷酸脫氫酶、谷胱甘肽還原酶活性降低,引起細胞損傷[15]。馬爾尼菲籃狀菌中也具有Yap1的類似物YapA,Wiyada Dankai等[16]發現YapA的突變會導致發芽以及產孢的延遲,提高氧化應激反應的敏感性,從而導致真菌在吞噬細胞內存活率降低。這間接反映yapA基因參與了抗吞噬細胞的殺傷作用。
3 代謝合成相關的編碼基因
3.1與黑色素合成相關的基因 黑色素是一類廣泛存在于微生物中的一類特殊的色素,是真菌的一個重要的毒力因子,同時也為真菌的存活提供重要的保護作用。馬爾尼菲籃狀菌也分泌黑色素,并在馬爾尼菲籃狀菌的致病性和存活方面發揮重要的作用。研究發現,黑色素具有對抗各種非特異性壓力(例如紫外線、氧化劑、酶裂解、極端高溫和低溫下)、清除氧自由基保護真菌免受由氧或氮衍生的自由基介導的損傷、調節免疫細胞因子水平及增強真菌對藥物的抵抗性等作用[17-18]。
黑色素可根據其合成途徑的不同可分為DOPA-黑色素和DHN-黑色素,目前認為馬爾尼菲籃狀菌既可通過DOPA途徑,也可通過DHA途徑合成黑色素[19-20]。在多種真菌中發現,黑色素的合成涉及多個基因簇,其中包括聚酮化合物、柱孢還原酶、羥基萘還原酶、多銅氧化酶、漆酶合成相關基因等[21]。在馬爾尼菲籃狀菌中也發現PKS合成相關基因及編碼漆酶的基因參與黑色素的合成,PKS催化丙二醇CoA或者乙酸轉化1,3,6,8-THN,漆酶在1,8-DHN轉化為黑色素中起關鍵作用[20],相關基因的突變可影響黑色素的合成。Woo等[22]發現敲除參與PKS合成的alb1基因的突變株合成的黑色素明顯減少,且其感染小鼠的存活率明顯高于野生株。同時,編碼漆酶的pbrB基因的缺失同樣會引起黑色素合成的減少。
3.2磷脂酶 細胞外磷脂酶作為一種可有效分解細胞膜脂質成分并裂解細胞膜的物質已被廣泛證實可作為病原菌的一種通用毒力因子。磷脂酶是一類可水解甘油磷脂中一個或多個酯鍵的酶,根據其水解不同酯鍵的能力,可將磷脂酶分為磷脂酶A、B、C、D。在微生物侵入宿主過程中,裂解宿主細胞膜或破壞宿主細胞膜的功能是微生物突破進入宿主細胞內的必要環節,而磷脂酶可有效分解細胞膜的脂質成分導致細胞膜的損傷和裂解。這一功能是磷脂酶被認為細菌和真菌的重要毒力因子的重要原因。而在白色念珠菌、新生隱球菌、煙曲霉等的研究都證實了磷脂酶與真菌的致病性密切相關[23]。Yan He等[23]研究表明細胞內磷脂酶B在馬爾尼菲籃狀菌酵母相(致病相)中表達明顯高于菌絲相,同時證明了磷脂酶B在馬爾尼菲籃狀菌的致病性中發揮積極作用。雖目前尚無證據表明磷脂酶在馬爾尼菲籃狀菌致病機制中的作用,但可作為未來進一步研究方向。
3.3其他聚酮類化合物合成相關的編碼基因 聚酮化合物是微生物廣泛合成的次級代謝產物,包括色素、抗生素及真菌毒素等;其生物活性多樣,可為微生物在宿主內存活提供生存優勢。除了黑色素外,其他聚酮化合物也與馬爾尼菲籃狀菌的致病性密切相關。這類化合物的生物合成過程均產生含有多個酮基的中間產物,聚酮合酶(Polyketide synthase, PKS) 是催化這類中間產物合成的關鍵酶。其中馬爾尼菲籃狀菌的黃色素是由絲紅醇及絲紅酸組成,分別由PKS-11和PKS-12基因編碼合成。其突變體產生的黃色色素明顯低于野生型,且野生菌株在吞噬細胞的存活率高于突變株,表明由PKS催化合成的絲紅醇及絲紅酸可增強馬爾尼菲籃狀菌在巨噬細胞內存活率[24]。
4 MP1p蛋白及相關編碼基因
MP1p是一種由MP1基因編碼的細胞壁表面的甘露糖蛋白,曾作為一種免疫性抗原,用于馬爾尼菲籃狀菌感染的檢測。但最新研究發現,MP1p是馬爾尼菲籃狀菌一種新的毒力因子,其在宿主體內的免疫應答中發揮重要作用[25]。MP1p共有462個氨基酸殘基,包含3個結構域,分別為脂質結合域1(Mp1p-LBD1)、脂質結合域2(Mp1p-LBD2)及C-羧基末端富含絲氨酸和蘇氨酸的區域[25]。Woo等[26]分別用含有MP基因、MP1互補基因、MP1敲除的馬爾尼菲籃狀菌菌株感染Balb/c小鼠,發現MP1的表達量與菌體在小鼠巨噬細胞的存活率呈現正相關。Kong-Hung Sze等[25]進一步研究發現Mp1p-LBD2是一種具有長疏水中心的5螺旋結構束狀單體,對花生四烯酸(arachidonic acid, AA)具有極高的親和力,可以捕獲并封閉1-2個AA,使細胞內AA水平減少,進而抑制下游AA代謝產物及促炎性因子IL-6和TNF-a的釋放,最終降低機體的炎癥反應。
5 展 望
馬爾尼菲籃狀菌是一種雙相真菌,具有區別于其他真菌的致病機制及機體相對應的防御機制。本文從分子層面回顧了馬爾尼菲籃狀菌致病機制,著重綜述了菌體雙相性轉變的相關信號通路及可能調控基因,馬爾尼菲被吞噬細胞吞噬后氧化殺傷的分子應答,以及其他致病毒力因子。馬爾尼菲籃狀菌首先通過相變的發生逃避宿主對一般真菌識別殺傷從而進入人體;其次在吞噬細胞中馬爾尼菲籃狀菌通過黑色素的產生以及一些代謝產物的形成的方式來逃避吞噬細胞的殺傷作用。此外,馬爾尼菲籃狀菌分泌了一種特殊的糖蛋白—Mp1p蛋白,這是一種新的毒力因子,其可通過捕獲一種關鍵的脂質促炎因子以逃避宿主的先天性免疫防御,可為日后研究真菌如何逃脫宿主免疫提供新的見解及方法。但關于雙相性轉變的關鍵啟動因子及其相關復雜網絡的調控,以及躲避宿主免疫應答的具體機制,目前尚無明確定論,有待進一步研究。
利益沖突:無
引用本文格式:肖艷萍,鐘橋石,胡龍華.馬爾尼菲籃狀菌致病機制相關分子研究進展[J].中國人獸共患病學報,2020,36(1):70-74. DOI: 10.3969/j.issn.1002-2694.2019.00.190

