基于網絡藥理學對山楂治療非酒精性脂肪肝病主要活性成分及潛在靶點分析?
林道斌,楊 華,程亞偉
(海南省中醫院脾胃肝病科 海口 570000)
非酒精性脂肪性肝病(NAFLD)是指排除酒精性因素及其他明確肝損害因素外,以甘油三酯為主的脂肪類物質在肝細胞中異常堆積為主要病理特征的一種肝臟代謝疾病[1]。大量脂肪類物質在肝臟的蓄積極易誘發肝細胞脂肪變性及炎癥反應,致使肝纖維化形成,最終將導致肝臟惡性病變的發生[2]。流行病學調查表明,NAFLD在我國的發病率約為15%[3],積極發掘治療NAFLD的藥物已刻不容緩。
山楂為常見的藥食兩用類藥物,有文獻表明對NAFLD有著良好治療效果[4]。山楂提取物山楂總黃酮能從抗氧化應激[5]、促進肝臟脂質代謝[6]、抗血小板聚集[7]等多個方面對NAFLD產生治療作用。目前關于山楂的中藥藥理學研究多從單個成分展開,與中草藥多成分、多靶點發揮功效的實質相悖。因此課題組運用網絡藥理學[8]方法,研究山楂治療NAFLD的作用機制,并為進一步試驗室研究提供先導信息。
1 材料與方法
1.1 山楂主要活性成分及作用靶點篩選
中藥系統藥理學分析平臺(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)是由西北農林科技大學依托文獻挖掘和數據庫整合建立的中藥系統藥理學數據庫和分析平臺。該數據庫收錄了500 味常用中藥以及30069 個中藥化合物的藥物化學和藥物-靶標蛋白網絡-疾病網絡、藥物代謝動力學的基本信息[9],是目前研究網絡藥理學最常用的的數據庫。通過該數據庫檢索山楂的所有活性成分,再根據口服利用度(OB)≥30%和類藥性(DL)≥0.18進一步篩選藥物的主要活性成分,OB和DL是評判藥物有效利用度的關鍵指標。一般而言,OB≥30、DL≥0.18的活性成分可視為藥物的主要活性成分[10]。再通過TCMSP檢索各個活性成分的作用靶點蛋白,然后利用Uniprot數據庫[11]將獲取的蛋白名稱轉換為基因名。
1.2 疾病靶點的獲取與交集靶點的篩選
運用gene cads數據庫(https://www.genecards.org/)[12]、人類孟德爾遺傳綜合數據庫(OMIM) (http://www.omim.org/)[13]和治療靶點數據庫(TTD) (http://bidd.nus.edu.sg/group/cjttd/)[14]尋找NAFLD的疾病靶點建立數據集,并與1.1篩選出的藥物靶點進行vnne分析,獲取交集靶點。
1.3 活性成分-靶點網絡的建立
運用Cytoscape3.6.1軟件[15]建立活性成分-靶點的相互作用網絡關系圖,再通過Network Analysis插件分析各個節點的度值(Dgree),根據網絡節點的Dgree大小做進一步分析。
1.4 京都基因與基因組百科全書通路注釋分析
最后再將1.2獲取的交集靶點導入DAVID在線平臺(https://david.ncifcrf.gov/)[16]行GO、KEGG功能注釋和富集分析。在DAVID平臺,基因標識符合選擇OFFICIFAL-GENE-SYMBOL,基因背景欄勾選HomoSapiens,然后選擇“Functional Annotation Tool”作為分析工具,所有檢取結果根據FDR(錯誤發現率)<0.01進行篩選。
2 結果
2.1 活性成分及藥物靶點篩選結果
在TCMSP數據庫并無山楂常用藥用部位果肉的條目,但有山楂葉相關條目。后通過檢索文獻[17]山楂葉活性成分與果肉相似,并常作為代用品使用。故以TCMSP數據庫中山楂葉活性成分作為研究對象,并根據OB≥30%和DL≥0.18作為條件共檢索到6種主要活性成分,分別是槲皮素(quercetin)、山柰酚(kaempferol)、異鼠李素(isorhamnetin)、豆甾醇(Stigmasterol)、表兒茶素(ent-Epicatechin)、谷甾醇(sitosterol)等。藥物靶點共檢索到279個,去重保留唯一值后有194個,6種活性成分均有各自的作用靶點。
2.2 交集靶點篩選結果與活性成分-靶點網絡的建立
以NAFLD的英文全稱non alcohol fatty liver disease為關鍵詞,在genecads數據庫共找到3538個相關靶點基因,OMIM數據庫找到202個,TTD數據未發現相關靶點。上述靶點去重保留唯一值后共獲得NAFLD靶點基因3645個,與2.1經Uniprot數據庫校正過基因名的靶點進行vnne分析后,確定了148個山楂治療NAFLD發揮作用靶點(見圖1)。而后將這148個靶點與其對應的活性成分導入Cytoscape3.6.1軟件后,建立一個各個節點聯系密切的相互作用網絡關系圖(見圖2)。在該圖中共有154個節點,綠色三角形的活性成分節點有6個,紅色圓形的靶點節點有148個。本研究還運用Cytoscape 中的Network Analysis-Analyze Network插件對該網絡圖中的每個節點進行分析,得到網絡中各個節點的度值(Degree),槲皮素、山柰酚、異鼠李素、豆甾醇等4個活性成分節點Degree明顯高于表兒茶素和谷甾醇(見表1),這也意味著這4種活性成分在山楂治療NAFLD過程中占有重要地位。靶點方面,Degree均值約等于1,有48個靶點節點Degree高于均值(見表2),這些靶點可能是山楂治療NAFLD的關鍵調控靶點,Degree均值最高的10個靶點分別是前列腺素G/H合酶1(PTGS1)、前列腺素G/H合酶2(PTGS2)、過氧化物酶體增殖物激活受體(PPARG)、雄激素受體(AR)、一氧化氮合酶(NOS3)、二肽基肽IV(DPP4)、絲氨酸蛋白酶1(PRSS1)、凝血因子VII(F 7)、單胺氧化酶B(MAOB)、轉錄因子P65(RELA)。
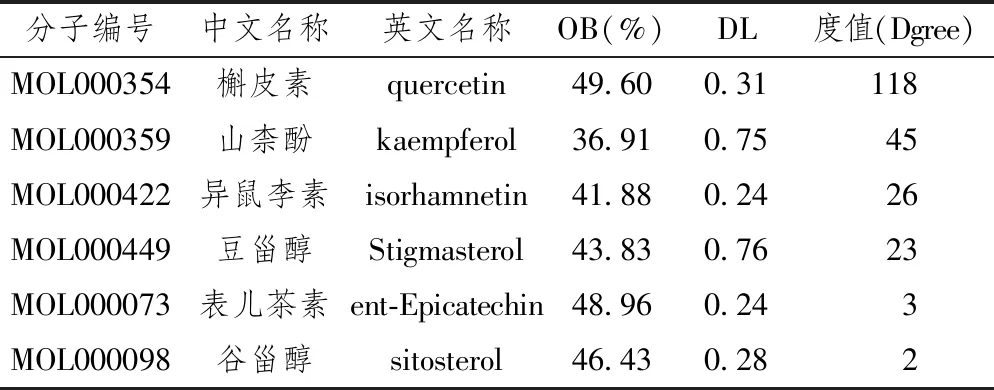
表1 活性成分-靶點網絡中活性成分關鍵節點拓撲學性質

表2 在活性成分-靶點網絡中高于靶點均值的基因比較
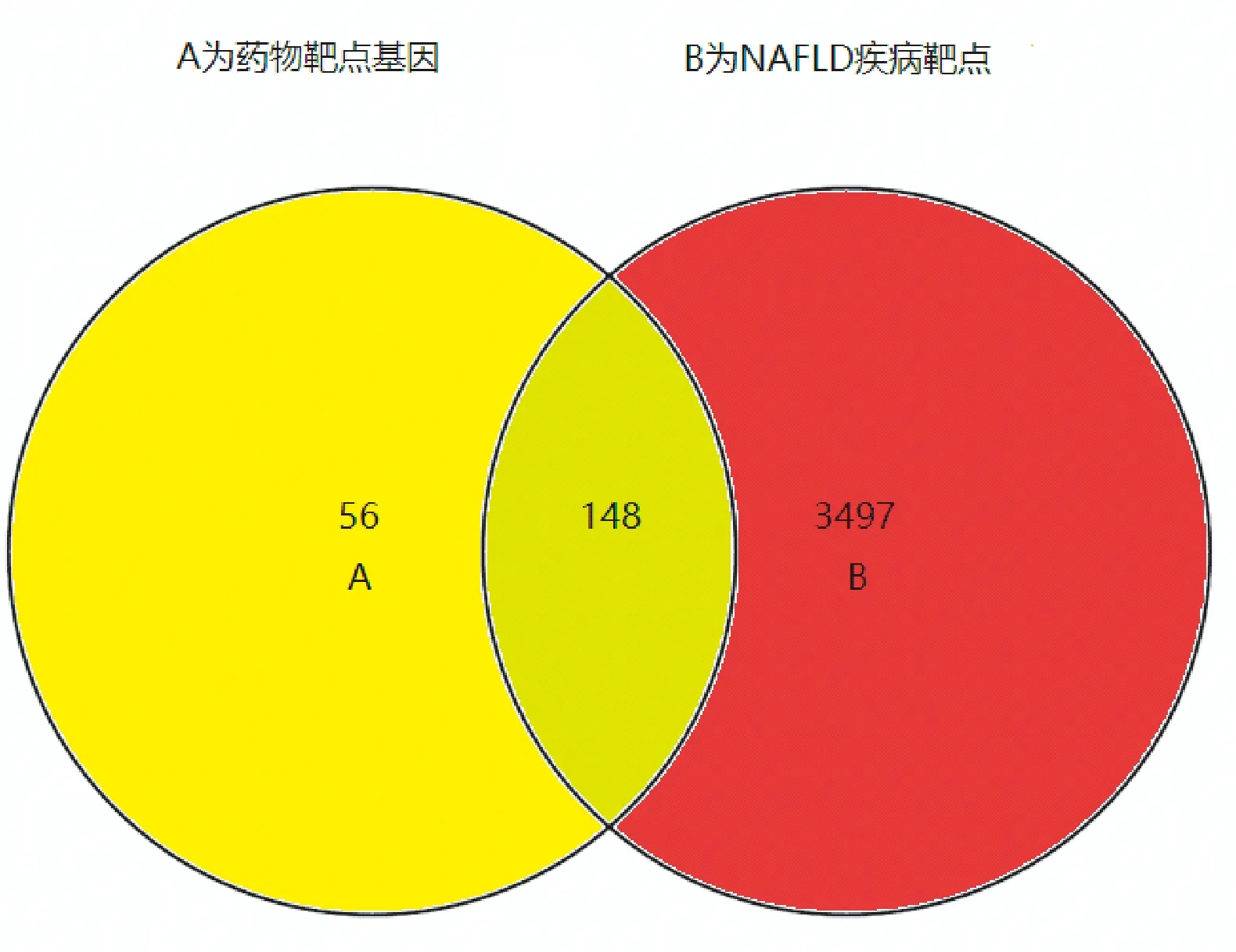
圖1 藥物靶點與HAG疾病靶點vnne分析圖
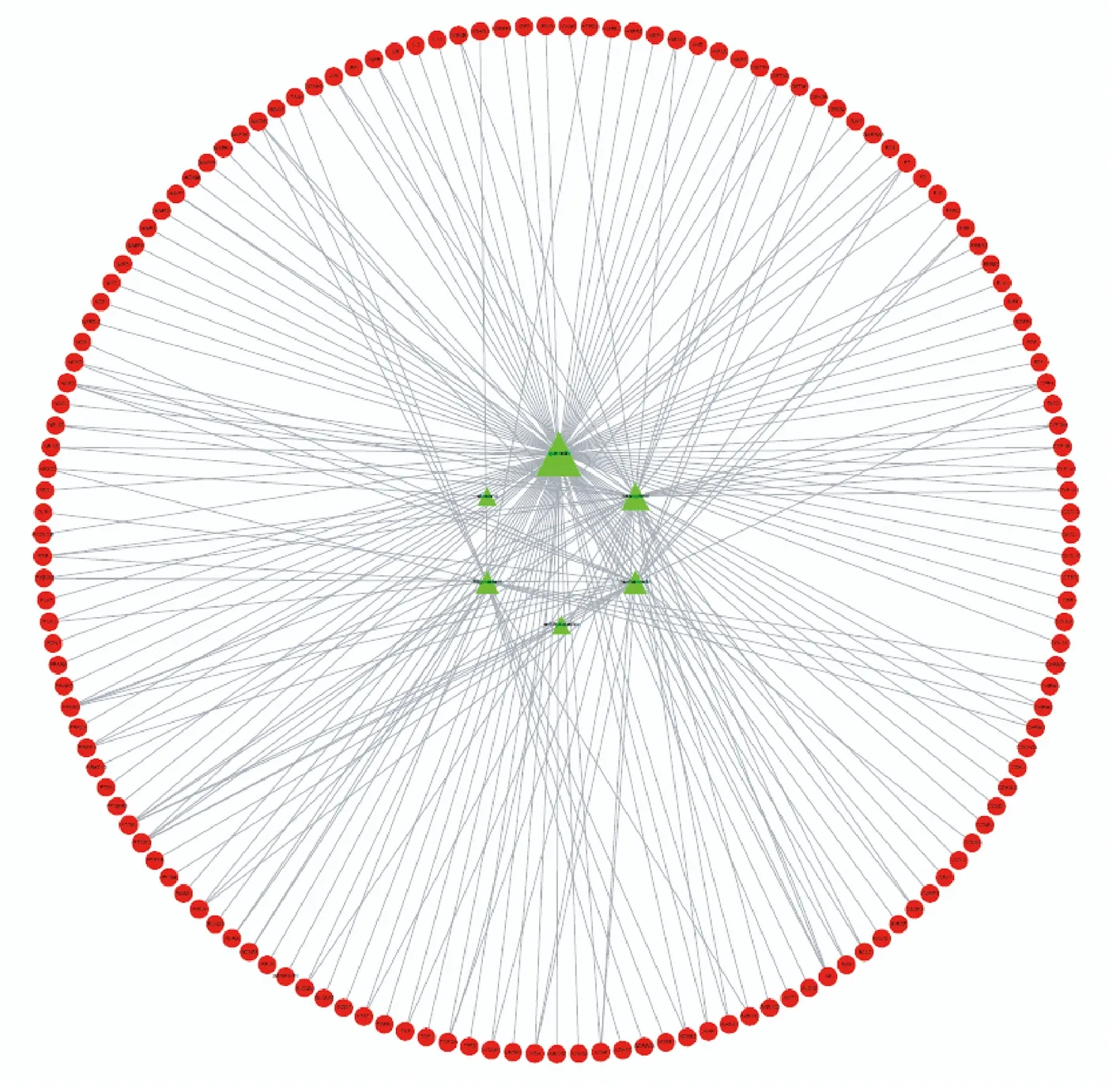
圖2 活性成分-靶點相互作用網絡關系圖(節點大小與Degree成正比)
2.3 GO功能注釋及KEGG通路富集分析結果
利用DAVID平臺的GO和PATHWAY富集分析功能對148個靶點進行研究,GO富集分析中根據FDR<0.01確定350條GO條目,涉及生物過程的有260條,如對藥物反應、轉錄正調節、RNA聚合酶II啟動子轉錄的正調節等。涉及分子功能的有60條,如酶結合、蛋白質結合、RNA聚合酶II轉錄因子活性等。涉及細胞組成的有30條,如細胞外空間、細胞質、膜筏等。同時根據FDR<0.01共找到97條作用通路,如癌癥通路、TNF信號通路、HIF-1信號通路等(表3表4分別列舉了FDR最小的前20條GO和KEGG通路分析結果)。

表3 潛在靶點的GO分析結果比較(FDR<0.01)

表4 潛在靶點的KEGG分析結果比較(FDR<0.01)
3 討論
本研究共發現6種主要活性成分及148個作用靶點,其中Degree值最高的4種主要成分里,槲皮素能通過抑制炎癥因子表達[18]、抗氧化應激反應[19]、改善胰島素抵抗[20]及脂代謝紊亂[21]等諸多途徑對NAFLD產生治療作用。另一化合物山柰酚也有類似抗炎[22]和抗氧化[23]作用,異鼠李素可以抑制膠原蛋白的形成[24]、抗肝纖維化,并且可以抑制PPARγ的表達,防治肝脂肪變性[25]。豆甾醇可以提高過氧化氫酶、超氧化物歧化酶、谷胱甘肽的表達[26]以及降低過氧根離子的生成速率,清除肝內氧自由基,降低肝脂肪過氧化[27]
靶點方面,前10個靶點分別為PTGS1、PTGS2、PPARG、AR、NOS3、DPP4、PRSS1、F7、MAOB、RELA等。其中前列腺素G/H合酶1(PTGS1)和前列腺素G/H合酶2(PTGS2)又稱環氧化酶(COX1/2)[28]是將花生四烯酸轉化為前列腺素的關鍵性限速酶[29],COX1為結構型同工酶,COX2為誘導型同工酶[30]。COX1廣泛分布于人體的組織臟器如胃、腎、血管等,對調節胃、腎的血流量、血管舒張、胃黏液分泌起重要作用,維持著機體的正常生理過程[31]。但COX1在NAFLD的疾病過程中扮演的角色目前鮮有報道,研究主要集中在另一種亞型COX2上。
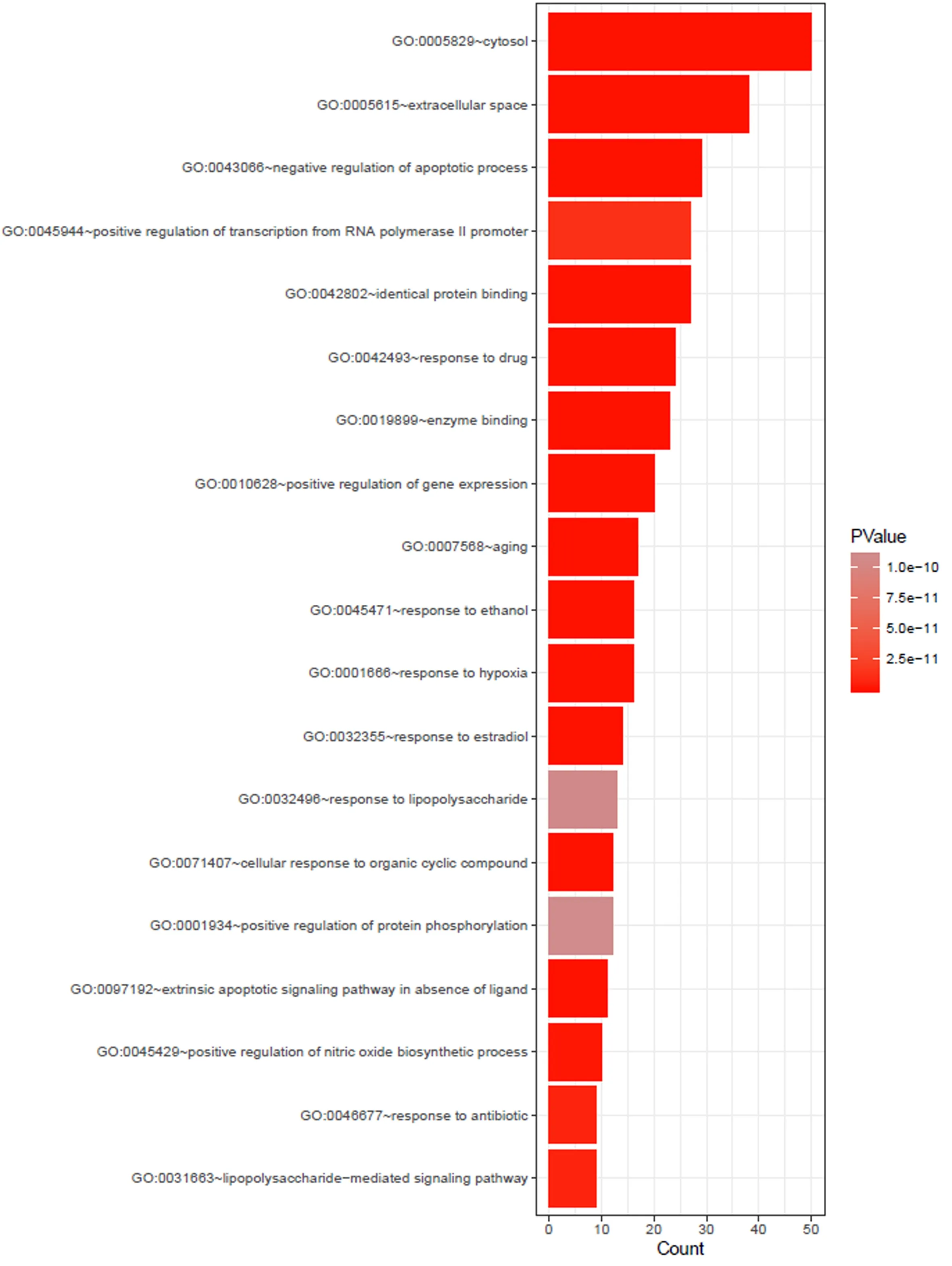
圖3 潛在靶點的GO分析結果條形圖(FDR<0.01)
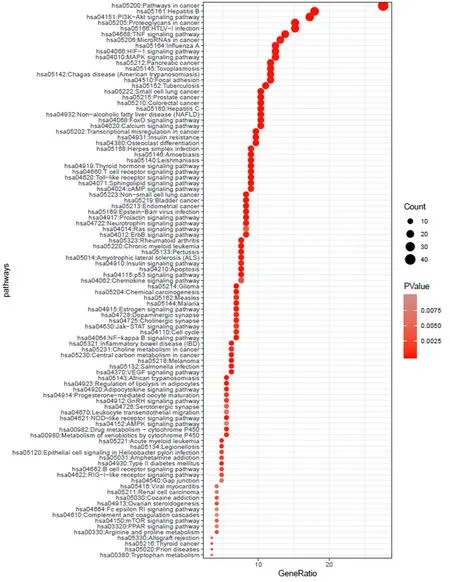
圖4 97條KEGG分析結果氣泡圖(FDR<0.01)
COX2在正常細胞中的表達水平很低,但在刺激因子如炎癥介質、內毒素等作用下會急劇上調,通過調高前列腺素的合成參與機體的炎癥反應[32]。有報道稱[33],COX2的表達水平與肝功能損傷程度成比。在NAFLD早期由于肝細胞脂肪變性可誘導COX2的高表達[34],而COX2及其介導產生的白介素-6、腫瘤壞死因子-α、前列腺素等又會干擾正常的肝細胞脂質代謝過程[35],從而形成惡性循環。結合目前研究,山楂可能通過作用于環氧化酶靶點控制炎癥反應,恢復肝臟正常脂質代謝。
過氧化物酶體增殖物激活受體(PPARG) 是一類由配體激活的轉錄因子,目前已發現有3種亞型PPARα、PPARβ、PPARγ等[36]。其中由PPARG編碼的PPARγ如果過度表達,可抑制環磷酸腺苷反應元件與蛋白的結合,誘導肝脂肪細胞變性[37],進而演變為非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。但值得注意的是,如果敲除小鼠PPARγ基因反而會促進NASH的形成[38]。更有研究顯示[39],PPARγ可以調高脂聯素的表達,控制炎癥因子的分泌,延緩肝纖維化進程。并且PPARγ還可以增加肉毒堿脂酰轉移酶以及乙酰輔酶A的表達減少肝脂肪沉積[40]。總的來說,PPARγ既可以加速NAFLD疾病演變,又可以緩解脂肪變性及肝纖維化,其機理暫不明晰,可能與PPARγ的其他亞型有關。
雄激素受體(AR)屬于核受體超家族成員,分布于體內多個組織臟器。由其介導的雄激素在糖脂代謝過程中發揮著重要作用。AR可以提高雄激素的釋放,從而加強對肝內硬脂酰輔酶A去飽和酶1、脂蛋白酯酶、脂肪酸合成酶、乙酰輔酶A羧化酶等多個脂代謝關鍵酶的調控,維持脂肪合成與分解的穩態[41]。另外,雄激素可以降低腫瘤壞死因子α、白介素6、白介素1β的表達水平[42],減輕炎癥因子對肝細胞的損害。山楂作用于AR靶點,可從調控脂代謝及炎癥反應途徑產生治療作用。
NOS3又稱內皮型一氧化氮合酶(eNOS),是人體內合成一氧化氮(NO)的關鍵性合成酶之一[43],尤其合成的NO在肝臟損傷時脂質過氧化和氧化應激反應中占有重要地位,過量合成的NO會破壞NO與O2-的平衡,生成過氧化亞硝酸陰離子,繼而造成不飽和脂肪酸、膽固醇、超氧化物歧化酶的氧化[44],加劇氧化應激程度,造成嚴重后果。故而山楂作用于eNOS靶點,可減輕NAFLD時的氧化應激反應。
二肽基肽IV(DPP4)既往研究多集中于治療2型糖尿病的作用。但近年來研究發現[45],DPP4還參與多種慢性肝病的發生發展,其中就包括NAFLD。DPP4參與NAFLD的機制與其促進胰高血糖素樣肽-1(GLP-1)降解有關[46],GLP-1可以提高機體對胰島素的敏感性,減少肝臟脂肪沉積以及調節肝臟脂肪酸代謝[47]。而DPP4的高表達會導致GLP-1的大量失活,導致上述生物過程的失控,所以抑制DPP-4可以改善肝細胞脂肪變性,山楂作用于該靶點,可能也扮演著DPP-4抑制劑的角色。
PRSS1在受到炎癥因子的刺激時會繼發磷酸化[48],而磷酸化過程會阻礙胰島素受體底物正常的酪氨酸磷酸化[49],繼而使胰島素受體底物與SH2結構域信號分子結合受阻[50],干擾胰島素信號傳導而誘發胰島素抵抗。凝血因子VII(F7)在NAFLD導致的肝臟損傷時,肝星狀細胞會在損傷部位募集,這一過程會誘導凝血因子的激活,將循環纖維蛋白原轉化為纖維蛋白,并促進血小板聚集[51],參與肝纖維化的形成和肝內結構的重建。這也是抗凝血藥或抗血小板藥能夠治療肝纖維化的機制之一[52]。
MAOB屬于黃素結合蛋白(MAO)的一種亞型[53]。MAO廣泛分布于人體心、肺、肝、腎等器官,能夠通過與氧離子結合催化細胞中的單胺氧化反應[54]在肝臟發生病變時,如NAFLD疾病過程中,在刺激因子的作用下MAO能夠提高膠原與彈性蛋白結合率,形成大量膠原纖維,繼而引發肝纖維化的發生。RELA又稱轉錄因子P65,是NF-κB發揮作用的重要異源二聚體之一[55]。NF-κB通路在機體內會促進肝星狀細胞的增殖,并釋放炎癥因子,從而加速肝纖維化的發展[56]。并且有研究表明,抑制NF-κB通路的信號傳導,可以減輕肝臟的炎癥反應,緩解肝臟損傷[57]。因此推測,山楂可以從調節胰島素抵抗、抗炎、抗纖維化等多個層面對NAFLD形成治療作用。
本研究還通過DAVID平臺,根據FDR<0.01確定了97條相關通路,如HIF-1[58]和TNF[59]信號通路均可引起肝星狀細胞的增殖,誘發肝纖維化。Toll樣受體信號通路對病原相關分子模式和損傷相關分子模式的識別,會激活一系列炎癥級聯反應,所產生的炎癥因子對肝細胞持續刺激,會導致膠原蛋白和基質蛋白在肝內的沉著,引起肝纖維化[60]。胰島素信號通路與NAFLD關系密切,因脂質異常[61]、炎癥反應[62]、轉錄因子X-Box結合蛋白1表達增加[63]等,導致胰島素信號傳導障礙,繼而引發的胰島素抵抗,不僅是“二次打擊”假說的核心[64],而且也被“多重打擊”學說認為是關鍵因素之一[65],所以對相關通路的調控也是山楂治療NAFLD的關鍵步驟。
綜上,本研究共發現6種主要活性成分和治療過程中的148個關鍵靶點以及97條關鍵通路,結果與已有文獻結論基本吻合,具有一定科學性,可為下一步的實驗提供參考與借鑒。

