平衡常數在高中化學平衡理論教學中的應用
羅 平,孫慧麗,祝可一
(新疆師范大學附屬中學,新疆 烏魯木齊 830054)
化學平衡常數是用于定量表征化學反應限度的熱力學常數。它在課標中提出了如下的要求:“知道化學平衡常數的含義,能利用化學平衡常數計算反應的轉化率”。高考考試大綱中的要求是:“了解化學平衡常數(K)的含義,能利用化學平衡常數進行相關計算”。在教學中用平衡常數分析問題和解決問題不僅符合課程標準理念,而且滿足高考考試大綱中的能力要求。
1 理解關于平衡移動的口訣


用水解平衡常數(Kh)也可以幫助理解“越稀越水解”這一口訣。
2 理解溶質粒子同時存在電離和水解時溶液的酸堿性
當溶液中的溶質粒子同時存在電離和水解時,溶液的酸堿性取決于電離程度和水解程度的相對強弱。單純的記憶給學生的認知帶來困惑,對學生記憶帶來負擔。引入平衡常數同樣可以幫助學生很好理解。
2.1 混合溶液
例題1.在濃度均為0.1mol/L的醋酸和醋酸鈉混合溶液中溶液的c(CH3COOH)_____c(CH3COO-)。(填“<”、“>”或“=”,下同),例題2.在濃度均為0.1mol/L的HCN和NaCN混合溶液中溶液的c(HCN)_____c(CN-)。
在濃度均為0.1mol/L的醋酸和醋酸鈉混合溶液中存在著醋酸的電離平衡和醋酸根離子的水解平衡:

由此可以得出如下結論:
(1)在同濃度的醋酸和醋酸鈉混合溶液中是以醋酸的電離為主,溶液顯酸性。
(2)由HCN的Ka≈10-6,可推知CN-的Ka≈10-4,水解程度強于電離程度,混合溶液顯堿性。
(3)在同濃度的氨水和氯化銨混合溶液中是以NH3·H2O的電離為主,溶液顯堿性。
2.2 弱酸酸式鹽溶液
(1)查表可知,碳酸的電離平衡常數為:Ka1=4.3×10-7,Ka2=4.3×10-11
在NaHCO3溶液中
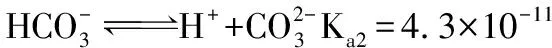
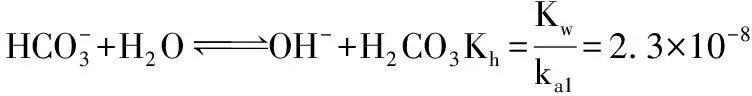
水解程度強于電離電離程度,NaHCO3溶液呈堿性。
(2)同理可知,在NaHSO3溶液中電離平衡常數Ka2=1.02×10-7,水解平衡常數Kh=6.5×10-13,電離程度強于水解程度,NaHSO3溶液呈酸性。
3 理解分布曲線圖
很多習題借助物質的量分數(δ)與溶液 pH曲線來綜合考察學生,從平衡常數的角度能很好地分析并解決問題。如下題:
例題3:常溫下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物質的量分數(分布系數)隨pH變化的關系如圖所示。下列表述不正確的是( )


B.在0.1mol/LNaHA溶液中,各離子濃度大小關系為:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)

D.將等物質的量的NaHA、Na2A溶于水中,所得溶液pH恰好為4.2
對于此類題目,如能了解用平衡常數表示分布系數的方法,就變得很直觀了。
對于題給弱酸H2A(c0代表H2A的分析濃度)存在如下的兩步電離。
(1)
(2)
在H2A溶液隨著pH變化的過程中始終存在著如下物料守恒:
c0=c(H2A)+ c(HA-)+c(A2-)
(3)
同理可得:
通過以上的推導分析,可以得出如下結論:
ⅠδH2A+δHA-δ(A2-)=1,分布系數(δ)決定于該酸堿物質的性質和溶液的pH,而與其總濃度(或分析濃度c0)無關。
Ⅱ兩步電離的Ka相差較大的時候,所有物料形式共存不明顯。
ⅢpH=pKa1時,溶液中c(H2A)=c(HA-),pH=pKa2時,c(HA-)=c(A2-)。
結合上述分析,例題3中D項描述錯誤。
4 分析特殊反應
實驗室吸收和檢驗H2S氣體的優良試劑是硫酸銅溶液,能發生如下反應:
CuSO4+H2S=CuS↓+H2SO4。在這個反應中出現了弱酸(H2S)制強酸(H2SO4)的反常情況。可以從平衡常數的角度來分析該反應,幫助學生理解。
溶液中存在這個平衡:Cu2++H2S=CuS↓+2H+
查表可知(25℃)Ka1=9.5×10-8,Ka2=1.3×10-14,Ksp=1.27×10-36。
代入數據可知上述反應的平衡常數K=9.7×1014≥105,反應非常徹底。
從上面的分析可以看出,在教學中引入平衡常數可以為學生提供理性分析的思維“支架”,降低學習難度,還能體現化學研究的過程與方法,有助于實現新課程提升學生核心素養的宗旨。

